Доклады Российской академии наук. Науки о жизни, 2020, T. 493, № 1, стр. 400-403
РАЗЛИЧИЯ В РАБОТЕ ФЕРМЕНТОВ DROSHA И DICER В ОБРАЗЦАХ КОЛОРЕКТАЛЬНОГО РАКА И НОРМАЛЬНОЙ ТКАНИ ТОЛСТОЙ КИШКИ
М. Ю. Шкурников 1, *, С. А. Нерсисян 2, 3, А. Ш. Осепян 3, Д. В. Мальцева 2, 4, Е. Н. Князев 4, **
1 Московский научно-исследовательский онкологический институт имени П.А. Герцена – филиал федерального государственного бюджетного учреждения “Национальный медицинский исследовательский центр радиологии” Министерства здравоохранения Российской Федерации
Москва, Россия
2 Факультет биологии и биотехнологии, Национальный иccледовательский университет “Высшая школа экономики”
Москва, Россия
3 Механико-математический факультет, Московский государственный университет имени М.В. Ломоносова
Москва, Россия
4 Федеральное государственное бюджетное учреждение науки Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
* E-mail: mshkurnikov@gmail.com
** E-mail: knyazevevg@gmail.com
Поступила в редакцию 24.03.2020
После доработки 31.03.2020
Принята к публикации 31.03.2020
Аннотация
Клеточная линия колоректальной аденокарциномы человека Caco-2 часто используется в качестве модели здорового эпителия кишечника, в том числе в работах по изучению микроРНК. Работа ферментов Drosha и Dicer является неотъемлемой частью процесса образования микроРНК. Неточности в работе этих ферментов приводят к изменению нуклеотидных последовательностей микроРНК с образованием новых изоформ, что в свою очередь может изменять внутриклеточные регуляторные механизмы. В рамках настоящего исследования было показано, что количественные оценки неточностей работы ферментов значимо различаются между образцами нормальной ткани толстой кишки и злокачественных колоректальных опухолей.
Клеточные модели кишечного барьера in vitro позволяют изучать различные биологические аспекты, включая барьерную, транспортную, секреторную функции эпителия кишечника, взаимодействие с микробиомом и особенности биологии клеток в нормальных и патологических условиях. Использование в качестве моделей человеческих органов иммортализованных опухолевых клеточных линий, например, клеток колоректальной аденокарциномы человека Caco-2 как модели кишечного барьера [1], позволяет получать хорошо воспроизводимые стандартизованные результаты, исключая вклад множества трудно учитываемых факторов, которые имеются в полноценном живом организме, и снижая вариабельность, присущую первичным культурам клеток [2]. Добавление внеклеточного матрикса и циркуляции питательной среды в микрофлюидных устройствах дополнительно приближает микроокружение моделей барьера к реальным условиям [3]. Однако при изучении биологических процессов на подобных моделях всегда следует помнить о возможных отличиях опухолевых клеток от нормальных.
В настоящее время активно изучается роль микроРНК в регулировании кишечного барьера. МикроРНК – это короткие молекулы РНК длиною порядка 22 нуклеотидов, играющие ключевую роль в процессе РНК-интерференции [4]. Их важнейшая функция заключается в посттранскрипционном подавлении экспрессии генов-мишеней, происходящем за счет комплементарного связывания микроРНК с 3'-нетранслируемой областью целевой мРНК, приводящего к блокированию дальнейшей трансляции и/или деградации мРНК [5].
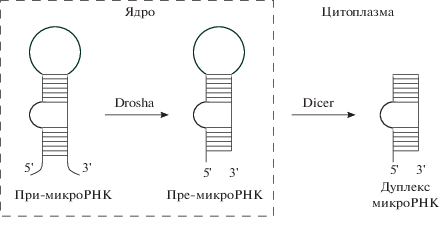
Процесс образования микроРНК состоит из нескольких этапов. На первом этапе в результате транскрипции образуется молекула при-микроРНК, имеющая структуру шпильки. На следующем этапе созревания внутриядерный фермент Drosha связывается с при-микроРНК и производит разрезание неспаренных концов молекулы с образованием пре-микроРНК [6]. Наконец, после транспортировки пре-микроРНК в цитоплазму фермент Dicer производит разрезание петли шпильки пре-микроРНК, в результате чего образуется две молекулы микроРНК [7], см. рис. 1. Неточность работы двух указанных ферментов приводит к образованию так называемых изоформ микроРНК (isomiRs) – молекул, отличающихся от канонической микроРНК на 1–3 нуклеотидных основания с концов последовательности [8]. Важность учета этих молекул заключается в том, что зачастую неканоническая изоформа микроРНК может преобладать в клетке [9] и приводить к существенному изменению списка генов-мишеней микроРНК [10, 11].
В настоящем исследовании описанные эффекты были изучены с помощью анализа данных профиля изоформ микроРНК здоровых и опухолевых тканей толстой кишки. Для этого были использованы результаты анализа микроРНК с помощью секвенирования нового поколения в 16 биологических образцах из проекта The Cancer Genome Atlas Colon Adenocarcinoma (TCGA-COAD) [12]. Образцы были получены из здоровых тканей и злокачественных опухолей толстой кишки, по два образца у каждого из восьми пациентов. Результаты секвенирования микроРНК были получены в виде таблицы экспрессий изоформ микроРНК, содержащей информацию о количестве ридов, соответствующих каждой изоформе (количества были нормированы на миллион выровненных ридов).
Из анализа были исключены слабо экспрессированные изоформы микроРНК, а именно изоформы, средняя экспрессия которых была меньше 100 ридов на миллион выровненных. Для сравнения профилей экспрессии изоформ микроРНК между здоровыми и патологическими тканями, была проведена агломеративная иерархическая кластеризация образцов методом Варда [13] на основе данных наиболее ярко экспрессированных изоформ (средняя экспрессия больше 1000 ридов на миллион выровненных). Два мажорных кластера образцов оказались полностью согласованными с клинической характеристикой тканей.
Для исследования роли неточностей в работе ферментов Drosha и Dicer в здоровых и опухолевых тканях были составлены таблицы, содержащие информацию о суммарном количестве ридов на миллион выровненных по каждому образцу для каждого значения отступа от канонической формы микроРНК. Отступы с 5'-конца 5'-цепи микроРНК и с 3'-конца 3'-цепи микроРНК были отнесены к неточностям в работе Drosha, тогда как отступы с 3'-конца 5'-цепи и с 5'-конца 3'-цепи были отнесены к неточностям в работе Dicer. Построенные таблицы были разделены на две части, отвечающие за образцы здоровых тканей и за образцы опухолей. Далее значения каждой из таблиц были нормированы с целью приведения к процентной шкале.
Полученные данные отражены на рис. 2а, 2б (значения отступов приведены в направлении от концов к петле шпильки).
Рис. 2.
Количественные оценки неточностей работы в здоровых и опухолевых тканях фермента Drosha (а) и фермента Dicer (б). Вертикальные отрезки на концах столбиков обозначают стандартное отклонение.
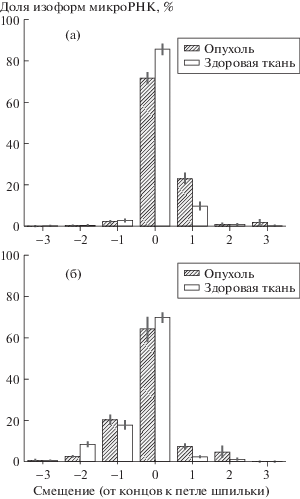
Видно, что в целом внутриядерная обработка микроРНК ферментом Drosha проходит с меньшим процентом ошибок по сравнению с цитоплазматической обработкой ферментом Dicer. Также интерес представляет смещение неточностей работы Drosha в сторону петли шпильки на фоне смещенности отступов Dicer в сторону концов шпильки. Таким образом, оба фермента в основном работают на укорачивание молекулы микроРНК. Сравнение данных образцов здоровых и опухолевой тканей с помощью U-критерия Манна–Уитни показало, что в патологических клетках происходит существенное изменение частот в вариантах работы Drosha и Dicer. Так, статистически значимыми оказались различия в работе Drosha при значениях смещения 0, 1 и 3 (p-значения равны 4.69 × 10–4, 4.69 × 10–4 и 2.69 × 10–3 соответственно) и в работе Dicer при значениях смещения –2, 1, 2 (p-значения равны 4.69 × 10–4, 4.69 × 10–4 и 6.79 × 10–3 соответственно).
Таким образом, процесс образования изоформ микроРНК, связанный с деятельностью белков Drosha и Dicer, имеет значимые различия между здоровыми и опухолевыми тканями толстой кишки. Эти данные следует учитывать при исследовании роли микроРНК в регуляции функциональной активности здорового эпителия кишечника, в том числе везикулярного транспорта [14, 15], с использованием линейных клеток колоректальной аденокарциномы человека. При выборе и разработке методов обнаружения микроРНК, а также при анализе генов-мишеней данных микроРНК и изменения их экспрессии рекомендуется учитывать набор существующих изоформ микроРНК.
Список литературы
Nikulin S.V., Knyazev E.N., Gerasimenko T.N., et al. // Bull. Exp. Biol. Med. 2018. V. 166. № 1. P. 35–38.
Nikulin S.V., Knyazev E.N., Gerasimenko T.N., et al. // Mol. Biol. 2019. V. 53. № 3. P. 411–418.
Bein A., Shin W., Jalili-Firoozinezhad S., et al. // Cell. Mol. Gastroenterol. Hepatol. 2018. V. 5. № 4. P. 659–668.
Knyazev E.N., Samatov T.R., Fomicheva K.A., et al. // Bull. Exp. Biol. Med. 2016. V. 161. № 1. P. 112–115.
Skurnikov M.Y., Makarova Y.A., Knyazev E.N., et al. // Bull. Exp. Biol. Med. 2016. V. 160. № 5. P. 632–634.
Lee Y., Ahn C., Han J., et al. // Nature. 2003. V. 425. № 6956. P. 415–419.
Hutvágner G., McLachlan J., Pasquinelli A.E., et al. // Science. 2001. V. 293. № 5531. P. 834–838.
Morin R.D., O’Connor M.D., Griffith M., et al. // Genome Res. 2008. V. 18. № 4. P. 610–621.
Loher P., Londin E.R., Rigoutsos I. // Oncotarget. 2014. V. 5. № 18. P. 8790–8802.
Telonis A.G., Loher P., Jing Y., et al. // Nucleic Acids Res. 2015. V. 43. № 19. P. 9158–9175.
Mercey O., Popa A., Cavard A., et al. // FEBS Lett. 2017. V. 591. № 5. P. 693–705.
Cancer Genome Atlas Network // Nature. 2012. V. 487. № 7407. P. 330–337.
Murtagh F., Legendre P. // J. Classif. 2014. V. 31. № 3. P. 274–295.
Moisenovich M., Tonevitsky A., Maljuchenko N., et al. // Histochem. Cell Biol. 2004. V. 121. № 6. P. 429–439.
Samatov T.R., Shkurnikov M.U., Tonevitskaya S.A., et al. // Prog. Histochem. Cytochem. 2015. V. 49. № 4. P. 21–29
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни