Доклады Российской академии наук. Науки о жизни, 2020, T. 493, № 1, стр. 408-412
РЕКОМБИНАНТНЫЙ АНАЛОГ БЕЛКА ЧЕЛОВЕКА SLURP-1 ТОРМОЗИТ РОСТ КЛЕТОК ГЛИОМ U251 MG И A172
М. А. Шулепко 1, М. Л. Бычков 1, Е. Н. Люкманова 1, *, академик РАН М. П. Кирпичников 1, 2
1 Федеральное государственное бюджетное
учреждение науки Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук
Москва, Россия
2 Биологический факультет Московского государственного университета имени М.В. Ломоносова
Москва, Россия
* E-mail: ekaterina-lyukmanova@yandex.ru
Поступила в редакцию 13.03.2020
После доработки 16.04.2020
Принята к публикации 16.04.2020
Аннотация
Никотиновый ацетилхолиновый рецептор альфа-7 типа (α7-nAChR) считается перспективной мишенью для терапии карцином. Ранее нами было показано, что рекомбинантный аналог белка человека SLURP-1 (rSLURP-1), взаимодействуя с α7-nAChR и снижая его экспрессию, эффективно ингибирует рост карцином различного происхождения. Экспрессия α7-nAChR повышена в глиомах по сравнению со здоровым мозгом человека, однако, роль этого рецептора в развитии глиом изучена слабо. В работе впервые показано, что rSLURP-1 значительно ингибирует рост клеток модельных линий глиом U251 MG и А172 до ∼70%, что сравнимо с действием α-бунгаротоксина, селективного ингибитора α7-nAChR. Полумаксимальные эффективные концентрации действия rSLURP-1 на клетки U251 MG и A172 составили 2.82 ± 0.2 и 8.9 ± 0.3 нМ соответственно. Совместная инкубация клеток U251 MG с rSLURP-1 и ингибитором nAChR мекамиламином приводила к ослаблению антипролиферативной активности rSLURP-1, что указывает на nAChR как на мишень действия rSLURP-1 в глиомах.
Глиомы являются наиболее распространенными первичными опухолями головного мозга. Несмотря на использование современных подходов лечения, сочетающих хирургическую резекцию первичной опухолевой ткани, лучевую и химиотерапию, средняя выживаемость пациентов с глиомами составляет всего 12–15 месяцев [1]. Низкая эффективность терапии глиом обуславливает актуальность поиска новых молекулярных мишеней и разработку новых действующих на них соединений.
Одним из перспективных направлений для разработки новых противоопухолевых препаратов является регуляция работы никотиновых ацетилхолиновых рецепторов (nAChR), в особенности, подтипа, состоящего из пяти одинаковых α7 субъединиц (α7-nAChR) [2]. Рецепторы этого подтипа вовлечены в процессы регуляции пролиферации, миграции и апоптоза раковых клеток, а экспрессия гена CHRNA7, кодирующего α7 субъединицу nAChR, повышена в клетках карцином [2]. Кроме того, экспрессия гена CHRNA7 повышена в глиомах по сравнению с тканями здорового мозга человека [3]. Однако, участие nAChR в возникновении и развитии глиом изучено слабо.
SLURP-1 является секретируемым белком, экспрессирующимся в эпителии человека [4] и принадлежит семейству трехпетельных белков Ly6/uPAR [5]. Снижение экспрессии гена SLURP-1 наблюдается при карциномах толстой кишки [6] и легкого [7], в кератиноцитах человека при онкогенной трансформации, вызванной нитрозаминами NNK и NNN, содержащимися в табаке [8], а также в меланомах [9]. В то же время, повышенная концентрация эндогенного SLURP-1 в крови пациентов с раком поджелудочной железы коррелирует с большим временем жизни пациентов после хирургического удаления первичной опухоли [10]. Ранее нами было показано, что рекомбинантный аналог белка человека SLURP-1 (rSLURP-1) является селективным негативным аллостерическим модулятором α7-nAChR [11], подавляет рост клеток карцином кожи, кишечника и легкого [12, 13], а также снижает экспрессию α7-nAChR в раковых клетках [12].
В настоящей работе мы исследовали способность препарата rSLURP-1 ингибировать рост клеток модельных глиом U251 MG и А172 (НИИ Цитологии, Россия) (рис. 1). Для этого клетки глиом культивировали в среде IMDM и DMEM соответственно (ПанЭко, Россия) с добавлением 10% эмбриональной бычьей сыворотки (Hyclone, Великобритания). Влияние rSLURP-1 на число жизнеспособных клеток изучали при помощи теста на активность митохондриальной сукцинатдегидрогеназы (МТТ-тест). Для этого к клеткам добавляли МТТ (0.1 мг/лунка планшета) и инкубировали в течение 4 ч. МТТ восстанавливался до нерастворимого формазана, после чего кристаллы формазана растворяли в кислом изопропаноле. Активность митохондриальной сукцинатдегидрогеназы определяли по поглощению в лунках планшета при 540 нм с выравниванием фона при 650 нм на планшетном ридере Bio-Rad 680. Антипролиферативный эффект rSLURP-1 был также сопоставлен с эффектом α-бунгаротоксина (α-Bgtx), специфического ингибитора α7-nAChR. Для этого клетки высевали в 96-луночные планшеты (5 × 103 клеток/лунка планшета), культивировали 24 ч, после чего добавляли 1 мкM α-Bgtx из стока в воде или 1 мкM rSLURP-1 из стока в 100% ДМСО и дополнительно инкубировали 24–96 ч. Конечная концентрация ДМСО не превышала 0.1% и не влияла на число жизнеспособных клеток, что было подтверждено дополнительными экспериментами. Каждые 24 ч среду в лунках планшета меняли на новую, содержащую те же количества веществ. Было показано, что при инкубации в течение 24 и 48 ч эффект rSLURP-1 на рост клеток U251 MG был незначительным. Однако более продолжительная инкубация клеток с rSLURP-1 в течение 72 ч приводила к снижению числа жизнеспособных клеток до ∼76% относительно контрольного уровня (рис. 1). Инкубация клеток А172 с rSLURP-1 сокращала число жизнеспособных клеток до ∼93, ∼78 и ∼73% от контрольного уровня при инкубации в течение 24, 48 и 72 ч соответственно (рис. 1). Эффект rSLURP-1 на пролиферацию клеток U251 MG и А172 был сопоставим с эффектом α-Bgtx (рис. 1).
Рис. 1.
Влияние α-Bgtx и rSLURP-1 на пролиферацию клеток глиом U251 MG и А172 при разном времени инкубации. Клетки инкубировали с 1 мкМ α-Bgtx и rSLURP-1 в течение 24–96 ч и анализировали влияние препаратов на количество жизнеспособных клеток при помощи МТТ-теста (n = 3–6). # (p < 0.05), ## (p < 0.01), ### (p < 0.001) и #### (p < 0.0001) означает достоверное отличие групп данных от контроля согласно одностороннему тесту ANOVA с последующим Dunnet’s/hoc тестом. 100% жизнеспособных клеток соответствует необработанным клеткам (контроль, пунктирная линия).

Для более детальной характеризации активности rSLURP-1 на клетках U251 MG и А172 были построены кривые доза-эффект при инкубации клеток с рекомбинантным белком в течение 72 ч (рис. 2а). Для клеток U251 MG полумаксимальная эффективная концентрация (ЕС50) составила 2.82 ± 0.20 нМ для rSLURP-1 и 0.24 ± 0.02 нМ для α-Bgtx (рис. 2а, табл. 1). Для клеток А172 ЕС50 составила 8.9 ± 0.3 нМ и 1.3 ± 0.2 нМ для rSLURP-1 и α-Bgtx соответственно (рис. 2а, табл. 1). Таким образом, rSLURP-1 ингибирует пролиферацию клеток глиом с ЕС50, лежащей в наномолярном диапазоне, но менее эффективно, чем α-Bgtx. Наблюдаемые различия в антипролиферативной активности rSLURP-1 и α-Bgtx могут объясняться тем, что токсин ингибирует ток через канал α7-nAChR с большей эффективностью, чем rSLURP-1, кроме того, α-Bgtx связывается с α7-nAChR необратимо [11]. Другим объяснением может быть активация различных внутриклеточных сигнальных путей под действием rSLURP-1 и α-Bgtx. Предполагается, что антипролиферативная активность rSLURP-1 может быть обусловлена регуляцией α7-nAChR не только по инотропному пути, связанному с открытием/закрытием канала рецептора, но и по метаботропному механизму [4, 12, 13].
Рис. 2.
Анализ антипролиферативного эффекта α-Bgtx и rSLURP-1 на клетках глиом U251 MG и А172 (а). Влияние различных концентраций α-Bgtx и rSLURP-1 на рост клеток U251 MG и А172. Клетки инкубировали 72 ч с различными концентрациями α-Bgtx или rSLURP-1, после чего определяли количество клеток МТТ-тестом (n = 3–6). (б). Влияние неспецифического ингибитора nAChR мекамиламина (Мес) на антипролиферативный эффект rSLURP-1 на клетках U251 MG (n = 3–6). # (p < 0.05) означает отличие групп данных от контроля согласно одностороннему тесту ANOVA с последующим Dunnet’s/hoc тестом. * (p < 0.05) означает отличие групп данных и “rSLURP-1” по одностороннему тесту ANOVA с последующим Dunnet’s/hoc тестом. 100% жизнеспособных клеток соответствует необработанным клеткам (контроль, пунктирная линия).
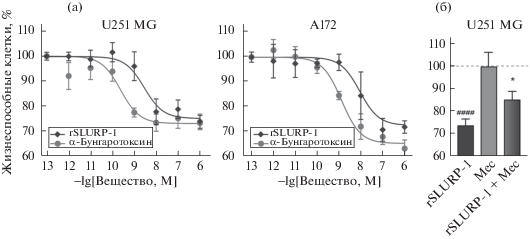
Таблица 1.
Параметры антипролиферативного эффекта rSLURP-1 и α-Bgtx на клетках глиом U251 MG и A172
| Линия клеток | α-Bgtx ЕС50, нM | А0, % | rSLURP-1 ЕС50, нM | А0, % |
|---|---|---|---|---|
| U251 MG | 0.24 ± 0.02 | 73.8 ± 2.6 | 2.82 ± 0.20 | 76.0 ± 2.0 |
| A172 | 1.3 ± 0.2 | 65.8 ± 2.0 | 8.9 ± 0.3 | 70.1 ± 3.3 |
Чтобы подтвердить, что антипролиферативный эффект rSLURP-1 в клетках глиом опосредуется nAChR, мы использовали неспецифический ингибитор nAChR – мекамиламин (Mec). Для изучения влияния мекамиламина на антипролиферативный эффект rSLURP-1 клетки U251 MG прединкубировали с 1 мкМ мекамиламина в течение получаса, после чего добавляли к клеткам 1 мкМ rSLURP-1 и инкубировали дополнительно в течение 72 ч. Мекамиламин сам по себе существенно не влиял на рост клеток U251 MG, однако, при совместном применении с rSLURP-1 число жизнеспособных клеток значительно возрастало по сравнению с клетками, обработанными только rSLURP-1 (рис. 2б). Это подтверждает наше предположение о вовлечении nAChR в антипролиферативную активность rSLURP-1.
Поскольку rSLURP-1 селективно взаимодействует с α7-nAChR [11], и именно этот рецептор предполагается мишенью действия рекомбинантного белка в раковых клетках [12, 13], мы провели сравнительный анализ экспрессии генов CHRNA7 и SLURP1 в клетках глиомы U251 MG и нормальных астроцитах (рис. 3). Для этого из клеток U251 MG и нормальных астроцитов (Cell Applications, США) выделяли суммарную РНК при помощи реактива Extract RNA (Evrogen, Россия). РНК обрабатывали ДНКазой I (Sigma, США), очищали при помощи набора Clean RNA Standard (Evrogen) и синтезировали кДНК с помощью набора Mint c DNA synthesis kit (Evrogen). ПЦР в реальном времени с полученной кДНК и специфическими праймерами (табл. 2) проводили с помощью готового набора HSqPCRmix (Evrogen) на амплификаторе Roche Light Cycler 96. Данные анализировали при помощи программы Lightcycler SW. Экспрессию целевых генов нормировали на экспрессию генов домашнего хозяйства β-ACTIN, GPDH и RPL13a. Было обнаружено, что в клетках U251 MG экспрессия гена CHRNA7 повышена по сравнению с нормальными астроцитами (рис. 3). В то же время, нам не удалось выявить экспрессию гена SLURP1 ни в нормальных астроцитах, ни в клетках глиомы U251 MG (рис. 3), что согласуется с данными [3].
Рис. 3.
Сравнительный анализ экспрессии генов CHRNA7 и SLURP1 в клетках глиомы U251 MG и нормальных астроцитах по данным ПЦР в реальном времени. * означает достоверное отличие между группами данных согласно двустороннему t-тесту.

Таблица 2.
Праймеры, использованные для ПЦР в реальном времени
| Ген | Прямой праймер | Обратный праймер | Ампликон, п.н. |
|---|---|---|---|
| β-actin | CATGTACGTTGCTATCCAGGC | CTCCTTAATGTCACGCACGAT | 88 |
| GPDH | ACAACTTTGGTATCGTGGAAGG | GCCATCACGCCACAGTTTC | 73 |
| RPL13a | TCAAAGCCTTCGCTAGTCTCC | GGCTCTTTTTGCCCGTATGC | 104 |
| CHRNA7 | AATGACTCGCAACCACTCACC | TCTGTCCAAGACATTTGCAGCC | 116 |
| SLURP-1 | AACAGGTCACAGTCAGAGGAGG | CTCGGAAGCAGCAGAAGATCAG | 280 |
Интересно, что существенный антипролиферативный эффект rSLURP-1 на клетках карцином толстой кишки, кожи, груди и легкого был заметен уже после 24 ч инкубации с препаратом [12, 13]. Для раковых клеток кожи и легкого наблюдалась заметная секреция эндогенного SLURP-1 во внеклеточное пространство уже после 1 ч инкубации с рекомбинантным препаратом, что, вероятно, приводит к значительному локальному увеличению концентрации SLURP-1 и межклеточной ауто/паракринной сигнализации [12, 13]. Можно предположить, что замедленный эффект действия rSLURP-1 на клетках глиом, наблюдающийся только после 48 ч, связан с отсутствием экспрессии эндогенного SLURP-1, и как следствие невозможностью быстро увеличить концентрацию SLURP-1 во внеклеточном пространстве. Вероятно, отсроченный эффект rSLURP-1 на клетках глиом скорее связан не с прямым взаимодействием рекомбинантного белка с рецептором, а с изменениями в экспрессии различных регуляторных молекул, вовлеченных в контроль клеточной пролиферации. Эти изменения могут происходить в результате активации различных внутриклеточных сигнальных каскадов в несколько этапов, как это было показано для другого Ly6/uPAR белка человека Lynx1 [14].
Таким образом, в настоящей работе впервые показано, что rSLURP-1 в наномолярных концентрациях ингибирует рост клеток глиом U251 MG и А172, и установлено, что активность рекомбинантного белка связана с nAChR. Полученные данные указывают на необходимость дальнейших исследований антипролиферативного действия rSLURP-1 и перспективность разработки препаратов на основе этого белка для терапии глиом.
Список литературы
Ostrom Q.T., Gittleman H., Truitt G., et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2011–2015 // Neuro-Oncol. 2018. V. 20. iv1–iv86.
Wang S., Hu Y. α7 nicotinic acetylcholine receptors in lung cancer // Oncol. Lett. 2018. V. 16. P. 1375–1382.
The UCSC Xena platform for public and private cancer genomics data visualization and interpretation | bioRxiv
Chernyavsky A.I., Arredondo J., Galitovskiy V., et al. Upregulation of nuclear factor-κB expression by SLURP-1 is mediated by α7 -nicotinic acetylcholine receptor and involves both ionic events and activation of protein kinases // Am. J. Physiol.-Cell Physiol. 2010. V. 299. P. 903–911.
Loughner C.L., Bruford E.A., McAndrews M.S., et al. Organization, evolution and functions of the human and mouse Ly6/uPAR family genes // Hum. Genomics. 2016. V. 10. P. 10.
Pettersson A., Nylund G., Khorram-Manesh A., et al. Nicotine induced modulation of SLURP-1 expression in human colon cancer cells // Auton. Neurosci. 2009. V. 148. P. 97–100.
Russo P., Cardinale A., Margaritora S., et al. Nicotinic receptor and tobacco-related cancer // Life Sci. 2012. V. 91. P. 1087–1092.
Arredondo J., Chernyavsky A.I., Grando S.A. SLURP-1 and -2 in normal, immortalized and malignant oral keratinocytes // Life Sci. 2007. V. 80. P. 2243–2247.
Bergqvist C., Kadara H., Hamie L., et al. SLURP-1 is mutated in Mal de Meleda, a potential molecular signature for melanoma and a putative squamous lineage tumor suppressor gene // Int. J. Dermatol. 2018. V. 57. P. 162–170.
Throm V.M., Männle D., Giese T., et al. Endogenous CHRNA7-ligand SLURP1 as a potential tumor suppressor and anti-nicotinic factor in pancreatic cancer // Oncotarget 9. 2018.
Lyukmanova E.N., Shulepko M.A., Kudryavtsev D., et al. Human Secreted Ly-6/uPAR Related Protein-1 (SLURP-1) Is a Selective Allosteric Antagonist of α7 Nicotinic Acetylcholine Receptor // PloS One. 2016. V. 11. e0149733.
Lyukmanova E., Bychkov M., Sharonov G., et al. Human secreted proteins SLURP-1 and SLURP-2 control the growth of epithelial cancer cells via interactions with nicotinic acetylcholine receptors: Actions of human SLURP proteins on cancer cells // Br. J. Pharmacol. 2018. V. 175. P. 1973–1986.
Shulepko M.A., Bychkov M.L., Shlepova O.V., et al. Human secreted protein SLURP-1 abolishes nicotine-induced proliferation, PTEN down-regulation and α7-nAChR expression up-regulation in lung cancer cells // Int. Immunopharmacol. 2020. V. 82. P. 106303.
Bychkov M., Shenkarev Z., Shulepko M., et al. Water-soluble variant of human Lynx1 induces cell cycle arrest and apoptosis in lung cancer cells via modulation of α7 nicotinic acetylcholine receptors // PloS One. 2019. V. 14. e0217339.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


