Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 472-476
Околочасовые ритмы температуры тела у млекопитающих и птиц с разным уровнем обмена веществ
М. Е. Диатроптов 1, *, В. А. Панчелюга 2, М. С. Панчелюга 2, член-корреспондент РАН А. В. Суров 1
1 ФГБУН “Институт проблем экологии и эволюции
им. А.Н. Северцова Российской академии наук”
Москва, Россия
2 ФГБУН “Институт теоретической и экспериментальной биофизики Российской академии наук”
Пущино, Московская область, Россия
* E-mail: diatrom@inbox.ru
Поступила в редакцию 07.04.2020
После доработки 05.06.2020
Принята к публикации 08.06.2020
Аннотация
Проведен анализ динамики внутрибрюшинной температуры тела у двух видов млекопитающих (лабораторные мыши C57Bl/6 и белогрудые ежи Erinaceus roumanicus) и у двух видов воробьиных птиц (обыкновенная зеленушка Chloris chloris и японский перепел Coturnix japonica), имеющих разную массу тела. В суммарных спектрах температуры тела у исследованных видов выделяется одинаковый набор основных гармоник, которые проявляются синхронно у разных особей. Уровень основного обмена у этих видов животных сильно различается, следовательно, период колебаний температуры тела в диапазоне 10–120 мин не определяется внутренними особенностями организма и, предположительно, отражает влияние внешнего биотропного фактора среды.
Околочасовые ритмы (ОР) в диапазоне 20–120 мин были выявлены в динамике многих биологических систем: размерах клеточного ядра, интенсивности синтеза белка, активности ферментов, концентрации гормонов и АТФ, потребления кислорода, pH цитоплазмы [1]. Они обнаружены у бактерий, дрожжей, некоторых других одноклеточных, моллюсков, в клетках млекопитающих. Эти ритмы выявляются как in vivo так и in vitro [1, 2].
В большинстве работ авторы рассматривают ОР только как результат внутренних регуляторных процессов организма или межклеточных взаимодействий [3]. Однако нужно учитывать возможность существования и внешних организаторов и синхронизаторов этих ритмов [4].
Удобный метод регистрации ритмической деятельности организма – исследование динамики температуры тела, которая отражает ритмику сон/бодрствование, двигательную активность, тонус симпатической нервной системы, концентрацию гормонов [5–7]. Считается, что ультрадианная, в том числе и околочасовая, ритмичность температуры тела определяется целиком внутренними механизмами на уровне нервной системы [6, 7].
Цель исследования – выявить основные периоды колебаний температуры тела в 10–120 минутном диапазоне периодов у млекопитающих и птиц, различающихся уровнем обмена веществ.
Выбор экспериментальных животных определялся их мелким размером, при котором показатель относительной поверхности тела выше и, следовательно, больше пассивная теплоотдача, что позволяет выявлять изменения температуры тела в более широком диапазоне периодов. В эксперименте участвовали представители двух классов теплокровных животных. В каждом классе виды различались массой тела, а, следовательно, и уровнем основного обмена. Использовали самцов: лабораторной мыши C57Bl/6 с массой тела 25–30 г, белогрудого ежа (Erinaceus roumanicus) – 1000–1350 г, обыкновенной зеленушки (Chloris chloris) – 26–29 г и японского перепела (Coturnix japonica) – 110–130 г.
Исследования динамики температуры тела мышей проводили в период с 24 сентября по 31 октября 2019 г. (n = 8), ежей с 24 июня по 22 июля 2019 г. (n = 12), перепелов с 19 по 27 июня 2019 г. (n = 6), а зеленушек с 1 по 27 ноября 2019 г. (n = 6). Всех животных содержали в индивидуальных клетках, при этом мыши и зеленушки были разделены на подгруппы, разнесенные на 1.5 км между собой, с целью исключения ольфакторных и акустических каналов связи между подгруппами. Для устранения влияния суточного режима освещения, мышей содержали при постоянном освещении интенсивностью 700–800 лк от источника с цветовой температурой 4200 К. Одну подгруппу зеленушек содержали при естественном освещении, а другую при постоянном искусственном освещении интенсивностью 1200–1400 лк от источника с цветовой температурой 4200 К. Ежей и перепелов содержали при естественном освещении. Температура в помещении, где находились мыши, зеленушки и перепела поддерживалась в пределах 18–22°С. Ежи содержались в неотапливаемом помещении при естественном режиме температуры. Доступ к воде и пище у всех групп был постоянным. Для замены воды, корма и подстилки мышей и зеленушек тревожили раз в неделю, а перепелов и ежей ежедневно, но в разное время суток.
Температуру тела у животных измеряли с частотой 1 раз в минуту при помощи имплантированных внутрибрюшинно датчиков ДТН3-28 (“ЭМБИ РЕСЕРЧ”, Новосибирск.). Внутрибрюшинное внедрение датчиков проводили за 2 недели до проведения эксперимента под золетиловом наркозом (“Virbac Sante Animale”, Франция) вводимого внутримышечно в дозе 7 мг/кг. Процедура эксперимента одобрена комиссией по биоэтике ИПЭЭ РАН протокол № 14 от 15.01.2018.
Для каждого экспериментального животного по данным динамики температуры тела строили спектры мощности на основе быстрого преобразования Фурье (БПФ). Полученные спектры усредняли по каждой группе. На основе усредненных спектров определяли координаты пиков, которые приведены в столбцах I-IV таблицы. У всех исследованных животных спектр флуктуаций температуры тела имеет сходный набор основных гармоник. Т.к. средний уровень температуры тела, а, значит, и интенсивность основного обмена, у этих видов животных различается, можно предположить, что периоды колебаний температуры тела в диапазоне 10–120 мин не определяются внутренними особенностями организма, то есть, собственно уровнем обмена.
Для верификации полученного результата было выполнено исследование тех же временных рядов флуктуаций температуры, но с использованием метода, существенно отличного от спектрального анализа на основе БПФ. Для этого синхронные временные ряды каждой группы животных разбивали на непересекающиеся отрезки определенной длины и почленно суммировали. Длины отрезков или период суммирования изменялся с шагом в 1 мин, начиная с 10-й мин. После этого для всех периодов суммирования вычисляли коэффициент корреляции между всеми возможными для данной группы парами суммарных отрезков – получали вектор значений коэффициентов корреляции. Затем, векторы коэффициентов корреляции вновь почленно суммировали и полученный суммарный вектор сглаживали два раза методом скользящего среднего с использованием пуассоновского окна. После сглаживания спектр нормировался на единицу. Результаты, полученные с использованием такой процедуры суммирования отрезков, представлены на рис. 1. Видно, что выделяются периоды с высокой корреляцией пар суммарных отрезков. Значения таких периодов, соответствующих пикам в спектрах, показанных на рис. 1, приведены в столбцах V–VIII табл. 1.
Рис. 1.
Спектры периодов, для которых наблюдается повышенная корреляция между парами синхронных отрезков, построенных на основе измерений флуктуаций температуры тела зеленушек (а), мышей (б), перепелов (в) и ежей (г).
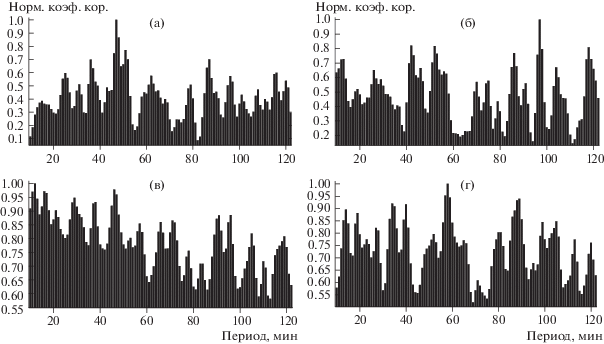
Таблица 1.
Периоды (даны в минутах), выявленные в динамике температуры тела экспериментальных животных, а также в работах [8–10]
| № | Зеленушки | Мыши | Ежи | Перепела | Рис. 1а | Рис. 1б | Рис.1в | Рис. 1г | Двигат. активн. крыс [8] | УСП [9] | СКЗ | МПЗ | OP [10] | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | VII | VIII | IX | X | XI | XII | XIII | XIV | |
| 1 | 10.7 | 10.1 | 9.3, 10.5, 11.1 | 9.9, 11 | 9 | 10.3 | 0T10 | 9.9, 11.3 | ||||||
| 2 | 11.7 | 12.1 | 12.5 | 12.6 | 12 | 12 | 12.3 | 0T8 | 12 | |||||
| 3 | 13.5 | 13.5 | 13 | 14 | 13.8 | 13.6 | 0S7 | 13.3 | ||||||
| 4 | 15.1 | 15.3 | 15.1, 16.3 | 15 | 16 | 15.5 | 0T6 | 14.4 | ||||||
| 5 | 18 | 18 | 18.6 | 18.3 | 18 | 17.95 | 0T5 | 17.7 | 18 | |||||
| 6 | 19.9 | 19.3 | 18.9 | 19.7 | 19 | 19 | 19.84 | 0S5 | 19.3 | |||||
| 7 | 21.2 | 21.2 | 21.3 | 21.8 | 21 | 21.3 | 21.73 | 0T4 | 20.9, 22.8 | 22 | ||||
| 8 | 25 | 25.6 | 24.4 | 25 | 26 | 23 | 25 | 25.77 | 0S4 | 26.3 | 24 | |||
| 9 | 28.4 | 27.7 | 26.3 | 29 | 29 | 27 | 27.5 | 28.36 | 0T3 | 27 | 27, 30 | |||
| 10 | 29.3 | 30.1 | 30.1 | 31 | 30, 32.3 | 32 | НЕТ | 31.03 | 32 | |||||
| 11 | 35.3 | 34.1 | 35.3 | 36 | 35 | 34 | 34.4, 36.9 | 35.57 | 0S3 | 34, 36 | ||||
| 12 | 39.4 | 39.4 | 39 | 38 | 40 | 39.9 | 40 | 41.26 | 2S1 | 39.4 | 40 | |||
| 13 | 42.7 | 42.7 | 42.7 | 43 | 42 | 41.3 | 43 | НЕТ | 42 | |||||
| 14 | 44.5 | 44.5 | 47 | 46 | 46 | 46 | 44.17 | 0T2 | 44.5 | 45 | ||||
| 15 | 51.2 | 48.8 | 51 | 52 | 53 | 52 | 51 | НЕТ | 48.8 | |||||
| 16 | 56.9 | 53.9 | 56.9 | 56 | 57 | 53.4, 56.4 | 55.8 | 53.86 | 0S2 | 55 | ||||
| 17 | 60.2 | 60.2 | 59; 62 | 58 | 60.1 | 60.7 | 59.2, 60.8 | 60 | ||||||
| 18 | 64 | 65 | 66 | 65 | 65 | |||||||||
| 19 | 68.3 | 68 | 70 | 68.5 | 68.3 | 67.8 | ||||||||
| 20 | 73.1 | 73 | 71 | 71 | 72.4 | 73 | 72 | 73.1 | 71 ± 5 | |||||
| 21 | 75 | 75.4 | 75.5 | 77 | 75 | |||||||||
| 22 | 78.8 | 78.8 | 78.8 | 79 | 79 | 78 | 80 | 80.7, 82.3 | 80 | 82 | 80 | |||
| 23 | 85.6 | 85.3 | 85.3 | 87 | 85 | 84 | 85.3 | 85.5 | 86.7 | |||||
| 24 | 90 | 91 | 91 | 89 | 90 | |||||||||
| 25 | 93.1 | 93.1 | 97 | 97 | 96 | 95 | 95.97 | 95 | 95.2 | 93.1 | ||||
| 26 | 101 | 99 | 99.8 | 103 | 100 | |||||||||
| 27 | 108 | 104 | 105 | 105 | 106.3 | 107 | 105 | |||||||
| 28 | 113.8 | 113.8 | 111 | 110 | 113 | 111.7 | 112.3 | |||||||
| 29 | 118 | 119 | 120 | 115.5, 119.9 | 118 | 120 | ||||||||
Можно заметить, что данные периоды, в основном, совпадают с периодами, приведенными в столбцах I–IV табл.
На рис. 1 видно, что при совпадающей частотной структуре спектры зеленушек и мышей имеют амплитуды пиков в диапазоне 0.2–1, в то время как для ежей и перепелов эти значения находятся в диапазоне от 0.55–0.6 до 1. Это связано с тем, что в первом случае исследовались корреляции для пространственно-разнесенных (до 1.5 км) групп животных, а во втором – все животные находились в одном помещении. Между животными, имеющими возможность контактировать между собой, динамика флуктуаций температуры является значительно более синхронной, что и отражает большая степень “тотальной” корреляции суммарных отрезков. Для пространственно-разнесенных животных такая синхронизация отсутствует, поэтому уровень “тотальной” корреляции снижается до незначительных величин, а остаются только пики, принадлежащие найденному нами спектру.
Полученные результаты говорят о синхронности колебаний температуры тела у животных разных экспериментальных групп, живущих изолированно друг от друга и находящихся как при естественном, так и постоянном искусственном освещении. То есть режим освещения не является синхронизатором ОР. Эти факты дают основание предположить, что динамика температуры тела в 10–120-минутном диапазоне периодов отражает влияние некоторого внешнего биотропного фактора среды.
Обычно повышение температуры тела связано с выраженным повышением двигательной активности. Сопоставление результатов работы [8] (столбец IX табл. 1), в которой исследовали ритмы двигательной активности белых крыс, с результатами нашего исследования, показывает хорошее совпадение выявленных частот.
Также необходимо отметить совпадение полученного в настоящей работе спектра периодов с обнаруженным в [9] универсальным спектром периодов (УСП), присутствующим в флуктуациях процессов различной природы (столбец X табл. 1). В [9] показано совпадение УСП с периодами собственных колебаний Земли (СКЗ) (столбцы XI–XII табл. 1). Такое же совпадение имеет место и для периодов, найденных во флуктуациях горизонтальной и вертикальной компонент магнитного поля Земли (МПЗ) (столбец XIII табл. 1). Очень интересным является совпадение ОР, которые приведены в обзоре [10] (столбец XIV табл. 1), со спектром периодов, обнаруженным нами. Как уже отмечалось, существование ОР принято связывать с эндогенными причинами. В таком случае, обнаруженное совпадение может быть связано с “эволюционным импринтингом” внешнего биотропного фактора среды, что в дальнейшем определяет синхронизацию эндогенных ОР с внешними ОР.
На наш взгляд, в качестве такого фактора могут служить СКЗ, периоды которых остаются неизменными на протяжении всей биологической эволюции. Являясь первичным генератором ритма, СКЗ модулируют практически все процессы в среде обитания (микрофлуктуации электрических и магнитных полей, атмосферного давления, флуктуации потока тепловых нейтронов, и т.д.), осуществляя подстройку эндогенных ОР.
Однако еще раз нужно отметить, что в рамках настоящей статьи мы показываем совпадение периодов ОР у исследованных видов животных и внешних факторов среды, а совпадение фазы ритма пока выявлено только между животными одного вида, разнесенными на 1.5 км и изолированных от естественного режима освещения. Тогда как для того, чтобы утверждать, что внешний фактор среды определяет или синхронизирует ОР, необходимо провести сопоставление фаз ОР и этих внешних факторов, а также создать условия экранирования или экспериментального воздействия предполагаемым физическим фактором, что является предметом будущих исследований.
Список литературы
Бродский В.Я. // Изв. АН. Сер. биологическая. 1998. № 3. С. 316–329.
Бродский В.Я. // Биохимия. 2014. Т. 79. № 6. С. 619–632.
Brodsky Y.Y., Zvezdina N.D. // Cell BioI. Int., 2010. V. 34. P. 1199–1204. https://doi.org/10.1042/CBI20100036
Мартынюк В.С., Б.М. Владимирский, Темурьянц Н.А. // Геофизические процессы и биосфера. 2006. Т. 5. № 1. С. 5–23.
Mochizuki T. Klerman E.B., Sakurai T., Scammell T.E. // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2006. V. 291. № 3. P. 533–540. https://doi.org/10.1152/ajpregu.00887.2005
Braulke L.J., Heldmaier G. // Cryobiology. 2010. V. 60. № 2. P. 198–203. https://doi.org/10.1016/j.cryobiol.2009.11.001
Blessing W., Ootsuka Y. // Temperature (Austin). 2016. V. 3. № 3. P. 371–383. https://doi.org/10.1080/23328940.2016.1177159
Мартынюк B.C. // Биофизика. 1998. Т. 43. № 5. С. 789–796.
Panchelyuga V.A., Panchelyuga M.S. // Biophysics. 2015. V. 60. № 2. P. 317–330. https://doi.org/10.1134/S0006350915020141
Ultradian rhythms in life processes. David Lloyd, Ernest L. Rossi (Eds.). Springer-Verlag, 1992, 419 p.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


