Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 468-471
Влияние ионизирующего излучения на когнитивные функции мышей в in vivo моделях болезни Альцгеймера
М. М. Чичёва 1, *, А. В. Мальцев 1, В. С. Кохан 2, член-корреспондент РАН С. О. Бачурин 1
1 Институт физиологически активных веществ Российской академии наук
Черноголовка, Россия
2 Научный центр биомедицинских технологий Федерального медико-биологического агентства России
Москва, Россия
* E-mail: chicheva.mariya@gmail.com
Поступила в редакцию 23.04.2020
После доработки 10.06.2020
Принята к публикации 11.06.2020
Аннотация
В статье представлены данные по влиянию комбинированного ионизирующего излучения (γ-кванты 0.24 Гр, 661.7 кэВ на все тело и 12С 0.18 Гр, 450 МэВ на область головы) на поведение мышей – трансгенных моделей болезни Альцгеймера. Для мышей дикого типа показано достоверное улучшение пространственного обучения и стимуляция ориентировочно-исследовательского поведения под действием облучения. При этом, для облученных мышей с таупатией выявлено анксиолитическое действие и стимуляция ОИП. Также было обнаружено улучшение обучения в тесте распознавания запахов у мышей с церебральным амилоидозом. Негативных эффектов облучения обнаружено не было.
Перспектива межпланетных пилотируемых миссий спровоцировала новую волну исследований влияния ионизирующего излучения (ИИ), в первую очередь, тяжелых заряженных частиц высоких энергий (ТЗЧ) на нервную систему. По данным, полученным марсоходом Curiosity (NASA), в ходе 860-дневной Марсианской миссии суммарная поглощенная доза астронавтами составит 0.27 Гр (~1 Зв с учетом коэффициента качества ИИ). Удивительно, но ряд исследований выявил улучшение контекстуальной и пространственной памяти под влиянием ИИ в подобных дозах [1, 2].
В настоящей работе мы изучаем влияние комбинированного ИИ в составе и дозах, релевантных межпланетным полетам, на когнитивные функции трансгенных животных, моделирующих различные патофизиологические аспекты болезни Альцгеймера (БА). Агрегация бета-амилоида (Aβ) и белка тау являются двумя основными признаками патогенеза БА [3–6]. Ранее были получены результаты по нейтральному эффекту ИИ (1H+ 150 МэВ, 0.1–1.0 Гр) на когнитивные функции, а также на содержание провоспалительных цитокинов у мышей – моделей БА [7]. Острое γ-облучение (100 мГр) также не влияло на агрегацию Aβ и белка тау, а хроническое облучение (1 мГр/день, 300 дней) подавляло нейровоспаление у ApoE-нокаутных мышей [7]. Облучение ядрами 12C (290 МэВ/нуклон, 15 кэВ/мкм) в дозе 50 и 100 мГр не привело к накоплению Aβ и белка тау в гиппокампе [8]. Облучение в дозах 0.1 и 0.5 Гр ядрами 56Fe (1 ГэВ/нуклон) приводило к снижению уровня Aβ в коре и активации микроглии мышей B6C3-Tg [9]. Примечательно, что хроническое γ-облучение в малых дозах рассматривается как физиотерапевтический подход в лечении БА [10, 11], однако для ТЗЧ подобные данные отсутствуют.
Для нашего исследования были сформированы когорты самцов трансгенной линий мышей с церебральным амилоидозом 5xFAD (n = 18), линии TauP301S с τ-патией (n = 19) и соответствующая им по возрасту группа контроля (n = 13). Определение генотипа животных проводилось с помощью метода ПЦР с последующим электрофорезом в агарозном геле. В возрасте трех месяцев каждая группа была разделена на две подгруппы, одна из которых была облучена: γ-квантами на установке GOBO-60 (137Cs, 661.7 кэВ в поглощенной дозе 0.24 Гр) и через 6 ч ядрами 12С на ускорительном комплексе У-70 (0.18 Гр, 450 МэВ; 10.3 кэВ/мкм). Другие подгруппы – контрольные – были подвергнуты имитации облучения.
Средний возраст на момент начала тестирования составил 156 дней. Водный лабиринт Морриса (ЛМ) проводился в классическом исполнении. Тест распознавания запахов представляет собой аналог методики, описанной Pavlis и др. [12]. Выработку условного рефлекса пассивного избегания проводили по ранее описанной методике [2]. Тест “открытое поле” (ОП) выполнялся на установке TruScan (Coulbourn Instruments, США): в течение 3 мин регистрировали параметры вертикально-горизонтальной активности животных. Результаты были обработаны с помощью пакета Statistica (StatSoft, США).
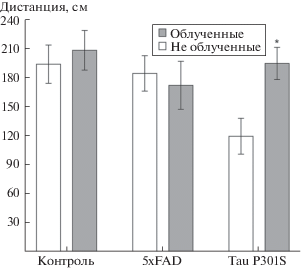
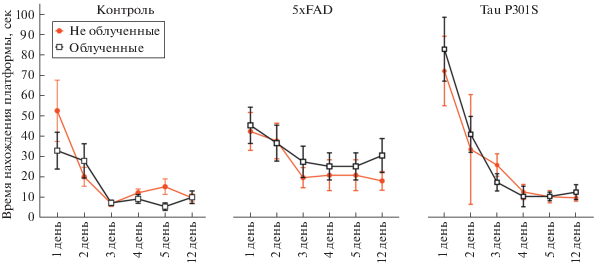
Обучение в ЛМ под воздействием ИИ достоверно улучшается в группе контроля (p5день = 0.014). В тесте ОП для облученной группы TauP301S наблюдается увеличение дистанции, пройденной в центре поля (p = 0.01), уменьшение таковой вне центра (p = 0.02), и увеличение времени, проведенного в центре (p = 0.02), что говорит о снижении уровня ситуативной тревоги. Количество заглядываний в норки достоверно больше в группе облученного контроля (p = 0.005), а время обнюхивания норок больше для двух групп – TauP301S и контрольной (p = 0.02 и p = 0.003), что указывает на стимуляцию ОИП. Облучение оказало стимулирующее влияние на обучение в тесте распознавания запахов линии 5xFAD: была обнаружена тенденция к улучшению распознавания запахов при двухфакторном анализе генотип/облучение (p = 0.09).
Данные когнитивных тестов согласуются между собой при оценке влияния ИИ на группы дикого типа и TauP301S: у облученных животных понижена ситуативная тревога (рис. 2) и стимулировано ОИП (рис. 3). При этом, у облученных мышей дикого типа более эффективно проходило пространственное обучение (рис. 1). Синхронность реакций животных дикого типа и линии TauP301S на облучение может являться следствием того, что тестирование животных TauP301S проводилось до начала симптоматики (которая для гетерозиготных особей начинается от 11 месяцев) таким образом, особи TauP301S могли оказаться ближе к животным дикого типа, чем представители 5xFAD, симптоматика которых во время проведения тестирования была ярко проявлена.
Рис. 1.
Тест “водный лабиринт Морриса”: среднее время нахождения платформы для каждого дня тренировки.
Стимулирующее влияние ИИ на ОИП и пространственное обучение мышей дикого типа хорошо согласуется с ранее полученными данными на крысах [1]. Вместе с тем, стимуляция ОИП как у контрольной, так и у трансгенных линий животных является позитивным эффектом ИИ, так как ОИП часто рассматривается как маркер ненаправленного внимания и коррелирует положительно с когнитивными способностями [1].
Более того, ИИ приводит к улучшению обучения мышей 5xFAD в тесте распознавания запахов, чувствительном к нейрогенезу. Таким образом, мы находим подтверждение ранее высказанной гипотезы об отложенном стимулирующем влиянии ИИ на нейрогенез [2]. Таким образом, результаты облучения в более релевантной [13] дозе и составе ИИ к таковому при реализации межпланетных миссий, указывают на возможные когнитивные преимущества на фоне нейродегенеративного процесса. Дальнейшие исследования необходимы для раскрытия молекулярных механизмов этого феномена.
Список литературы
Kokhan V.S., Shakhbazian E.V., Markova N.A. Psycho-emotional status but not cognition is changed under the combined effect of ionizing radiations at doses related to deep space missions // Behav. Brain Res. 2019. V. 362. P. 311–319.
Kokhan V.S., Anokhin P.K., Belov O.V., Gulyaev M.V. Cortical Glutamate/GABA imbalance after combined radiation exposure: relevance to human deep-space missions // Neuroscience. 2019. V. 416. P. 295–308.
Taylor J. P., Hardy J., Fischbeck K. H. Toxic proteins in neurodegenerative disease // Science. 2002. V. 296. № 5575. P. 1991–1995.
Games D., Adams D., Alessandrini R., Barbour R., Berthelette P., Blackwell C., Carr T., Clemens J., Donaldson T., Gillespie F., et al. Alzheimer-type neuropathology in transgenic mice overexpressing V717F beta-amyloid precursor protein // Nature. 1995. V. 373. № 6514. P. 523–527.
Bachurin S.O., Ustyugov A.A., Peters O., Shelkovnikova T.A., Buchman V.L., Ninkina N.N. Hindering of proteinopathy-induced neurodegeneration as a new mechanism of action for neuroprotectors and cognition enhancing compounds // Dokl Biochem Biophys. 2009. V. 428. P. 235–238.
Hardy J., Selkoe D.J. The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics // Science. 2002. V. 297. № 5580. P. 353–356.
Rudobeck E., Bellone J. A., Szucs A., Bonnick K., Mehrotra-Carter S., Badaut J., Nelson G.A., Hartman R.E., Vlkolinsky R. Low-dose proton radiation effects in a transgenic mouse model of Alzheimer’s disease—Implications for space travel // PLoS One. 2017. V. 12. № 11. P. e0186168.
Wang B., Tanaka K., Ji B., Ono M., Fang Y., Ninomiya Y., Maruyama K., Izumi-Nakajima N., Begum N., Higuchi M., Fujimori A., Uehara Y., Nakajima T., Suhara T., Nenoi M. Low-dose total-body carbon-ion irradiations induce early transcriptional alteration without late Alzheimer’s disease-like pathogenesis and memory impairment in mice // J Neurosci Res. 2014. V. 92. № 7. P. 915–926.
Liu B., Hinshaw R.G., Le K.X., Park M.A., Wang S., Belanger A.P., Dubey S., Frost J.L., Shi Q., Holton P., Trojanczyk L., Reiser V., Jones P.A., Trigg W., Di Carli M.F., Lorello P., Caldarone B.J., Williams J.P., O’Banion M.K., Lemere C.A. Space-like (56)Fe irradiation manifests mild, early sex-specific behavioral and neuropathological changes in wildtype and Alzheimer’s-like transgenic mice // Sci Rep. 2019. V. 9. № 1. P. 12118.
Cuttler J.M., Moore E.R., Hosfeld V.D., Nadolski D.L. Update on a Patient with Alzheimer Disease Treated With CT Scans // Dose Response. 2017. V. 15. № 1. P. 1559325817693167.
Cuttler J.M., Moore E.R., Hosfeld V.D., Nadolski D.L. Treatment of Alzheimer Disease with CT Scans: A Case Report // Dose Response. 2016. V. 14, № 2. P. 1559325816640073.
Pavlis M., Feretti C., Levy A., Gupta N., Linster C. l-DOPA improves odor discrimination learning in rats // Physiol Behav. 2006. V. 87. № 1. P. 109–113.
Bevelacqua J.J., Welsh J., Mortazavi S.M.J. Comments on “New Concerns for Neurocognitive Function during Deep Space Exposures to Chronic, Low Dose Rate, Neutron Radiation” // eNeuro. 2020. V. 7. № 7. P. 295–308.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни