Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 508-512
Гендер-зависимый эффект метилобогащенной диеты матери на экспрессию наследственной absence-эпилепсии и коморбидной депрессии у взрослого потомства крыс линии WAG/Rij
К. Ю. Саркисова 1, *, А. В. Габова 1, Е. А. Федосова 1, А. Б. Шацкова 1
1 Федеральное государственное бюджетное учреждение науки Институт высшей нервной деятельности
и нейрофизиологии Российской академии наук
Москва, Россия
* E-mail: karine.online@yandex.ru
Поступила в редакцию 27.03.2020
После доработки 01.06.2020
Принята к публикации 01.06.2020
Аннотация
В настоящей работе впервые показано, что метилобогащенная диета матери (холин, бетаин, фолиевая кислота, витамин B12, L-метионин, цинк) во время перинатального периода уменьшает экспрессию наследственной absence-эпилепсии и коморбидной депрессии у взрослого потомства крыс линии WAG/Rij. Этот благоприятный эффект материнской диеты больше выражен у самцов по сравнению с самками. Предполагается, что эпигенетические модификации, вызываемые метил-обогащенной диетой матери у потомства на ранних стадиях онтогенеза, являются возможным механизмом, лежащим в основе коррекции генетически обусловленного патологического фенотипа у крыс линии WAG/Rij. Результаты свидетельствуют о том, что метилобогащенная диета матери во время перинатального периода может быть использована для ослабления или предотвращения эпилептогенеза и коморбидных депрессивных расстройств у людей с наследственной предрасположенностью к absence-эпилепсии.
Крысы линии WAG/Rij являются моделью наследственной absence-эпилепсии (АЭ) с коморбидной депрессией [1]. АЭ – неконвульсивная форма эпилепсии, характерным признаком которой является наличие спонтанных генерализованных пик-волновых разрядов (ПВР) на ЭЭГ, сопровождающихся отключением сознания (отсутствии реагирования на внешние стимулы). Первые симптомы АЭ, такие как ПВР на ЭЭГ, и коморбидной депрессии (повышенная иммобильность в тесте вынужденного плавания) появляются у крыс линии WAG/Rij в возрасте 2–3 мес, а в возрасте 6–8 мес патологический фенотип полностью выражен [1, 2]. Несмотря на то, что патологический фенотип у крыс линии WAG/Rij генетически обусловлен, он может быть модифицирован под влиянием ранних средовых воздействий, таких как материнская забота [3]. Исследование с перекрестным воспитанием показали, что высокий уровень материнской заботы приемной здоровой матери Вистар может улучшить патологический фенотип у крыс линии WAG/Rij [4]. Этот положительный эффект проявлялся у взрослых животных, что указывает на то, что в его основе могут лежать эпигенетические механизмы.
Метилирование ДНК является одним из наиболее изученных эпигенетических механизмов. Эпигенетические механизмы регулируют экспрессию генов без изменения последовательности ДНК. Метилирование ДНК вызывает стабильные, но потенциально обратимые изменения в экспрессии генов. Получены доказательства того, что эпигенетические модификации, в частности нарушения метилирования ДНК, могут быть причиной многих неврологических и психических заболеваний у человека и животных, в том числе эпилепсии [5] и депрессии [6]. Для осуществления процесса метилирования ДНК необходимы доноры метильных групп. Паттерн метилирования ДНК формируется на самых ранних стадиях онтогенеза, поэтому в перинатальном периоде он особенно чувствителен к воздействиям окружающей среды, прежде всего к составу материнской диеты. Диета с недостаточным содержанием доноров метильных групп может вызвать нарушения метилирования ДНК и изменение экспрессии генов, приводящих к развитию различных расстройств у потомства [7]. В этой связи особый интерес представляют исследования возможности эпигенетической коррекции генетически обусловленных патологий с помощью метилобогащенных диет (МОД), влияющих на метилирование ДНК и экспрессию генов. Показано, что МОД матери увеличивает уровень метилирования ДНК и уменьшает выраженность патологии у взрослого потомства – повышенной тревожности [8], а также генетически обусловленных конвульсивных припадков [9]. Работы, посвященные исследованию возможности коррекции наследственной АЭ и коморбидной депрессии с помощью МОД матери, отсутствуют.
Цель исследования – выяснить: 1) может ли МОД матери в перинатальном периоде уменьшить проявления наследственной АЭ и коморбидной депрессии у взрослого потомства крыс линии WAG/Rij; 2) является ли эффект МОД матери на потомство гендер-зависимым. Для достижения этой цели самкам крыс линии WAG/Rij предоставляли контрольную диету (КД) или МОД в течение одной недели до беременности, во время беременности и в течение одной недели после рождения детенышей. Использовали следующие метилсодержащие добавки (на 1 кг пищи): холин – 5 г; бетаин – 15 г; фолиевая кислота – 15 мг; витамин В12 – 1.5 мг; L-метионин – 7.5 г; цинк – 150 мг. Метилсодержащие добавки смешивали с 4-зерновой кашей, творогом и свежими яйцами [9]. Выбранная нами метилобогащенная диета показала высокую эффективность в модификации других генетически обусловленных патологических фенотипов – аудиогенных припадков у крыс линии КМ и агути-окраса волосяного покрова у мышей. Коррекция патологических фенотипов сопровождалась изменениями профиля метилирования некоторых генов [9, 10]. Регистрацию ЭЭГ и оценку депрессивноподобного поведения проводили у 7-месячного потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими КД или МОД. Запись ЭЭГ (с 16.00 до 19.00) с фронтальных (AP +2, L 2.5 мм) и затылочных (AP –6, L 4 мм) отделов коры осуществляли в соответствии с ранее описанным методом [3] у свободно передвигающихся животных с помощью 8-канального беспроводного усилителя биопотенциалов BR8V1 (“Texas Instruments”, США). Выраженность симптомов АЭ оценивали по числу, длительности и индексу ПВР [(общая длительность ПВР/время регистрации) × 100%]. Выраженность коморбидной депрессии оценивали в тестах вынужденного плавания и предпочтения 2%-го раствора сахарозы [1]. Статистическую обработку данных проводили с помощью двухфакторного и однофакторного дисперсионного анализа (ANOVA) с последующим определением различий между средними значениями показателей по тесту Ньюмена–Кейлса и критерию U Манна–Уитни с поправкой Бонферрони. Эксперименты проведены в соответствии с международными правилами содержания и обращения с животными (Директива Европейского Сообщества от 22 сентября 2010 г. – 2010/63/EU).
Двухфакторный АNOVA показал значимое влияние МОД на число ПВР [F(1,30) = 9.68, p < < 0.01], их среднюю длительность [F(1,30) = 4.69, p < 0.05] и индекс ПВР [F(1,30) = 9.73, p < 0.01]. У самцов МОД матери вызывала уменьшение числа ПВР и индекса ПВР, но не влияла на среднюю длительность разрядов, а у самок, напротив, вызывала уменьшение средней длительности разрядов и индекса ПВР, но не влияла на число ПВР (табл. 1, А).
Таблица 1.
Влияние МОД матери на проявление АЭ (А) и коморбидной депрессии (Б) у взрослого потомства крыс линии WAG/Rij
| А | ||||
|---|---|---|---|---|
| Показатели | Потомство крыс линии WAG/Rij, рожденное матерями, потреблявшими КД | Потомство крыс линии WAG/Rij, рожденное матерями, потреблявшими МОД | ||
| Самцы (n = 12) | Самки (n = 7) | Самцы (n = 8) | Самки (n = 7) | |
| Число ПВР | 41.8 ± 8.3 | 31.0 ± 6.9 | 11.3 ± 5.3* | 13.7 ± 6.3 |
| Длительность ПВР, с | 4.9 ± 0.4 | 5.6 ± 0.7 | 3.9 ± 1.7 | 2.4 ± 0.9* |
| Индекс ПВР, % | 2.5 ± 0.5 | 2.3 ± 0.7 | 0.9 ± 0.5* | 0.6 ± 0.3* |
| Б | ||||
| Длительность иммобильности, с | 218.2 ± 3.1 | 203.9 ± 4.9 | 195.9 ± 4.8* | 170.3 ± 11.8** |
| Длительность 1-го эпизода активного плавания, с | 34.3 ± 1.7 | 36.9 ± 2.8 | 48.4 ± 5.7* | 51.3 ± 5.6* |
| Длительность плавания, с | 47.5 ± 3.0 | 60.6 ± 7.4 | 55.8 ± 4.7 | 87.1 ± 15.8* |
| Число ныряний | 1.5 ± 0.3 | 2.1 ± 0.2 | 3.4 ± 0.4* | 2.9 ± 0.6 |
| Предпочтение раствора сахарозы, % | 52.0 ± 10.9 | 86.0 ± 6.3 | 77.8 ± 5.2* | 80.9 ±5.1 |
Уменьшение числа зрелых ПВР разрядов у взрослых 7-месячных самцов крыс линии WAG/Rij сопровождалось появлением множества незрелых разрядов, характерных для молодых 2–3-месячных крыс этой линии [2], что указывает на антиэпилептогенный эффект МОД матери. У 50% самцов, рожденных матерями, потреблявшими МОД, зрелые ПВР отсутствовали (рис. 1а), они замещались незрелыми разрядами, обычно регистрируемые у молодых крыс линии WAG/Rij [2].
Рис. 1.
Характеристики ПВР, зарегистрированных у самцов крыс линии WAG/Rij, рожденных матерями, потреблявшими МОД (а) или КД (Б). (а) – незрелый ПВР, (б) – зрелый ПВР. 1 – пример ПВР, 2 – спектральная плотность мощности ПВР, 3 – фрагмент ПВР, представленный на увеличенной по времени шкале (отмечен горизонтальной линией над разрядом) с целью иллюстрации его морфологии: а – ранний переходный процесс, б – пик, в – поздний переходный процесс, г – волна. Шкалы: время 500 мс (абсцисса), амплитуда 500 мкВ (ордината).

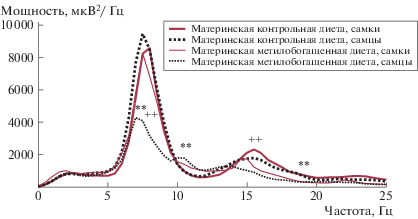
На незрелость разрядов указывают спектральная мощность разрядов (рис. 1а, 2) и измененная морфология (рис. 1а, 3). В то же самое время у 100% самцов того же возраста, рожденных матерями, потреблявшими КД, наблюдали типичные для АЭ зрелые ПВР (рис. 1б). Другими словами, МОД матери во время перинатального периода замедляет связанный с возрастом процесс прогрессивного развития эпилептической активности у самцов крыс линии WAG/Rij. У самок крыс линии WAG/Rij антиэпилептогенный эффект МОД матери был выражен слабее (уменьшалась только общая и средняя длительность ПВР). МОД матери вызывала значимые изменения усредненной спектральной плотности мощности разрядов согласно данным Фурье анализа только у самцов: уменьшение на фундаментальной частоте (7–8 Гц) и частотах первой и второй гармоник (рис. 2).
Рис. 2.
Усредненные спектры мощности ПВР, вычисленные методом Уэлча с применением быстрого преобразования Фурье у взрослого потомства крыс линии WAG/Rij. По критерию Манна-Уитни с поправкой Бонфферони на число значений в спектре и число парных сравнений (100): на частотах 6.5–8.5, 11, 14.5–25 Гц у самцов, рожденных матерями, потреблявшими МОД, по сравнению с самцами, рожденными матерями, потреблявшими КД, ** p < 0.01; на частотах 7.5–8.5, 15–17.5 Гц у самцов, рожденных матерями, потреблявшими МОД, по сравнению с самками, рожденными матерями, потреблявшими МОД, ++ p < 0.01. Значимых отличий между самками и самцами, рожденными матерями, потреблявшими КД, и между самками, рожденными матерями, потреблявшими КД и МОД не обнаружено.
Двухфакторный ANOVA выявил значимое влияние факторов “МОД” [F(1,32) = 21.51, p < < 0.001] и “пол” [F(1,32) = 10.97, p < 0.01] на длительность иммобильности в тесте вынужденного плавания. МОД матери оказала значимое влияние на длительность 1-го эпизода активного плавания [F(1,32) = 13.65, p < 0.001], длительность плавания [F(1,32) = 5.08, p < 0.05] и число ныряний [F(1,32) = 10.49, p < 0.01].
У взрослого потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими МОД, длительность иммобильности была меньше, а длительность 1-го эпизода активного плавания больше аналогичных показателей у взрослого потомства крыс линии WAG/Rij, рожденного матерями, потреблявшими КД (табл. 1, Б). МОД вызывала значимое увеличение длительности плавания только у самок, а числа ныряний – только у самцов. МОД матери увеличивала также предпочтение раствора сахарозы (антиагедонический эффект) только у самцов и не оказывала значимого влияния на предпочтение сладкого раствора у самок.
В данной работе впервые показано, что эпигенетический фактор, такой как состав материнской диеты во время перинатального периода, оказывает существенное влияние на проявление наследственной патологии у потомства. МОД матери подавила развитие АЭ и коморбидной депрессии у генетически предрасположенных к данной патологии особей – у крыс линии WAG/Rij. Другими словами, МОД матери на самых ранних стадиях онтогенеза, наиболее чувствительного к эпигенетическим модификациям, вызывает коррекцию патологического фенотипа у крыс линии WAG/Rij. Этот эффект выражен больше у самцов по сравнению с самками, что согласуется с данными других авторов [11]. Положительное влияние МОД матери показано также на модели болезни Альцгеймера [12, 13]. Известно, что патология ионных каналов HCN1 в сенсомоторной коре мозга является ведущим патогенетическим механизмом развития АЭ [14], а дофаминергическая недостаточность в мезолимбической системе – коморбидной депрессии у крыс линии WAG/Rij [1, 15]. В связи с этим предполагается, что МОД матери вызвала коррекцию патологического фенотипа у потомства крыс линии WAG/Rij возможно вследствие изменения метилирования ДНК, приводящего к изменениям экспрессии генов, патогенетически значимых для АЭ и коморбидной депрессии – гена HCN1 ионного канала, ответственного за генерацию и генерализацию ПВР, и гена тирозингидроксилазы – ключевого фермента синтеза катехоламинов, в том числе дофамина. Проверка этого предположения – цель дальнейших исследований.
Продемонстрированная в настоящей работе возможность эпигенетической коррекции симптомов АЭ и коморбидной депрессии у потомства открывает новые перспективы для дальнейших исследований молекулярных механизмов этой коррекции и целью разработки новых подходов к лечению данной патологии. Результаты работы указывают на новую превентивную терапевтическую стратегию, основанную на материнской диете во время перинатального периода, для коррекции симптомов генетически обусловленной АЭ и коморбидной депрессии у потомства.
Список литературы
Sarkisova K, van Luijtelaar G. // Progress Neuro-Psychopharm. Biol. Psychiatry. 2011. V. 35. P. 854–876.
Габова А.В., Саркисова К.Ю., Федосова Е.А. и др. // Рос. Физиол. ж. 2018. Т. 104. № 10. С. 1176–1189.
Sarkisova K.Y., Gabova A.V. // Genes Brain Behav. 2018. V.1 7. № 7: e12477. https://doi.org/10.1111/gbb.12477
Саркисова К.Ю., Габова А.В., Куликов М.А. и др. // ДАН. 2017. Т. 473. № 2. С. 246–249.
Kobow K., Blümcke I. // Epilepsia. 2012. V. 53 (Suppl.). P. 11–20.
Vialou V., Feng J., Robinson A.J. et al. // Ann. Rev. Pharmacol. 2013. V. 53. P. 59–87.
Geoffroy A., Kerek R., Pouriế G., et al. // Mol. Neurobiol. 2017. V. 54. P. 5017–5033.
McCoy C.R., Jackson N.L., Day J., et al. // Behav. Brain Res. 2017. V. 320. P. 165–178.
Poletaeva I.I., Surina N.M., Ashapkin V.V., et al. // Pharmacol Biochem. Behav. 2014. V. 127. P. 21–26.
Cooney C.A., Dave A.A., Wolff G.L. // J. Nutr. 2002. V. 132. № 8 (Suppl.). P.2393S–2400S.
Maloney C.A., Hay S.M., Young L.E., et al. // J. Nutr. 2011. V. 41. P. 95–100.
Velazquez R., Ferreira E., Winslow W., et al. // Mol. Psychiatry. 2019. https://doi.org/10.1038/s41380-018-0322-z
Ash J.A., Velazquez R., Kelley C.M., et al. // Neurobiol. Dis. 2014. V. 70. P. 32–42.
Schridde U., Strauss U., Bräuer A.U., et al. // Eur. J. Neurosci. 2006. V. 23. P. 3346–3358.
Саркисова К.Ю., Куликов М.А., Кудрин В.С. и др. // Журн. высш. нервн. деят. им. И.П. Павлова. 2013. Т. 63. № 3. С. 303–315.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


