Доклады Российской академии наук. Науки о жизни, 2020, T. 495, № 1, стр. 612-615
АДАПТАЦИЯ МИКОПЛАЗМ К АНТИМИКРОБНЫМ ПЕПТИДАМ: РАЗВИТИЕ УСТОЙЧИВОСТИ К МЕЛИТТИНУ У Acholeplasma laidlawii СВЯЗАНО С ИЗМЕНЕНИЯМИ ГЕНОМНОГО, ПРОТЕОМНОГО ПРОФИЛЕЙ И ВИРУЛЕНТНОСТИ
В. М. Чернов 1, Н. Б. Баранова 1, 2, *, А. А. Музыкантов 1, Е. С. Медведева 1, М. А. Драмшини 2, О. А. Чернова 1, 2
1 Казанский институт биохимии и биофизики – обособленное структурное подразделение Федерального государственного бюджетного учреждения науки “Федеральный исследовательский центр “Казанский научный центр Российской академии наук”
Казань, Россия
2 Федеральное государственное автономное образовательное учреждение высшего образования “Казанский (Приволжский) федеральный университет”
Казань, Россия
* E-mail: natalja-b@yandex.ru
Поступила в редакцию 13.07.2020
После доработки 10.08.2020
Принята к публикации 10.08.2020
Аннотация
Впервые показано, что развитие резистентности к мелиттину у Acholeplasma laidlawii – широко распространенной в природе микоплазмы, являющейся основным контаминантом клеточных культур и вакцинных препаратов, связано с существенными изменениями геномного профиля, клеточного и везикулярного протеомов, а также вирулентности.
Acholeplasma laidlawii – один из шести видов микоплазм (здесь – собирательное название представителей класса Mollicutes), являющихся основными контаминантами клеточных культур и вакцинных препаратов [1]. Подавление микоплазм и деконтаминация клеточных культур – серьезная проблема. Перспективы ее решения связывают с использованием антимикробных пептидов, прежде всего мелиттина, полученного из пчелиного яда [2]. Недавно появились данные о способности микоплазм развивать устойчивость к мелиттину [3, 4], но молекулярные основы резистентности бактерий к этому препарату не определены. Выяснение молекулярных основ адаптации к Acholeplasma laidlawii к мелиттину – цель нашего исследования.
В работе использовали штамм Acholeplasma laidlawii PG8B из коллекции микроорганизмов ФГБУ “ФНИЦЭМ им. Н.Ф. Гамалеи” Минздрава России НИИ эпидемиологии и микробиологии им Н.Ф. Гамалеи (Москва). Штамм A. laidlawii PG8RMel, проявляющий повышенную устойчивость к мелиттину (MПК 21 мкг/мл), был получен в результате последовательного пересева культуры A. laidlawii PG8B (MПК 7 мкг/мл) в питательной среде Эдварда с возрастающей концентрацией антимикробного пептида. Культивирование микоплазмы, трансмиссивную электронную микроскопию (ТЭМ), а также выделение, очистку внеклеточных везикул (ВВ) штаммов и контроль чистоты препаратов (отсутствие клеток микоплазмы в образцах везикул) осуществляли как описано [5].
Секвенирование геномов штаммов A. laidlawii проводили на ДНК-секвенаторе GS Junior (“Roche Diagnostics”, Швейцария). Для анализа нуклеотидных последовательностей использовали программу Sequencing Analysis 5.3.1 (“Applied Biosystems”, США), а также базу данных NCBI (National Center for Biotechnology Information). Для сборки ДНК последовательностей de novo применялся программный пакет Newbler (“Roche Diagnostics”, Швейцария), для выравнивания нуклеотидных последовательностей – Bowtie2 (http://bowtie-bio.sourceforge.net/bowtie2/index.shtml), для поиска и аннотации однонуклеотидных полиморфизмов (SNP) – Samtools (http://samtools.sourceforge.net/mpileup.shtml) и SnpEff (http://snpeff.sourceforge.net/SnpEff.html) соответственно. Результаты полногеномного секвенирования A. laidlawii PG8RMel были депонированы в GenBank (https://www.ncbi.nlm.nih.gov/nuccore/NELN00000000.2). Протеомное профилирование клеток и внеклеточных везикул A. laidlawii проводили с помощь 2DE MALDI-TOF/TOF и 1D-LC-ESI-MS/MS, соответственно, как описано [5]. Для определения локализации белков использовали программу Psortb v3.0.2 (http://www. psort.org/psortb/). Идентифицированные белки классифицировали в соответствии с функциональными категориями EggNOG (http://eggnogdb.embl.de). Для поиска белков, ассоциированных с бактериальной вирулентностью и устойчивостью к антимикробным препаратам, использовали базы данных CARD (https://card.mcmaster.ca/home), и VFDB (http://www.mgc.ac.cn/VFs/main.htm).
Мутагенность везикул и клеток A. laidlawii определяли как описано [6]. Статистическую обработку данных выполняли с помощью программного обеспечения MS Excel (Microsoft) и Origin 8.0. Сравнение средних значений проводили по критерию Стьюдента. При сравнении количества клеток в классах использовали критерий χ2 (p).
В геноме штамма PG8RMel нами было обнаружено 208 SNPs (188 – в кодирующей части генома, 17 – в межгенных областях, 3 – в псевдогенах), из которых 142 – значимые мутации (рис. 1) (GenBank, https://www.ncbi.nlm.nih.gov/nuccore/NELN00000000.2). Мутации выявлены в генах, продукты которых могут быть вовлечены в защиту бактерий от антимикробных пептидов – белки мембран и эффлюксной системы, протеазы, а также белки, вовлеченные в универсальный каскад ответных реакций микроорганизмов на стрессоры и эпигенетическую регуляцию. Однако существенная часть мутаций локализована в генах, кодирующих ключевые ферменты метаболизма и факторы бактериальной вирулентности. Кроме того, мутации обнаружены в генах, ассоциированных с адаптацией классических бактерий к антимикробным препаратам (мупироцину, пенициллинам и фузидовой кислоте), в отношении которых микоплазмы индифферентны. Связаны ли они с bacterial charity [7], предстоит выяснить.
Рис. 1.
Локализация на геномной карте Acholeplasma laidlawii PG-8А генов, ассоциированных с развитием устойчивости микоплазмы к мелиттину. * − гены, в первичной структуре которых обнаружены мутации относительно A. laidlawii PG8B; ■ – гены, кодирующие дифференциально экспрессированные белки A. laidlawii PG8RMel/A. laidlawii PG8B, ▲ – гены, кодирующие белки, выявленные во внеклеточных везикулах A. laidlawii PG8RMel. Графическое изображение хромосомы получено с помощью GCView Server (htp://stothard.afns.ualberta.ca/cgview_server/index.html).
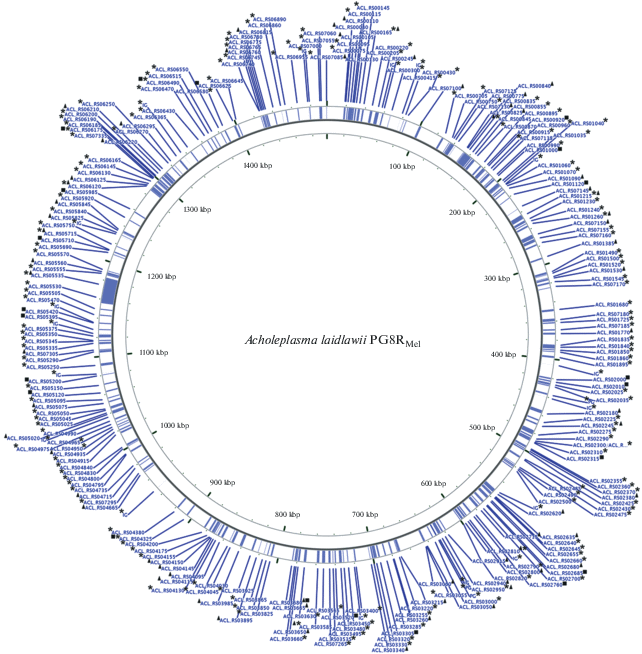
Протеомные профили клеток штаммов [8] тоже имеют существенные различия, которые связаны и с количественными, и с качественными изменениями полипептидного пула, а также появлением белковых изоформ у PG8RMel. Образование последних связывают с универсальной защитной реакцией бактерий [9]. Значительное количество полипептидов, представленность которых у штаммов различается, вовлечено в стресс-реактивность, фундаментальные клеточные процессы микроорганизмов и вирулентность. Некоторые дифференциально экспрессированные белки PG8RMel кодируются генами, в которых выявлены мутации (рис. 1). Результаты протеомного анализа везикул также свидетельствуют о количественных и качественных различиях везикулярного пула белков у PG8RMel и PG8B [8]. Существенную часть белков в везикулах PG8RMel (55 из 64) составляют белки, которые не выявляются в везикулах штамма PG8B.
Некоторые из них ассоциированы с развитием устойчивости классических бактерий к антимикробным пептидам, входят в пул дифференциально экспрессированных и/или являются продуктами генов, в которых выявлены мутации (рис. 1). При этом в составе везикул PG8RMel также обнаруживается бета субъединица ДНК-зависимой РНК полимеразы (ACL_RS00840). Это единственный общий белок, который появляется в везикулах A. laidlawii при развитии резистентности к антимикробным препаратам разных классов – он обнаруживается и у штаммов, резистентных к тетрациклину и ципрофлоксацину, является у них продуктом мутантных версий гена и, в связи с этим, представляет интерес как потенциальная мишень для элиминации микоплазмы.
Значительная часть везикулярного протеома у PG8RMel, как и у PG8В, составляют факторы вирулентности, но профиль их у штаммов существенно различается. Это (наряду с результатами анализа геномных профилей и протеомов клеток) позволяет предполагать, что адаптация A. laidlawii к мелиттину связана с изменением вирулентных свойств микоплазмы. Экспериментальные подтверждения этого предположения были получены нами при сравнительном анализе мутагенности штаммов. Инфицирование лимфоцитов периферической крови человека in vitro клетками PG8RMel приводит к тотальному преждевременному расхождению центромер в метафазе у 65% клеток. В случае штамма PG8B этот эффект не наблюдается. Выявленные нами особенности различий штаммов PG8RMel и PG8В в отношения мутагенности, геномного профиля, а также протеомов клеток и везикул свидетельствуют, что адаптация A. laidlawii к мелиттину сопровождается существенными изменениями вирулома микоплазмы.
Таким образом, нами впервые получены данные о молекулярных основах развития устойчивости к мелиттину у A. laidlawii. Эти данные: 1) свидетельствуют о существенных изменениях геномного профиля, клеточного и везикулярного протеомов, а также вирулома бактерии при адаптации к антимикробному пептиду – мелиттину; 2) изменяют представления об арсенале средств самозащиты у простейших прокариот; 3) определяют необходимость коррекции стратегии контроля микоплазм.
Список литературы
Mollicutes: Molecular Biology and Pathogenesis // G.F. Browning, C. Citti Eds L.: Caister Acad. Press, 2014. 350 p.
Ravensdale J., Wong Z., O’Brien F., et al. // Front. Microbiol. 2016. V. 7. Article 1745. https://doi.org/10.3389/fmicb.2016.01745
Park H.J., Kang K.M., Dybvig K., et al. // FEBS Lett. 2013. V. 587. P. 3321–3326. https://doi.org/10.1016/j.febslet.2013.08.016
Fehri L.F., Sirand-Pugnet P., Gourgues G. et al. // Antimicrob Agents Chemother. 2005. V. 49. № 10. P. 4154–4165. https://doi.org/10.1128/AAC.49.10.4154-4165.2005
Chernov V.M., Mouzykantov A.A., Baranova N.B., et al. // J. Proteomics. 2014. V. 110. P. 117–128. https://doi.org/10.1016/j.jprot.2014.07.020
Чернова О.А., Волкова Е.Н., Чернов В.М. // Генетика. 1996. Т. 32. С. 810–814.
Lee H.H., Molla M.N., Cantor C.R., et al. // Nature. 2010. V. 467. P. 82–85. https://doi.org/10.1038/nature09354
Medvedeva E.S., Mouzykantov A.A., Baranova N.B., et al. // Data Brief. 2019. V. 25:104169. https://doi.org/10.1016/j.dib.2019.104169
Sriramulu D.D. // Proteomics Insights. 2009. V. 2. P. 39–47. https://doi.org/10.4137/PRI.S3760
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


