Доклады Российской академии наук. Науки о жизни, 2020, T. 495, № 1, стр. 624-631
РАСПРЕДЕЛЕНИЕ ЖИРНЫХ КИСЛОТ В СОСТАВЕ ЛИПИДОВ СЕСТОНА, В ТКАНЯХ ДВУСТВОРЧАТЫХ МОЛЛЮСКОВ Mytilus edulis L. И ИХ ФЕКАЛЬНЫХ ПЕЛЛЕТ
Н. Н. Фокина 1, *, Т. Р. Руоколайнен 1, член-корреспондент РАН Н. Н. Немова 1, Д. М. Мартынова 2, А. А. Сухотин 2
1 Институт биологии – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр Российской академии наук”
Петрозаводск, Россия
2 Федеральное государственное бюджетное учреждение науки Зоологический институт Российской академии наук
Санкт-Петербург, Россия
* E-mail: fokinann@gmail.com
Поступила в редакцию 17.07.2020
После доработки 21.07.2020
Принята к публикации 22.07.2020
Аннотация
Анализ жирнокислотного состава сестона – источника пищи двустворчатых моллюсков, выявил доминирование в нем фитопланктонных n-3 полиеновых жирных кислот, свидетельствующих о преобладании в составе сестона диатомовых водорослей. Показано, что распределение основных классов липидов и их жирных кислот по тканям мидий зависит от размера их тела. С увеличением размера моллюсков отмечалось снижение уровня мембранных липидов и накопление в составе запасных липидов высокоэнергетических насыщенных и мононенасыщенных жирных кислот. При этом основная доля n-3 полиеновых кислот, поступающих моллюскам с пищей в составе сестона, накапливается в их тканях и используется на собственные нужды организма, тогда как длинноцепочечные насыщенные жирные кислоты, олеиновая кислота и n-6 полиеновые кислоты выводятся из организма мидий в составе фекальных пеллет.
Донные фильтраторы, к которым относятся некоторые виды двустворчатых моллюсков, способны образовывать массовые скопления (банки), являясь, таким образом, одним из важнейших элементов прибрежных экосистем, определяющих скорость биоседиментации и осадконакопления [1]. Моллюски интенсивно отфильтровывают взвесь из воды и выделяют большое количество фекальных и псевдофекальных пеллет, которые накапливаются в грунте, внося тем самым существенный вклад не только в формирование пелагических и бентосных трофических сетей, но и “бактериальной петли”, обеспечивающей обратную связь в экосистемах водоемов [2]. Роль жирных кислот в пищевых пелагических и бентосных цепях морских [3, 4] и пресноводных [5] экосистем описана достаточно подробно. Специфические жирные кислоты, перемещаясь по пищевой цепи, служат маркерами трофических взаимоотношений в сообществе. Сравнительный анализ жирнокислотного состава тканей мидии съедобной Mytilus edulis Linnaeus, 1758, их фекальных пеллет и пищи (сестона) позволит получить новую информацию о транспорте жирных кислот по короткой трофической цепи “сестон–моллюски-фильтраторы” [6, 7] и установить жирные кислоты, которые возвращаются в окружающую среду в составе фекальных пеллет моллюсков, накапливаются в осадочном материале и в дальнейшем могут перемещаться по экосистеме водоема.
Серия экспериментов была поставлена на Беломорской биологической станции Картеш Зоологического института РАН, расположенной в губе Чупа Кандалакшского залива Белого моря. Моллюски M. edulis для экспериментов были собраны с субстратов аквакультуры, расположенных вблизи биостанции. Животные в эксперименте были представлены тремя размерными группами: мелкие (1), средние (2) и крупные (3); средняя масса моллюска с раковиной и мантийной жидкостью составляла 1.3 ± 0.2, 5.7 ± 1.4 и 21.1 ± 7.9 г соответственно. От 10 до 50 экземпляров мидий, в зависимости от их размерной группы, помещали в аквариумы объемом 10–20 л с предварительно профильтрованной (100 мкм) и термостатированной нативной морской водой; температура воды составляла 12 ± 1°С в течение всего эксперимента (6 суток), что соответствовало температуре воды в море на глубине 2 м (глубине сбора материала). Воду в аквариумах меняли полностью каждые 12 ч. Начиная с третьих суток, перед сменой воды, из аквариумов отбирали фекальные пеллеты мидий, которые осаждали на стекловолокнистые фильтры Whatman GF/C. Ежедневно три порции нативной морской воды, предварительно профильтрованной (100 мкм), объемом 10 л каждая, осаждали под вакуумом (0.6 атм) на стекловолокнистые фильтры Whatman GF/C. После окончания эксперимента, мидий вскрывали и отбирали пробы тканей (гепатопанкреас, жабры, задний аддуктор). Перед вскрытием мидий обсушивали, измеряли и взвешивали. Пробы сестона (n = 10), пеллет (n = 5 от каждой группы мидий) и тканей жабр, гепатопанкреаса и аддуктора (n = 5 от каждой группы мидий) фиксировали 96% этанолом. Исследование состава липидов и жирных кислот проводили на оборудовании Центра коллективного пользования научным оборудованием КарНЦ РАН. Липиды тканей M. edulis, а также сестона и фекальных пеллет анализировали методами, подробно описанными ранее [8]. Достоверность различий содержания липидов в тканях моллюсков исследуемых размерных групп оценивали с помощью непараметрического критерия Краскела–Уоллиса (H). Различия в составе жирных кислот сестона и фекальных пеллет оценивали однофакторным дисперсионным анализом (ANOVA). Коэффициент ранговой корреляции Спирмена использовали для оценки связи состава липидов в тканях мидий и фекальных пеллетах с размерами моллюсков. Различия считались достоверными при p < 0.05.
Основную долю жирных кислот (ЖК) в составе фосфолипидов (ФЛ) и триацилглицеринов (ТАГ) сестона и фекальных пеллет мидий составляли насыщенные (НЖК) и мононенасыщенные жирные кислоты (МНЖК) (рис. 1), тогда как на долю n-3 и n-6 полиненасыщенных жирных кислот (ПНЖК) приходилось не более 20% от суммы ЖК. Однако качественный состав ЖК ФЛ и ТАГ сестона и пеллет значительно отличался друг от друга, что, в первую очередь, связано с ассимиляцией и избирательным накоплением ЖК в тканях моллюсков [6, 7]. В составе липидов сестона отмечалось повышенное содержание 16 : 1 кислот и n-3 ПНЖК, главным образом, эйкозапентаеновой 20 : 5n-3 кислоты (ЭПК) и докозагексаеновой 22 : 6n-3 кислоты (ДГК), которые, как известно, имеют фитопланктонное происхождение [3, 4]. Более того, преобладание в сестоне ЭПК указывает на доминирование в его составе диатомовых водорослей [9]. В составе фекальных пеллет среди ЖК была заметно повышена доля длинноцепочечных НЖК (22 : 0 и 24 : 0), которые являются конечными продуктами метаболизма жирных кислот у мидий [10], а также отмечали высокие доли олеиновой 18 : 1n-9 кислоты и n-6 ПНЖК (в частности, 18 : 2n-6 и 20 : 4n-6). В ЖК составе фекальных пеллет отмечалось повышение пропорций 17 : 0, 20 : 3n-3 и 18 : 3n-6 кислот и снижение 22 : 0 кислоты при увеличении размера моллюсков (рис. 2), что сопровождалось колебаниями количественного состава ЖК в тканях мидий. В составе ТАГ гепатопанкреаса и ФЛ аддуктора наблюдалось повышение уровня 17 : 0 кислоты при увеличении размера моллюсков (табл. 1). Известно, что жирные кислоты с нечетным числом атомов углерода имеют бактериальное происхождение и могут ассимилироваться в ткани моллюсков [3, 7], но при этом, в отличие от жирных кислот с четным числом атомов углерода (например, 16 : 0 и 18 : 0), они не могут использоваться организмом в качестве субстратов для ферментов. При этом снижение пропорций насыщенной 22 : 0 кислоты (на фоне накопления НЖК 12 : 0 и 14 : 0) в фекальных пеллетах крупных моллюсков (рис. 2), а также в составе ФЛ гепатопанкреаса (табл. 1) может свидетельствовать о подавлении у них синтеза длинноцепочечных НЖК, которые моллюскам сложно катаболизировать [10].
Рис. 1.
Жирно-кислотный состав (% от суммы жирных кислот) фосфолипидов (а, в, д, ж) и триацилглицеринов (б, г, е, з) сестона (черные столбцы) и фекальных пеллет мидий (белые столбцы). * достоверное различие между жирнокислотным составом сестона и пеллет, однофакторный дисперсионный анализ (ANOVA), p < 0.05.

Рис. 2.
Содержание некоторых жирных кислот (% от суммы жирных кислот) в фосфолипидах (pl) и триациглицеринах (tag) пеллет мидий разных размеров: На рисунке размерные группы мидий 1, 2 и 3 обозначены: круг, квадрат и треугольник, соответственно. * Достоверные корреляции, r-ранговый коэффициент корреляции Спирмена.
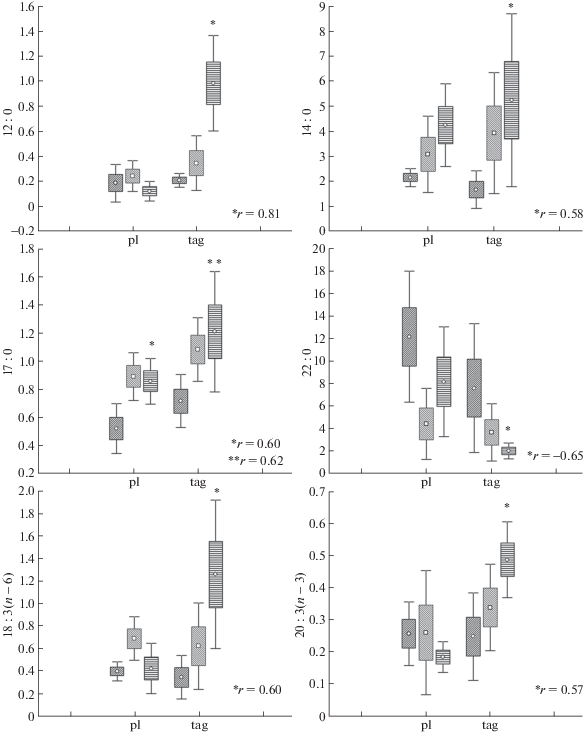
Несмотря на повышенное содержание 20 : 3n-3 и 18 : 3n-6 кислот в фекальных пеллетах мидий, мы отмечали снижение их уровня в тканях крупных мидий (табл. 1). Помимо того, что данные кислоты входят в состав сестона, известно, что они являются промежуточными метаболитами синтеза длинноцепочечных ПНЖК, таких как ЭПК, ДГК и арахидоновой (20 : 4n-6, АК) кислоты [3–5]. Однако у морских моллюсков полностью или частично утрачена способность к синтезу n-3 ПНЖК [7, 9], поскольку данные кислоты в избыточном количестве поступают с пищей (преимущественно в составе фитопланктона). Более того, повышенное содержание АК и длинноцепочечных n-6 ПНЖК в составе фекальных пеллет указывает на избыточное поступление данных ЖК из сестона и низкий уровень их метаболизма в организме мидий. Известно, что n-6 ПНЖК могут поступать моллюскам в составе фитопланктона, зоопланктона, а также наземного аллохтонного органического вещества [3–5]. Следовые количества n-3 ПНЖК в составе фекальных пеллет свидетельствуют об избирательном накоплении и ассимиляции ЭПК и ДГК в тканях мидий [7, 9]. Эти n-3 ПНЖК используются моллюсками не только для синтеза эйкозаноидов, но и для поддержания текучести фосфолипидов в составе мембран и энергетических потребностей организма [3, 4, 7, 9].
При увеличении размера мидий в ФЛ жабр и гепатопанкреаса отмечалось также повышение доли длинноцепочечных ПНЖК, а именно, 22:5n-3 и 22:5n-6 (табл. 1). При этом в ФЛ жабр наблюдалось повышение уровня МНЖК (в частности, 20:1), а также снижение уровня С18 и С20 кислот в ФЛ гепатопанкреаса и аддуктора. Длинноцепочечные С22 ПНЖК накапливаются в составе ФЛ мембран и обеспечивают необходимый уровень их текучести и целостности, в то время как короткоцепочечные С18 и С20 ПНЖК используются моллюсками еще и в биосинтетических процессах (например, для синтеза эйкозаноидов) [3–5]. Во всех исследуемых органах крупных мидий в составе ТАГ также отмечалось снижение уровня ПНЖК (в частности, 18:2n-6, 18:3n-6, АК, ЭПК), при этом росла доля НЖК (14:0, 18:0) и МНЖК (например, 18:1n-9). Вероятно, у крупных моллюсков сформированный пул НЖК и МНЖК в составе ТАГ необходим для обеспечения энергетической функции [11]. Более того, снижение содержания основных структурных компонентов мембран – фосфолипидов и стеринов (в частности, холестерина) – у крупных мидий (табл. 1) может указывать на переключение их метаболизма с формирования мембранных липидов на аккумуляцию высокоэнергетических компонентов в мягких тканях.
Таким образом, фекальные пеллеты двустворчатых моллюсков могут служить источником длинноцепочечных НЖК (22:0 и 24:0), олеиновой 18:1n-9 кислоты и n-6 ПНЖК (в частности 18:2n-6 и АК) для обитателей бентосных сообществ и морских экосистем в целом. Основная доля n-3 ПНЖК, поступающих моллюскам с пищей в составе сестона, накапливается в тканях и используется на собственные нужды организма. Распределение основных классов липидов и их жирных кислот по тканям мидий зависит от размера тела моллюсков и указывает на стратегию, направленную на накопление высокоэнергетических компонентов в тканях.
Таблица 1.
Состав липидов (% сухой массы) и жирных кислот (% суммы ЖК) в различных органах мидий Mytilus edulis в зависимости от веса моллюска (мелкие (1), средние (2), крупные (3)). Указаны средние значения (m) и стандартная ошибка (SE)
| Орган | Жабры | Гепатопанкреас | Аддуктор | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Размерная группа | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | ||||||||||||
| Показатель | m | SE | m | SE | m | SE | r | m | SE | m | SE | m | SE | r | m | SE | m | SE | m | SE | r |
| Общие липиды | 11.73 | 0.27 | 10.18 | 0.70 | 11.78 | 0.55 | – | 17.91 | 1.30 | 16.37 | 1.74 | 11.61*1 | 0.79 | –0.71 | 6.84 | 0.28 | 5.13 | 0.87 | 6.41 | 0.57 | – |
| Фосфолипиды | 5.12 | 0.25 | 4.73 | 0.43 | 4.54 | 0.25 | – | 8.98 | 0.49 | 9.75 | 0.86 | 7.09*2 | 0.42 | – | 3.46 | 0.22 | 2.65 | 0.46 | 3.16 | 0.35 | – |
| Триацилглицерины | 0.84 | 0.34 | 0.68 | 0.32 | 2.22 | 0.73 | – | 3.61 | 1.34 | 2.95 | 0.79 | 1.57 | 0.31 | – | 0.70 | 0.31 | 0.74 | 0.21 | 1.05 | 0.45 | – |
| Эфиры стеринов | 0.22 | 0.10 | 0.03 | 0.01 | 0.22 | 0.20 | – | 1.51 | 0.61 | 0.39 | 0.15 | 0.24 | 0.12 | –0.57 | 0.19 | 0.06 | 0.19 | 0.09 | 0.16 | 0.12 | – |
| Стерины | 5.55 | 0.32 | 4.74 | 0.44 | 4.79 | 0.66 | – | 3.80 | 0.16 | 3.28 | 0.40 | 2.72 | 0.32 | –0.57 | 2.49 | 0.27 | 1.56 | 0.24 | 2.03 | 0.12 | – |
| Фосфатидилинозитол | 0.01 | 0.00 | 0.02 | 0.00 | 0.03 | 0.01 | – | 0.09 | 0.02 | 0.06 | 0.01 | 0.03*1 | 0.01 | –0.76 | 0.09 | 0.00 | 0.11 | 0.03 | 0.09 | 0.01 | – |
| Фосфатидилсерин | 0.06 | 0.01 | 0.05 | 0.01 | 0.07 | 0.01 | – | 0.10 | 0.01 | 0.11 | 0.01 | 0.08 | 0.02 | – | 0.20 | 0.01 | 0.15 | 0.03 | 0.20 | 0.04 | – |
| Фосфатидилэтаноламин | 0.24 | 0.05 | 0.21 | 0.05 | 0.28 | 0.05 | – | 0.52 | 0.06 | 0.54 | 0.09 | 0.38 | 0.06 | – | 0.56 | 0.03 | 0.40 | 0.08 | 0.56 | 0.10 | – |
| Фосфатидилхолин | 4.29 | 0.24 | 3.94 | 0.34 | 3.66 | 0.19 | –0.48 | 4.66 | 0.29 | 5.43 | 0.44 | 3.97*2 | 0.31 | – | 2.14 | 0.15 | 1.62 | 0.32 | 1.86 | 0.18 | – |
| Лизофосфатидилхолин | 0.10 | 0.02 | 0.11 | 0.03 | 0.08 | 0.02 | – | 2.86 | 0.45 | 2.70 | 0.31 | 1.92 | 0.27 | – | 0.01 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | – |
| Сфингомиелин | 0.01 | 0.01 | 0.02 | 0.01 | 0.01 | 0.01 | – | 0.01 | 0.00 | 0.01 | 0.00 | 0.00*2 | 0.00 | – | 0.00 | 0.00 | 0.00 | 0.00 | 0.01 | 0.00 | – |
| Жирнокислотный состав фосфолипидов | |||||||||||||||||||||
| 12:0 | 1.25 | 0.35 | 1.71 | 0.65 | 2.11 | 0.21 | – | 0.87 | 0.39 | 0.58 | 0.21 | 0.96 | 0.19 | – | 0.36 | 0.14 | 0.32 | 0.14 | 0.43 | 0.16 | – |
| 14:0 | 1.18 | 0.35 | 1.51 | 0.68 | 2.01 | 0.31 | – | 0.86 | 0.37 | 0.55 | 0.22 | 2.18 | 1.48 | – | 0.33 | 0.04 | 0.30 | 0.09 | 0.31 | 0.10 | – |
| 15:0 | 0.28 | 0.12 | 0.47 | 0.15 | 0.66 | 0.06 | +0.51 | 0.41 | 0.11 | 0.32 | 0.06 | 0.59 | 0.19 | – | 0.53 | 0.13 | 0.24 | 0.09 | 0.35 | 0.14 | – |
| 16:0 | 13.96 | 1.29 | 11.71 | 1.10 | 9.71 | 1.17 | –0.53 | 9.65 | 1.03 | 9.38 | 0.57 | 8.30 | 0.71 | – | 14.91 | 0.31 | 15.65 | 0.50 | 14.88 | 1.34 | – |
| 17:0 | 0.74 | 0.08 | 0.75 | 0.10 | 0.77 | 0.08 | – | 0.53 | 0.08 | 0.62 | 0.07 | 0.61 | 0.09 | – | 1.08 | 0.08 | 1.18 | 0.11 | 1.46*1 | 0.11 | +0.59 |
| 18:0 | 3.02 | 0.49 | 3.42 | 1.06 | 2.81 | 0.64 | – | 2.28 | 0.49 | 2.25 | 0.28 | 1.90 | 0.30 | – | 4.46 | 0.11 | 5.10 | 0.16 | 5.48*1 | 0.23 | +0.77 |
| 20:0 | 0.86 | 0.17 | 1.01 | 0.15 | 0.85 | 0.22 | – | 0.82 | 0.39 | 1.18 | 0.50 | 0.72 | 0.41 | – | 0.08 | 0.01 | 0.08 | 0.01 | 0.09 | 0.01 | – |
| 22:0 | 0.57 | 0.25 | 0.79 | 0.33 | 0.60 | 0.31 | – | 0.53 | 0.15 | 0.41 | 0.10 | 0.25 | 0.08 | –0.49 | 0.38 | 0.17 | 0.98 | 0.68 | 0.13 | 0.02 | – |
| 24:0 | 0.14 | 0.02 | 0.13 | 0.02 | 0.18 | 0.04 | – | 0.26 | 0.09 | 0.19 | 0.03 | 0.16 | 0.03 | – | 0.11 | 0.01 | 0.13 | 0.01 | 0.13 | 0.02 | – |
| ∑ НЖК | 22.01 | 2.23 | 21.51 | 1.62 | 19.69 | 1.28 | – | 16.20 | 0.85 | 15.47 | 1.15 | 15.65 | 1.41 | – | 22.24 | 0.47 | 24.00 | 1.21 | 23.26 | 1.41 | – |
| 14:1 | 0.45 | 0.02 | 0.41 | 0.04 | 0.48 | 0.07 | – | 0.23 | 0.02 | 0.27 | 0.03 | 0.34 | 0.08 | – | 0.45 | 0.04 | 0.49 | 0.04 | 0.46 | 0.09 | – |
| 16:1 | 3.50 | 0.36 | 3.87 | 0.36 | 4.76 | 0.94 | – | 6.21 | 0.61 | 6.39 | 0.52 | 5.48 | 0.41 | – | 3.92 | 0.27 | 4.23 | 0.36 | 3.52 | 0.40 | – |
| 18:1n-9 | 3.11 | 0.84 | 4.35 | 1.08 | 2.26 | 0.49 | – | 3.65 | 0.87 | 2.57 | 0.21 | 2.41 | 0.48 | – | 1.74 | 0.33 | 2.23 | 0.47 | 1.77 | 0.38 | – |
| 18:1n-7 | 1.67 | 0.04 | 1.78 | 0.12 | 1.60 | 0.20 | – | 1.34 | 0.15 | 1.40 | 0.07 | 1.35 | 0.09 | – | 2.71 | 0.10 | 3.01 | 0.12 | 3.01 | 0.27 | – |
| 20:1 | 3.34 | 0.16 | 3.62 | 0.34 | 4.22 | 0.29 | +0.49 | 2.24 | 0.17 | 2.29 | 0.13 | 2.20 | 0.11 | – | 5.46 | 0.09 | 6.06*1 | 0.16 | 5.91*1 | 0.34 | – |
| 22:1 | 0.39 | 0.10 | 0.73 | 0.26 | 0.67*1 | 0.17 | – | 0.51 | 0.09 | 0.39 | 0.09 | 0.54 | 0.13 | – | 0.31 | 0.05 | 0.27 | 0.03 | 0.19*1 | 0.02 | –0.51 |
| 24:1 | 0.11 | 0.01 | 0.17 | 0.03 | 0.16 | 0.04 | – | 0.30 | 0.08 | 0.18 | 0.04 | 0.18 | 0.03 | – | 0.13 | 0.03 | 0.13 | 0.02 | 0.12 | 0.02 | – |
| ∑ МНЖК | 12.58 | 0.79 | 14.93 | 1.44 | 14.14 | 1.30 | – | 14.48 | 1.00 | 13.49 | 0.61 | 12.50 | 0.73 | – | 14.72 | 0.59 | 16.41 | 0.66 | 14.98 | 0.75 | – |
| 16:3n-3 | 7.11 | 1.61 | 2.87 | 0.67 | 5.29 | 0.94 | – | 5.81 | 1.57 | 5.30 | 1.74 | 4.42 | 1.30 | – | 3.67 | 1.46 | 3.04 | 0.83 | 2.68 | 1.62 | – |
| 18:3n-3 | 0.15 | 0.06 | 0.10 | 0.04 | 0.26 | 0.08 | – | 0.14 | 0.01 | 0.12 | 0.01 | 0.09*1 | 0.01 | –0.64 | 0.06 | 0.01 | 0.05 | 0.01 | 0.07 | 0.01 | – |
| 20:3n-3 | 0.11 | 0.02 | 0.10 | 0.02 | 0.12 | 0.02 | – | 0.11 | 0.02 | 0.11 | 0.02 | 0.13 | 0.03 | – | 0.08 | 0.02 | 0.07 | 0.01 | 0.05*2 | 0.01 | – |
| 20:5n-3 | 11.39 | 0.86 | 11.73 | 0.75 | 11.78 | 0.58 | – | 20.43 | 1.21 | 23.70 | 0.97 | 25.24 | 1.56 | – | 15.65 | 0.29 | 16.34 | 0.75 | 19.23 | 1.95 | – |
| 22:5n-3 | 1.08 | 0.08 | 1.32 | 0.04 | 1.52*1 | 0.13 | +0.71 | 1.31 | 0.08 | 1.44 | 0.07 | 1.55 | 0.05 | +0.53 | 1.37 | 0.05 | 1.32 | 0.08 | 1.35 | 0.05 | – |
| 22:6n-3 | 14.92 | 0.93 | 15.35 | 0.91 | 14.72 | 0.37 | – | 13.93 | 0.71 | 13.89 | 0.31 | 14.11 | 0.36 | – | 18.41 | 0.33 | 16.44 | 0.86 | 15.76*1 | 0.57 | –0.65 |
| ∑ n-3 ПНЖК | 34.76 | 2.21 | 31.47 | 1.70 | 33.69 | 1.27 | – | 41.72 | 2.44 | 44.56 | 1.83 | 45.54 | 2.20 | – | 39.24 | 1.40 | 37.26 | 1.57 | 39.12 | 2.53 | – |
| 18:2n-6 | 1.74 | 0.23 | 2.64 | 0.70 | 1.54 | 0.60 | – | 3.35 | 1.08 | 2.60 | 0.27 | 2.16 | 0.36 | – | 1.41 | 0.04 | 1.39 | 0.08 | 1.00*1,2 | 0.07 | –0.70 |
| 18:3n-6 | 0.43 | 0.04 | 0.51 | 0.03 | 0.41 | 0.04 | – | 1.44 | 0.12 | 1.33 | 0.14 | 0.92 | 0.10 | –0.57 | 0.91 | 0.02 | 1.07 | 0.03 | 0.74 | 0.02 | –0.48 |
| 20:2n-6 | 0.40 | 0.03 | 0.44 | 0.04 | 0.43 | 0.02 | – | 0.45 | 0.07 | 0.50 | 0.08 | 0.46 | 0.14 | – | 0.66 | 0.03 | 0.76 | 0.04 | 0.65 | 0.07 | – |
| 20:3n-6 | 0.19 | 0.03 | 0.26 | 0.06 | 0.17 | 0.03 | – | 0.55 | 0.05 | 0.50 | 0.04 | 0.47 | 0.05 | – | 0.59 | 0.03 | 0.54 | 0.05 | 0.40*1 | 0.04 | –0.67 |
| 20:4n-6 | 3.03 | 0.39 | 4.07 | 0.85 | 3.74 | 0.52 | – | 3.10 | 0.34 | 2.86 | 0.26 | 2.91 | 0.21 | – | 2.10 | 0.04 | 2.08 | 0.15 | 2.24 | 0.12 | – |
| 22:2n-6 | 0.36 | 0.09 | 0.49 | 0.13 | 0.81 | 0.29 | – | 0.80 | 0.12 | 0.58 | 0.11 | 0.97 | 0.34 | – | 0.24 | 0.02 | 0.35 | 0.09 | 0.58 | 0.15 | – |
| 22:4n-6 | 0.45 | 0.04 | 0.41 | 0.03 | 0.45 | 0.04 | – | 0.30 | 0.03 | 0.27 | 0.03 | 0.26 | 0.02 | – | 0.26 | 0.02 | 0.20 | 0.04 | 0.20 | 0.01 | – |
| 22:5n-6 | 0.50 | 0.04 | 0.48 | 0.02 | 0.46 | 0.07 | – | 0.38 | 0.04 | 0.48 | 0.07 | 0.59 | 0.10 | +0.54 | 0.39 | 0.01 | 0.39 | 0.05 | 0.44 | 0.04 | – |
| ∑ n-6 ПНЖК | 7.09 | 0.55 | 9.31 | 1.59 | 8.01 | 1.28 | – | 10.36 | 1.27 | 9.12 | 0.39 | 8.73 | 0.76 | – | 6.56 | 0.09 | 6.79 | 0.38 | 6.27 | 0.23 | – |
| ∑ НМРЖК | 14.30 | 0.97 | 13.10 | 1.00 | 14.76*1 | 1.11 | – | 9.11 | 0.57 | 9.31 | 0.33 | 9.37 | 0.33 | – | 10.70 | 0.27 | 9.37 | 0.69 | 8.79 | 0.71 | –0.47 |
| ∑ ПНЖК | 41.85 | 2.42 | 40.77 | 0.66 | 41.70 | 1.43 | – | 52.08 | 1.54 | 53.68 | 1.70 | 54.27 | 1.64 | – | 45.79 | 1.39 | 44.04 | 1.81 | 45.39 | 2.43 | – |
| НЖК/ПНЖК | 0.55 | 0.10 | 0.53 | 0.04 | 0.47 | 0.02 | – | 0.31 | 0.02 | 0.29 | 0.03 | 0.29 | 0.04 | – | 0.49 | 0.02 | 0.56 | 0.05 | 0.52 | 0.05 | – |
| n-3/n-6 ПНЖК | 5.01 | 0.44 | 3.93 | 0.65 | 4.63 | 0.58 | – | 4.34 | 0.55 | 4.95 | 0.36 | 5.44 | 0.53 | – | 5.99 | 0.24 | 5.54 | 0.28 | 6.33 | 0.60 | – |
| ИН | 10.09 | 1.14 | 10.11 | 0.79 | 10.94 | 0.51 | – | 16.04 | 1.05 | 17.88 | 1.71 | 18.12 | 1.69 | – | 10.93 | 0.36 | 9.94 | 0.80 | 10.67 | 1.14 | – |
| Жирнокислотный состав триацилглицеринов | |||||||||||||||||||||
| 12:0 | 0.36 | 0.12 | 0.29 | 0.04 | 0.46 | 0.07 | – | 0.07 | 0.01 | 0.08 | 0.02 | 0.13 | 0.04 | – | 0.24 | 0.06 | 0.23 | 0.08 | 0.36 | 0.07 | – |
| 14:0 | 2.78 | 0.60 | 2.73 | 0.76 | 5.38 | 0.50 | +0.52 | 2.59 | 0.48 | 2.52 | 0.64 | 3.13 | 0.51 | – | 1.57 | 0.68 | 1.61 | 0.51 | 3.31 | 1.06 | – |
| 15:0 | 0.39 | 0.08 | 0.36 | 0.07 | 0.37 | 0.07 | – | 0.46 | 0.04 | 0.43 | 0.07 | 0.37 | 0.11 | – | 0.53 | 0.06 | 0.60 | 0.08 | 0.53 | 0.13 | – |
| 16:0 | 17.67 | 2.29 | 18.38 | 2.13 | 16.07 | 2.70 | – | 23.34 | 0.85 | 22.65 | 1.14 | 27.32 | 1.82 | – | 19.09 | 2.27 | 23.03 | 3.14 | 20.22 | 4.16 | – |
| 17:0 | 1.43 | 0.55 | 1.37 | 0.79 | 1.71 | 0.71 | – | 0.90 | 0.09 | 0.96 | 0.09 | 1.26*1 | 0.06 | +0.64 | 2.23 | 0.63 | 1.51 | 0.24 | 1.20 | 0.12 | – |
| 18:0 | 6.95 | 1.16 | 8.77 | 1.91 | 5.71 | 1.22 | – | 5.67 | 0.52 | 5.68 | 0.58 | 9.48*1,2 | 0.61 | +0.62 | 6.56 | 0.41 | 4.81 | 0.56 | 7.05 | 0.97 | – |
| 20:0 | 0.37 | 0.08 | 0.27 | 0.04 | 0.32 | 0.10 | – | 0.13 | 0.01 | 0.20 | 0.02 | 0.12*1 | 0.02 | – | 0.19 | 0.03 | 0.21 | 0.04 | 0.18 | 0.05 | – |
| 22:0 | 0.35 | 0.10 | 0.29 | 0.03 | 0.27 | 0.05 | – | 0.13 | 0.02 | 0.16 | 0.05 | 0.22 | 0.05 | – | 0.63 | 0.17 | 0.30 | 0.07 | 0.47 | 0.18 | – |
| 24:0 | 0.66 | 0.16 | 0.39 | 0.05 | 0.37 | 0.05 | – | 0.40 | 0.05 | 0.34 | 0.04 | 0.36 | 0.06 | – | 0.72 | 0.06 | 0.53 | 0.11 | 0.91 | 0.22 | – |
| ∑ НЖК | 30.98 | 2.62 | 32.84 | 2.38 | 30.67 | 3.42 | – | 33.68 | 1.36 | 33.01 | 1.80 | 42.39*1,2 | 2.03 | +0.59 | 31.75 | 1.41 | 32.84 | 3.38 | 34.22 | 4.81 | – |
| 14:1 | 3.67 | 1.35 | 3.44 | 1.11 | 6.27 | 0.60 | – | 0.25 | 0.11 | 0.61 | 0.17 | 0.39 | 0.19 | – | 1.10 | 0.58 | 1.39 | 0.35 | 1.91 | 0.48 | – |
| 16:1 | 3.71 | 0.60 | 3.31 | 0.59 | 3.93 | 0.54 | – | 8.49 | 2.28 | 9.61 | 2.50 | 8.71 | 1.28 | – | 7.61 | 1.13 | 14.36 | 2.73 | 11.32 | 2.03 | – |
| 18:1n-9 | 0.14 | 0.03 | 0.14 | 0.02 | 0.15 | 0.03 | – | 0.21 | 0.01 | 0.23 | 0.04 | 0.27 | 0.02 | – | 4.03 | 1.83 | 7.73 | 0.44 | 10.83 | 1.80 | +0.51 |
| 18:1n-7 | 2.16 | 0.27 | 2.10 | 0.41 | 1.41 | 0.21 | – | 4.55 | 0.32 | 4.39 | 0.21 | 5.16 | 0.41 | – | 3.45 | 0.30 | 3.57 | 0.31 | 4.00 | 0.41 | – |
| 20:1 | 2.57 | 0.38 | 2.19 | 0.37 | 2.13 | 0.32 | – | 4.07 | 0.37 | 4.43 | 0.51 | 6.43*1,2 | 0.56 | +0.56 | 5.52 | 0.52 | 4.43 | 0.48 | 5.71 | 1.44 | – |
| 22:1 | 2.71 | 1.44 | 1.92 | 0.75 | 3.24 | 1.43 | – | 0.57 | 0.19 | 0.58 | 0.06 | 0.41 | 0.10 | – | 0.91 | 0.25 | 1.23 | 0.62 | 0.96 | 0.29 | – |
| 24:1 | 0.51 | 0.05 | 0.28 | 0.04 | 0.39 | 0.08 | – | 0.20 | 0.01 | 0.26 | 0.06 | 0.24 | 0.06 | – | 0.42 | 0.08 | 0.55 | 0.30 | 0.59 | 0.15 | – |
| ∑ МНЖК | 15.47 | 2.21 | 13.38 | 1.25 | 17.52 | 1.59 | – | 18.33 | 1.89 | 20.11 | 2.14 | 21.61 | 0.91 | – | 23.04 | 2.30 | 33.27 | 3.35 | 35.31 | 1.68 | +0.69 |
| 16:3n-3 | 0.72 | 0.26 | 0.68 | 0.15 | 0.54 | 0.10 | – | 0.09 | 0.01 | 0.18 | 0.03 | 0.25 | 0.09 | – | 0.44 | 0.13 | 0.27 | 0.07 | 0.32 | 0.09 | – |
| 18:3n-3 | 0.13 | 0.03 | 0.07 | 0.01 | 0.10 | 0.01 | – | 0.17 | 0.02 | 0.18 | 0.02 | 0.12 | 0.03 | – | 0.20 | 0.03 | 0.16 | 0.02 | 0.16 | 0.02 | – |
| 20:3n-3 | 0.14 | 0.03 | 0.19 | 0.03 | 0.13 | 0.02 | – | 0.19 | 0.02 | 0.18 | 0.01 | 0.14 | 0.02 | –0.49 | 0.76 | 0.24 | 0.38 | 0.12 | 0.21*2 | 0.03 | –0.60 |
| 20:5n-3 | 7.16 | 1.12 | 7.06 | 1.33 | 6.42 | 1.33 | – | 12.03 | 0.89 | 12.78 | 1.26 | 8.26*2 | 0.64 | –0.58 | 10.52 | 0.71 | 9.85 | 1.47 | 8.27 | 2.79 | – |
| 22:5n-3 | 0.41 | 0.06 | 0.41 | 0.05 | 0.39 | 0.07 | – | 0.16 | 0.02 | 0.28 | 0.05 | 0.26 | 0.08 | – | 0.63 | 0.13 | 0.39 | 0.10 | 0.82 | 0.19 | – |
| 22:6n-3 | 7.29 | 1.49 | 6.47 | 0.39 | 4.72 | 0.75 | –0.48 | 6.18 | 0.34 | 5.87 | 0.59 | 6.21 | 0.83 | – | 8.00 | 0.70 | 6.35 | 1.31 | 7.22 | 3.01 | – |
| ∑ n-3 ПНЖК | 15.85 | 2.49 | 14.88 | 1.25 | 12.32 | 2.07 | – | 18.82 | 0.88 | 19.46 | 1.19 | 15.23 | 1.36 | – | 20.55 | 1.35 | 17.40 | 2.64 | 17.01 | 5.64 | – |
| 18:2n-6 | 3.20 | 0.87 | 3.91 | 1.57 | 2.17 | 0.39 | – | 3.86 | 0.22 | 3.25 | 0.35 | 2.81 | 0.40 | –0.49 | 3.14 | 0.32 | 2.36 | 0.33 | 1.89 | 0.26 | –0.61 |
| 18:3n-6 | 0.83 | 0.14 | 0.69 | 0.11 | 0.78 | 0.07 | – | 2.91 | 0.17 | 2.75 | 0.21 | 1.62*1,2 | 0.09 | –0.77 | 2.44 | 0.18 | 2.05 | 0.23 | 1.08*1,2 | 0.13 | –0.77 |
| 20:2n-6 | 0.44 | 0.18 | 0.32 | 0.05 | 0.24 | 0.04 | – | 0.14 | 0.04 | 0.13 | 0.03 | 0.10 | 0.02 | – | 0.20 | 0.04 | 0.10 | 0.03 | 0.12 | 0.03 | – |
| 20:3n-6 | 0.25 | 0.06 | 0.20 | 0.03 | 0.24 | 0.08 | – | 0.34 | 0.08 | 0.37 | 0.07 | 0.21 | 0.03 | – | 0.34 | 0.06 | 0.24 | 0.09 | 0.20 | 0.04 | – |
| 20:4n-6 | 4.37 | 1.22 | 4.83 | 1.50 | 2.16 | 0.41 | – | 0.96 | 0.13 | 0.70 | 0.12 | 1.71 | 0.66 | – | 1.52 | 0.22 | 1.20 | 0.31 | 0.86 | 0.11 | –0.47 |
| 22:2n-6 | 0.42 | 0.09 | 0.46 | 0.04 | 0.36 | 0.02 | – | 0.25 | 0.02 | 0.36 | 0.04 | 0.27 | 0.05 | – | 0.69 | 0.17 | 0.47 | 0.09 | 0.54 | 0.13 | – |
| 22:4n-6 | 0.33 | 0.07 | 0.36 | 0.09 | 0.29 | 0.03 | – | 0.19 | 0.04 | 0.18 | 0.06 | 0.21 | 0.05 | – | 0.41 | 0.11 | 0.23 | 0.05 | 0.46 | 0.13 | – |
| 22:5n-6 | 0.37 | 0.06 | 0.30 | 0.06 | 0.28 | 0.04 | – | 0.18 | 0.03 | 0.25 | 0.07 | 0.19 | 0.03 | – | 0.69 | 0.13 | 0.35 | 0.06 | 0.51 | 0.13 | – |
| ∑ n-6 ПНЖК | 10.22 | 1.88 | 11.08 | 3.03 | 6.50 | 0.67 | – | 8.81 | 0.39 | 8.00 | 0.61 | 7.13 | 0.95 | –0.48 | 9.44 | 0.28 | 7.00 | 0.62 | 5.64*2 | 0.29 | –0.80 |
| ∑ НМРЖК | 3.10 | 0.74 | 3.10 | 0.59 | 2.98 | 0.72 | – | 2.56 | 0.28 | 2.91 | 0.51 | 2.25 | 0.23 | –0.64 | 3.22 | 0.26 | 2.57 | 0.34 | 2.37 | 0.53 | – |
| ∑ ПНЖК | 26.06 | 3.20 | 25.95 | 2.86 | 18.82 | 2.48 | – | 27.63 | 1.21 | 27.46 | 1.09 | 22.37*1,2 | 1.38 | –0.64 | 29.99 | 1.42 | 24.40 | 3.22 | 22.65 | 5.66 | – |
| НЖК/ПНЖК | 1.24 | 0.11 | 1.31 | 0.13 | 1.69 | 0.16 | +0.53 | 1.24 | 0.11 | 1.22 | 0.10 | 1.95*1,2 | 0.20 | +0.60 | 1.08 | 0.09 | 1.47 | 0.22 | 2.22 | 0.61 | – |
| n-3/n-6 ПНЖК | 1.70 | 0.27 | 1.71 | 0.31 | 1.90 | 0.24 | – | 2.14 | 0.06 | 2.51 | 0.26 | 2.31 | 0.33 | – | 2.18 | 0.14 | 2.44 | 0.16 | 3.04 | 1.05 | – |
| ИН | 4.27 | 0.34 | 3.95 | 0.35 | 3.46 | 0.41 | – | 4.27 | 0.34 | 4.44 | 0.35 | 2.99 | 0.34 | –0.51 | 5.07 | 0.39 | 4.89 | 1.05 | 5.55 | 2.03 | – |
Примечание. *1, 2, 3 – обозначены различия в составе липидов и жирных кислот отдельного органа в зависимости от размерной группы мидий, критерий Краскела-Уоллиса, P < 0.05; r – коэффициент ранговой корреляции Спирмена (где стоит прочерк “–” – корреляции не достоверны); НЖК – насыщенные жирные кислоты, МНЖК – мононенасыщенные жирные кислоты, ПНЖК – полиненасыщенные жирные кислоты, НМРЖК – неметиленразделенные жирные кислоты, ИН – индекс ненасыщенности. Расчет ИН производился по формуле: ИН = ((сумма % моноеновых ЖК) + (2 ∙ сумма % диеновых ЖК) + (3 ∙ сумма % триеновых ЖК) + (4 ∙ сумма % тетраеновых ЖК) + (5 ∙ сумма % пентаеновых ЖК) + (6 ∙ сумма % гексаеновых ЖК))/сумма % насыщенных ЖК.
Список литературы
Newell R.I.E. Ecosystem influences of natural and cultivated populations of suspension-feeding bivalve molluscs: a review //Journal of Shellfish Research. 2004. 23 (1): 51–62
Алимов А. Ф. Элементы теории функционирования водных экосистем. Москва, Наука, 2000
Dalsgaard J., John M. S., Kattner G., et al. Fatty acid trophic markers in the pelagic marine environment // Advances in marine biology. 2003. 46: 225–340 https://doi.org/10.1016/S0065-2881(03)46005-7
De Troch M., Boeckx P., Cnudde C., et al. Bioconversion of fatty acids at the basis of marine food webs: insights from a compound-specific stable isotope analysis // Marine Ecology Progress Series. 2012. 465: 53–67 https://doi.org/10.3354/meps09920
Napolitano G.E. Fatty acids as trophic and chemical markers in freshwater ecosystems // Lipids in freshwater ecosystems. Springer, New York, NY, 1999. P. 21–44 https://doi.org/10.1007/978-1-4612-0547-0_3
Tiselius P., Hansen B.W., Calliari D. Fatty acid transformation in zooplankton: from seston to benthos //Marine Ecology Progress Series. 2012. 446: 131–144 https://doi.org/10.3354/meps09479
Irisarri J., Fernández-Reiriz M.J., De Troch et al. Fatty acids as tracers of trophic interactions between seston, mussels and biodeposits in a coastal embayment of mussel rafts in the proximity of fish cages //Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 2014. 172: 105–115 https://doi.org/10.1016/j.cbpb.2014.04.006
Fokina N.N., Ruokolainen T.R., Nemova N.N. The effect of intertidal habitat on seasonal lipid composition changes in blue mussels, Mytilus edulis L., from the White Sea //Polar Record. 2018. 54 (2): 133–151 https://doi.org/10.1017/S0032247418000293
Müller-Navarra D.C. Food web paradigms: the biochemical view on trophic interactions //International Review of Hydrobiology. 2008. 93 (4–5): 489–505 https://doi.org/10.1002/iroh.200711046
Smith G.G., Thompson P.A., Ritar A.J., et al. Effects of starvation and feeding on the fatty acid profiles of Stage I phyllosoma of the spiny lobster, Jasus edwardsii // Aquaculture Research. 2003. 34 (5): 419–426 https://doi.org/10.1046/j.1365-2109.2003.00825.x
Langdon C.J., Waldock M.J. The effect of algal and artificial diets on the growth and fatty acid composition of Crassostrea gigas spat //Journal of the Marine Biological Association of the United Kingdom. 1981. 61 (2): 431–448. https://doi.org/10.1017/S0025315400047056
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


