Доклады Российской академии наук. Науки о жизни, 2020, T. 495, № 1, стр. 562-566
ФАГОЦИТАРНАЯ АКТИВНОСТЬ ЛЕЙКОЦИТОВ ГРЕНЛАНДСКИХ ТЮЛЕНЕЙ
Н. Н. Кавцевич 1, *, И. А. Ерохина 1, Т. В. Минзюк 1
1 Мурманский морской биологический институт
КНЦ РАН
Мурманск, Россия
* E-mail: kavtsevitsch2015@yandex.ru
Поступила в редакцию 12.05.2020
После доработки 10.07.2020
Принята к публикации 10.07.2020
Аннотация
В работе исследовали фагоцитарные и цитохимические показатели лейкоцитов периферической крови взрослых гренландских тюленей и щенков 1.5-месячного возраста. В образцах крови определяли фагоцитарное число – долю фагоцитирующих лейкоцитов и фагоцитарную активность – среднее число поглощенных частиц латекса на один лейкоцит. Различий между группами тюленей по средним значениям этих показателей не было выявлено. При корреляционном анализе у взрослых тюленей была обнаружена достоверная связь фагоцитарной активности лейкоцитов с содержанием в них гликогена (r = 0.89). Содержание катионного бактерицидного белка (КБ) в лейкоцитах взрослых животных было в 10–12 раз выше этого показателя у щенков. Корреляция между КБ и числом эозинофилов в крови у взрослых особей оказалась высокой (r = 0.88). Кроме того, у половозрелых тюленей содержание эозинофилов значительно больше, чем у щенков. Отмеченные особенности могут обеспечивать более высокую эффективность фагоцитоза и уничтожения поглощенных бактерий у взрослых тюленей по сравнению со щенками, несмотря на высокий уровень показателей первой, поглотительной, фазы фагоцитоза у последних.
Среди проблем современной эволюционной иммунологии одной из наиболее существенных является исследование соотношения между неспецифическим (врожденным) и специфическим (приобретенным) иммунитетом [1]. Проблема оценки эффективности механизмов резистентности к воздействию неблагоприятных факторов актуальна не только для содержащихся в неволе и редких, но и для промысловых видов морских млекопитающих, численность которых существенно снижается из-за интоксикаций и эпизо-отий [2, 3]. Давно сформулированная гипотеза [4] о существовании особенностей системы иммунитета у китообразных и ластоногих, обусловленных эволюцией в чистой, не содержавшей патогенных микроорганизмов суши, океанической среде, и обеспечивающих недостаточную иммунологическую резистентность в современных условиях, до настоящего времени не подтверждена. Высокий уровень заболеваемости морских млекопитающих связывают с влиянием загрязнения среды их обитания на здоровье, в том числе на систему иммунитета.
Фагоцитоз – наиболее древний клеточный механизм, обеспечивающий, наряду с гуморальными факторами, неспецифическую защиту от патогенных микроорганизмов. Неспецифические иммунологические реакции развиваются значительно быстрее, чем специфические. Это существенно для водных животных, находящихся в постоянном контакте со средой, в которой могут присутствовать патогенные микроорганизмы и ксенобиотики [5].
Сведения о бактерицидных функциях лейкоцитов морских млекопитающих немногочисленны. Так, установлена прямая зависимость фагоцитарной активности лейкоцитов крови детенышей северного морского котика от интенсивности инвазии Uncinaria lucasi [6]. Для дельфинов известно, что стресс, развивающийся у животных после отлова и помещения их на судно для транспортировки, сопровождается снижением фагоцитарных функций лейкоцитов, восстановление которых происходило только через 4–6 месяцев [7]. Общее количество лизосом и их число, содержащих катионные бактерицидные белки, уменьшается после отлова, транспортировки и в первые дни пребывания дельфинов в бассейне [8]. Определены некоторые показатели фагоцитоза лейкоцитов белух [9], обыкновенного, серого и гренландского тюленей [10].
Центральным звеном врожденного клеточного иммунитета являются фагоцитирующие лейкоциты. Они играют также роль медиаторов воспаления, обладают цитотоксическим, противоопухолевым действием [11]. Бактерицидная активность лейкоцитов обеспечивается кислород-зависимой системой (включающей миелопероксидазу, синглетный кислород, супероксидный анион, гидроксильный радикал, пероксид водорода, галогены) и кислород-независимой неферментной системой (включающей катионные белки, трансферрин, лактоферрин и молочную кислоту). Катионные белки (КБ) являются важной составной частью антимикробной защиты организма, а их недостаток приводит к резкому снижению неспецифической резистентности [12]. КБ проявляют бактерицидную активность в анаэробных условиях, что существенно для водных млекопитающих, подвергающихся воздействию гипоксии при нырянии.
О соотношении и взаимодействии реакций специфического и неспецифического иммунитета можно судить, исследуя их развитие в онтогенезе животных. Неспецифическая резистентность играет важную роль в обеспечении выживания щенков тюленей, поскольку система специфического иммунитета у млекопитающих после рождения еще только формируется. В настоящей работе мы определяли показатели фагоцитоза и некоторые цитохимические параметры лейкоцитов гренландских тюленей разного возраста.
МАТЕРИАЛ И МЕТОДЫ
Материал для исследования получен на зверобойном промысле в пос. Койда Архангельской обл. от щенков после ювенильной линьки (возраст 1–1.5 мес), серок, и взрослых животных. Выделяли группы: “нормальные” – хорошо упитанные детеныши весом 30–35 кг и “недокормленные” или “заморыши” – 10–15 кг.
Исследование фагоцитарных реакций проводили, используя наборы реактивов и методику, применяющиеся в клинических исследованиях человека. В качестве объекта фагоцитоза использовали частицы латекса диаметром 0.5–0.6 мкм. 0.05 мл взвеси частиц (2.5 × 107) в сбалансированном буферном солевом растворе Хенкса смешивали с 0.1 мл гепаринизированной крови и 0.05 мл раствора Хенкса или 0.05 мл 0.00025% продигиозана. Образцы инкубировали 1 ч при 37°С, периодически, каждые 5 мин, встряхивая пробирки. Таким методом определяется эффективность начальной, поглотительной фазы фагоцитоза, поскольку латекс клеткой не переваривается. Подсчет числа частиц латекса проводили в 100 лейкоцитах. Определяли фагоцитарное число (ФЧ) – процент фагоцитирующих клеток и фагоцитарную активность (ФА) – среднее число поглощенных частиц латекса на один лейкоцит. Резервные возможности фагоцитоза оценивали по величине индекса стимуляции (ИС) фагоцитарных реакций продигиозаном (липополисахарид Bacillus prodigiosum). Применяли также окрашивание мазков крови по Романовскому-Гимза и цитохимические методики: выявление гликогена, бактерицидных катионных белков [13]. Рассчитывали средний цитохимический коэффициент (СЦК). СЦК = (А1 × 1 + А2 × 2 + А3 × 3)/100, где А – число лейкоцитов с различным количеством выявляемого вещества. Препараты исследовали с масляной иммерсией (объектив 100×, окуляр 10×).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При окрашивании мазков крови тюленей по методу Романовского-Гимза типирование лейкоцитов, как правило, однозначно. В исследованных образцах крови тюленей, как и у многих видов наземных млекопитающих, включая представителей отряда хищных, филогенетически наиболее близких к настоящим тюленям, преобладали нейтрофилы. Взрослые животные отличались от щенков значительно более высоким числом эозинофильных лейкоцитов. Содержание гликогена в лейкоцитах взрослых тюленей и щенков было одинаково, а уровень катионного белка значительно выше (табл. 1).
Таблица 1.
Лейкоцитарная формула крови и цитохимические показатели лейкоцитов гренландских тюленей (M ± SE)
| Группа тюленей |
Типы лейкоцитов, % | ГЛ | КБ | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Н | Э | Б | М | Л | СЦК | ГЛ+ | СЦК | КБ+ | |
| Взрослые, n = 10 | 53.8 ± 3.6 | 19.3 ± 2.6 | 0.1 ± 0.1 | 2.7 ± 0.4 | 24.1 ± 4.2 | 1.57 ± 0.08 | 90.0 ± 2.2 | 0.45 ± 0.07 | 21.7 ± 2.9 |
| Серки, n = 10 | 60.8 ± 5.8 | 1.6 ± 0.6 | 0.2 ± 0.1 | 9.0 ± 0.1 | 28.4 ± 6.6 | 1.33 ± 0.09 | 86.9 ± 1.9 | 0.06 ± 0.01 | 2.7 ± 0.5 |
| “Недокормленные”, n = 10 | 61.3 ± 4.0 | 2.0 ± 0.4 | 0.2 ± 0.1 | 10.1 ± 1.1 | 26.4 ± 4.4 | 1.26 ± 0.10 | 82.4 ± 3.6 | 0.03 ± 0.01 | 1.7 ± 0.5 |
Как свидетельствуют данные, приведенные в табл. 2, различия между средними значениями для групп тюленей по всем показателям оказались статистически недостоверными (р > 0.05). Это согласуется с результатами опубликованного исследования обыкновенного, серого и гренландского тюленей: фагоцитарная активность лейкоцитов новорожденных животных и взрослых самок одинакова, в конце периода лактации у щенков она выше, чем у их матерей, затем постепенно снижается [10]. Однако индивидуальные колебания показателей фагоцитоза у гренландских тюленей велики, в особенности, по степени возрастания ФА у щенков-заморышей после стимуляции продигиозаном.
Таблица 2.
Показатели фагоцитарной активности лейкоцитов гренландских тюленей (M±SE, в скобках – пределы колебания показателей). ФЧ – фагоцитарное число, процент фагоцитирующих клеток, ФА – фагоцитарную активность, среднее число поглощенных частиц латекса на один лейкоцит
| Группы | ФЧ | ФА | ||||
|---|---|---|---|---|---|---|
| тюленей | спонт. | стимул. | ИС1, % | спонт. | стимул. | ИС2, % |
| Взрослые, n = 6 | 58.5±6.7 (32–74) | 68.34±5.8 (41–80) | 17.7 (0–25.4) | 18.2±1.4 (14.2–23.5) | 22.7±2.3 (14.2–31.6) | 25.0 (0–54.1) |
| Серки, n = 10 | 61.3±4.4 (36–86) | 70.6±4.5 (58–86) | 15.1 (0–72.6) | 13.7±1.6 (8.7–26.5) | 16.2±1.8 (10.0–25.5) | 18.3 (0–31.2) |
| “Недокормленные”, n = 10 | 49.5±5.0 (30–68) | 56.2±5.4 (29–79) | 13.5 (0–45.7) | 16.0±1.6 (10.4–24.7) | 20.6±2.0 (13.5–31.5) | 28.2 (0–110) |
При корреляционном анализе были выявлены существенные связи между некоторыми цитохимическими и фагоцитарными показателями. Продемонстрирована высокая корреляция между содержанием гликогена и фагоцитарной активностью лейкоцитов у взрослых тюленей, в отличие от щенков (рис. 1). Исследование лейкоцитов, стимулированных продигиозаном, дало сходный результат: r = 0.90, r = 0.14, r = 0.41 (взрослые, нормальные щенки и щенки-заморыши соответственно).
Кроме того, была выявлена достоверная корреляция резерва фагоцитарной активности (ИС2) и относительного количества гликогена нейтрофилов у нормальных щенков (r = 0.68, р < 0.05), в отличие от заморышей (r = 0.15) и взрослых (r = 0.32). Фагоцитоз – энергозависимый процесс. Различное содержание гликогена (и особенности его обмена) обеспечивает разную энергетическую базу для фагоцитоза и других функций клеток. У истощенных, длительно голодающих щенков тюленей высокий уровень гликогена, вероятно, не является предпосылкой эффективного фагоцитоза. Запасы гликогена у них – резерв, расходуемый в последнюю очередь, а для обеспечения жизненно важных функций используется энергия, получаемая из подкожного жира и белков.
У взрослых тюленей была выявлена высокая корреляция числа эозинофилов и лейкоцитов, в которых присутствует бактерицидный катионный белок (рис. 2). По-видимому, именно с эозинофилами связана реализация фагоцитарной функции у водных млекопитающих. Высокий уровень фагоцитарной активности, который продемонстрировали лейкоциты щенков гренландских тюленей обеспечили именно нейтрофильные лейкоциты. Однако содержание бактерицидного катионного белка в этих клетках было крайне низким, и, следовательно, уничтожение поглощенных бактерий происходило, по-видимому, недостаточно эффективно. У тюленей, начавших самостоятельное кормление (возраст – 3–3.5 месяца), число эозинофилов возрастало до 7–40% [14]. При этом содержание бактерицидного катионного белка повышалось до уровня взрослых животных. Вероятно, становление фагоцитарной системы происходит именно на данном этапе онтогенеза гренландских тюленей.
Рис. 1.
Корреляция фагоцитарной активности (ФА) и содержания гликогена в лейкоцитах гренландских тюленей (СЦК – средний цитохимический коэффициент).
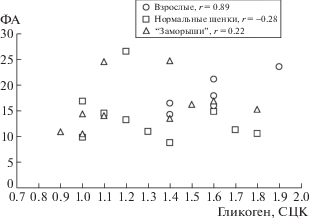
Рис. 2.
Соотношение числа эозинофилов (Э) и лейкоцитов, содержащих бактерицидный катионный белок (КБ+).
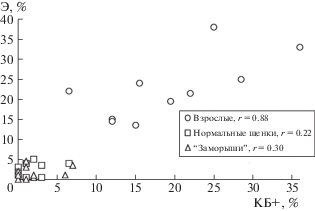
Для всей группы исследованных тюленей выявлена достоверные корреляции между ФЧ после стимуляции лейкоцитов продигиозаном и числом эозинофилов и клеток, содержащих катионный белок (r = 0.94 и r = 0.99 соответственно). Это, наряду с эозинофилией у взрослых тюленей, позволяет предположить, что ведущая роль в фагоцитарных и, вероятно, других реакциях неспецифического иммунитета тюленей принадлежит эозинофилам.
Гренландский тюлень – наиболее многочисленный вид ластоногих в северном полушарии, играющий значительную роль в экосистемах арктических морей. Состояние популяций морских млекопитающих в значительной степени определяется уровнем загрязнения среды обитания, влияющим на функционирование клеточных и гуморальных механизмов иммунной резистентности организмов. Детеныши тюленей могут быть особенно уязвимыми по отношению к воздействию различных патогенных факторов. Полученные в данной работе результаты целесообразно дополнить, исследуя как специфические, так и неспецифические реакции иммунитета тюленей различного возраста.
Список литературы
Галактионов В.Г. // Медицинская иммунология. 2004. Т. 6. № 3–5. С. 159–170.
Harwood J., Reijnders F. // New Sci. 1988. V. 119. № 1634. P. 28–29.
Хураськин Л.С., Захарова Н.А., Кузнецов В.В. и др. // Морские млекопитающие Голарктики. М., 2002. С. 276–278.
Cavagnolo R. // Develop. Comp. Immunol. 1979. V. 3. № 2. P. 245–257.
Desforges W., Sonne C., Levin M. et al. // Environment International. 2016. V. 86. P. 126–139.
Букина Л.А. / IX Всесоюз. совещ. по изучению, охране и рациональному использованию морских млекопитающих, 9–14 сентября 1986 г., г. Архангельск: Тез. докл. Архангельск, 1986. С. 60–61.
Матишева С.К., Шапунов В.М. Влияние стресса пленения на фагоцитарные реакции лейкоцитов крови черноморских дельфинов / Х Всесоюз. совещ. по изучению, охране и рациональному использованию морских млекопитающих, 2–5 октября 1990 г., г. Светлогорск: Тез. докл. М., 1990. С. 187–188.
Швацкий А.Б., Радыгин Г.Ю., Живкова Е.П. и др. / Х Всесоюз. совещ. по изучению, охране и рациональному использованию морских млекопитающих, 2–5 октября 1990 г., г. Светлогорск: Тез. докл. М., 1990. С. 328–329.
De Guise S., Flipo D., Boehm J.R. et al. // Veterinary Immunology and Immunopathology. 1995. V. 47. № 3–4. P. 351–362.
Frouin H., Lebeuf M., Hammill M. et al. // Veterinary Immunology and Immunopathology. 2010. V. 134. № 3–4. P. 160–168.
Зайчик А.Ш., Чурилов Л.П. Механизмы развития болезней и синдромов. СПб.: ЭЛБИ-СПб, 2002. 507 с.
Пигаревский В.Е. Зернистые лейкоциты и их свойства. М.: Медицина, 1978. 128 с.
Бутенко З.А., Глузман Д.Ф., Зак К.П. и др. Цитохимия и электронная микроскопия клеток крови и кроветворных органов. Киев: Наукова думка, 1974. 248 с.
Кавцевич Н.Н. Морфологические и цитохимические особенности клеток крови морских млекопитающих в связи с адаптацией к среде обитания. Дисс. … докт. биол. наук. Мурманск, 2011. 243 с.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


