Доклады Российской академии наук. Науки о жизни, 2020, T. 495, № 1, стр. 658-662
НОВЫЙ PH-ЧУВСТВИТЕЛЬНЫЙ МИКРОБНЫЙ РОДОПСИН ИЗ SPHINGOMONAS PAUCIMOBILIS
Н. Маляр 1, , И. С. Охрименко 1, , Л. Е. Петровская 2, , А. А. Алексеев 1, 4, 5, 6, К. В. Ковалев 1, 3, 4, 5, 6, Д. В. Соловьев 1, 7, 8, П. А. Попов 9, 1, Т. И. Рокицкая 10, Ю. Н. Антоненко 10, Д. В. Забельский 1, 4, 5, Д. А. Долгих 2, 11, академик РАН М. П. Кирпичников 2, 11, В. И. Горделий 1, 3, 4, 5, **
1 Московский физико-технический институт
Долгопрудный, Россия
10 НИИ Физико-химической биологии
им. А.Н. Белозерского Московского государственного университета имени Ломоносова
Москва, Россия
11 Московский государственный университет имени Ломоносова, биологический факультет
Москва, Россия
2 Институт биоорганической химии им. академиков
М. М. Шемякина и Ю. А. Овчинникова
Российской академии наук
Москва, Россия
3 Institut de Biologie Structurale (IBS), Université Grenoble Alpes, CEA, CNRS
Гренобль, Франция
4 Institute of Biological Information Processing (IBI-7: Structural Biochemistry), Forschungszentrum Jülich GmbH
Юлих, Германия
5 JuStruct: Jülich Center for Structural Biology, Forschungszentrum Jülich GmbH
Юлих, Германия
6 Institute of Crystallography, University of Aachen (RWTH)
Ахен, Германия
7 Институт проблем безопасности атомных электростанций НАН Украины
Киев, Украина
8 Объединенный институт ядерных исследований
Дубна, Россия
9 Сколковский институт науки и технологий
Москва, Россия
** E-mail: valentin.gordeliy@ibs.fr
Поступила в редакцию 03.09.2020
После доработки 07.09.2020
Принята к публикации 07.09.2020
Аннотация
В данной работе впервые охарактеризован родопсин SpaR из Sphingomonas paucimobilis, аэробной бактерии, вызывающей оппортунистические инфекции. Анализ аминокислотной последовательности SpaR выявил, что этот белок обладает необычным мотивом DTS, не встречающимся ранее в родопсинах из протеобактерий. Мы показали, что родопсин SpaR функционирует как протонная помпа при низких pH, однако транспорт протонов почти полностью отсутствует в нейтральной и щелочной среде. Скорость фотоцикла белка в мицеллах детергента уменьшается с ростом pH за счет замедления репротонирования Шиффова основания. Наши результаты показывают, что новый микробный ионный транспортер SpaR интересен как для фундаментальных исследований мембранных белков, так и в качестве инструмента для оптогенетики.
ВВЕДЕНИЕ
Микробные родопсины – наиболее распространенные светочувствительные белки, встречающиеся в микроскопических организмах всех доменов жизни, включая вирусы [1]. Развитие оптогенетики привело к быстрому росту количества структурно-функциональных исследований микробных родопсинов с целью получения оптогенетических инструментов с новыми свойствами [2]. Для поиска новых родопсинов зачастую применяют метагеномный анализ, методы молекулярной филогенетики; при выборе новых объектов исследования особое внимание обращают на необычный мотив консервативных аминокислотных остатков. Наиболее изученная светочувствительная протонная помпа бактериородопсин H. salinarum (bR) обладает DTD мотивом (D85, T89 и D96 – аминокислотные остатки, ключевые для переноса протона) [3].
Ген, кодирующий опсин SpaR, был обнаружен нами в ходе биоинформатического поиска по открытым базам метагеномных данных [4]. Он содержится в геноме строго аэробной бактерии S. paucimobilis NBRC 13935 [5], выделенной из больничной вентиляции, обнаруженной также в клинических образцах и имеющей ряд других водных и грунтовых ареалов обитания [6, 7]. Анализ аминокислотной последовательности SpaR выявил наличие мотива DTS. Родопсины из протеобактерий с таким мотивом не были охарактеризованы ранее. Обнаруженный нами белок наиболее близок к недавно описанной филогенетической группе родопсинов с DTG-мотивом, в частности, содержит характерный для этой группы консервативный остаток гистидина H37 [8]. Авторы работы [8] описали родопсины из бактерий Pseudomonas putida (PspR) и Pantoea ananatis (PaR), в которых в положении, соответствующем остатку D96 бактериородопсина, являющегося карбоксильным донором протона для Шиффова основания (ШО), размещен G84. Кроме того, остаток T46 бактериородопсина, с которым D96 связан водородной связью, заменен гистидином H37, консервативным во всей филогенетической группе белков с мотивом DTG. В работе была показана способность PspR и PaR к активному транспорту протонов и высказано предположение, что именно H37 участвует в формировании комплекса, обеспечивающего репротонирование ШО.
В данной работе мы охарактеризовали родопсин SpaR спектроскопическими методами и провели эксперименты по определению его ионной селективности в клетках и в липидных везикулах.
МАТЕРИАЛЫ И МЕТОДЫ
Последовательность нуклеотидов, кодирующая SpaR (UniProt ID: A0A0C9NB29), была оптимизирована для экспрессии в Escherichia coli с использованием Codon Optimization tool (Integrated DNA Technologies). Нуклеотидная последовательность на 5'-конце была оптимизирована с помощью RNA WebServer (Institute for Theoretical Chemistry, University of Vienna) с целью уменьшения вероятности образования шпилек РНК в области включающей сайты связывания рибосомы. Ген был получен сборкой из 14 перекрывающихся олигонуклеотидов (синтезированных “Евроген”) методом ПЦР в две стадии [9] и клонирован в экспрессионный вектор pET32b (“Novagen”) по сайтам рестрикции NdeI и XhoI. Таким образом был присоединен ген, кодирующий полигистидиновый таг на 3´-конце с сохранением рамки считывания. Экспрессию в клетках E. coli штамма C41(DE3) и очистку белка SpaR проводили по протоколу, описанному ранее [10]. Спектры поглощения регистрировали на спектрофотометре Synergy™ HT Multi-Mode Microplate Reader (“BioTek Instruments”). Установка для импульсного фотолиза аналогична описанной ранее [11] и включает в себя лазер Brilliant B Nd:YAG laser (“Quantel”, Франция), генерирующий импульсы с энергией около 2 мДж длительностью 4 нс на длине волны 500 нм, монохроматоры MSH-150 (“LOT”, Германия), источник света Xe-arc lamp, 75W (“Hamamatsu”, Япония), детектор PMT detector (R12829, “Hamamatzu”), два цифровых осциллографа (Keysight DSO-X 4022A). Регистрацию изменений поглощения начинали спустя 700 нс после лазерного импульса до окончания фотоцикла; на длинах волн от 330 до 730 нм с шагом 10 нм. Мы проанализировали полученные данные, используя глобальное фитирование с помощью программы MEXFIT [12]. Для регистрации изменения pH суспензии клеток E. coli или липидных везикул в ответ на освещение использовали pH-метр (S20 SevenEasy™, “Mettler Toledo”). Образец (3 мл) помещали в стеклянную колбу c тефлоновым магнитным мешальником внутри. Все измерения проводили при температуре образца 0°C. Клетки и липидные везикулы освещали в течение 5 и 10 мин соответственно рефлекторной лампой холодного света (Olympus KL2500-LCD, 250 Вт). Измерения повторяли в тех же условиях после добавления 30 мМ протонофора СССР (карбонил цианид m-хлорфенил гидразон, Carbonyl cyanide m-chlorophenyl hydrazone, CCCP).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
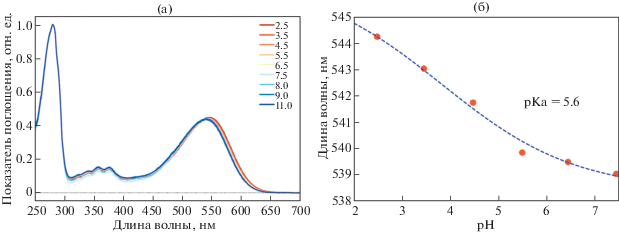
Положение максимума поглощения белка SpaR в мицеллах ДДМ (додецилмальтозид; n-dodecyl-β-Dmaltoside; DDM, ДДМ) составляет 541 нм при pH 7.5 и практически не зависит от pH в диапазоне от 2.5 до 11.0 (рис. 1а). Максимум поглощения сдвигается при изменении pH от 2.5 до 7.5, что соответствует протонированию противоиона ШО D73, а pKa акцептора протона составляет 5.6 (рис. 1б).
Рис. 1.
(а) Спектры поглощения SpaR в мицеллах ДДМ при различных значениях pH в смеси 6 буферов (10 мM цитрата, 10 мM MES, 10 мM HEPES, 10 мM MOPS, 10 мM CHES и 10 мM CAPS), включающих 100 мM NaCl; (б) pH-зависимость положения максимума поглощения SpaR в мицеллах ДДМ (красные кружки), фитированная сигмоидной кривой (синим пунктиром). pKa акцептора протона получен путем определения точки перегиба сигмоиды.
Фотоцикл SpaR был охарактеризован методом импульсного фотолиза. Мы показали, что длительность фотоцикла SpaR значительно зависит от pH (рис. 2). Схематическое изображение фотоциклов и временные константы, полученные в результате глобального фитирования 7-ю экспонентами кинетики фотоцикла при pH 5.2 и 8.0, представлены на рис. 2а. На рис. 2б представлена pH-зависимость кинетики фотоцикла SpaR в мицеллах ДДМ (додецилмальтозид; n-dodecyl-β-Dmaltoside; DDM, ДДМ), измеренная на трех характерных длинах волн 400 нм, 570 нм и 630 нм. Установлено, что при возрастании рН длительность τ фотоцикла SpaR увеличивается более, чем в 30 раз: от τ = 90 мс при pH 5.2 до τ = 3 с при pH 8.0. На основе модели фотоцикла bR [12] , мы заключаем, что в фотоцикле SpaR присутствуют аналоги интермедиатов K, M1 (М400), M2 (М410), N1, N2, а также N3 при низком pH. В отличие от bR, не наблюдается промежуточных состояний, подобных L- и O-состояниям. При pH 5.2 интермедиат K распадается на смесь K и M410 (K/M1) в течение 6 мкс, затем через 27 мкс K/M1 распадается с накоплением M1, а спустя 280 мкс происходит накопление M2. M2-состояние распадается до основного состояния через смесь M2 и трех спектрально неразличимых N1, N2 и N3-состояний. Весь фотоцикл занимает около 90 мс (рис. 2а). При pH 8.0 фотоцикл гораздо более длинный (3 с). Распад M1 занимает примерно такое же время, как при pH 5.2, но затем кинетика фотоцикла существенно замедляется. К тому же, в отличие от pH 5.2, фаза M2/N3 отсутствует.
Рис. 2.
(а) Предлагаемые модели фотоцикла SpaR в мицеллах ДДМ в буфере, содержащем 100 мM NaCl, 50 мM Na2HPO4/NaH2PO4 при pH 5.2 и 8.0 (слева направо); (б) изменение поглощения SpaR в мицеллах ДДМ на 400 нм (красным), 570 нм (синим), 630 нм (зеленым), регистрируемое в течение фотоцикла, при pH 5.2 и 8.0 (слева направо).

Интересно, что в работе Harris и соавторов [8] для белка PspR также показано замедление фотоцикла за счет удлиненного распада М-состояния. Это позволяет предположить, что SpaR и PspR могут иметь похожие функции и использовать аналогичные механизмы переноса протона.
С помощью метода регистрации светоиндуцированного изменения pH мы наблюдали эффект закисления суспензии клеток E. coli C41(DE3), экспрессирующих SpaR, в 100 мM NaCl (pH 6.2, буфер отсутствует) при освещении. Наблюдаемый эффект существенно уменьшается в при-сутствии протонофора СССР (карбонил цианид m-хлорфенил гидразон, Carbonyl cyanide m-chlorophenyl hydrazone, CCCP), что указывает на транспорт протонов из клетки наружу (рис. 3а). Такое поведение характерно для протонных помп, в том числе бактериородопсина (bR) и протеородопсина (pR) [13]. Для анализа зависимости эффекта от pH мы провели аналогичные эксперименты со SpaR, встроенным в одиночные липидные везикулы. При pH 6.0 наблюдалось защелачивание среды (рис. 3б), аналогично результатам подобных экспериментов с bR и pR, поскольку они ориентируются в везикулах С-концом наружу и закисляют внутреннее пространство везикул под действием света. Мы наблюдали значительное изменение pH под действием света только при pH 6.0, а при pH 7.5 оно было сравнимо с контролем (липидные везикулы без SpaR). Проведенные эксперименты еще раз подтверждают выраженную pH-зависимость активного транспорта протонов родопсином SpaR.
Рис. 3.
(а) Изменение pH суспензии клеток E. coli, экспрессирующих SpaR под действием освещения с и без добавления СССР (100 мM NaCl, pH 6.2). Период освещения обозначен оранжевой линией; (б) изменение pH под действием света в одиночных липидных везикулах со встроенным SpaR при различных pH с/без добавления CCCP. Период освещения обозначен оранжевой линией. Для уравновешивания везикул в нужном pH проводили диализ против 200 мл раствора 100 мM NaCl, доведенного до нужного значения pH при 4°C (четыре смены). В качестве контроля использовались одиночные везикулы без белка.

Таким образом, в нашей работе описан новый родопсин SpaR, недавно найденный в геноме строго аэробной оппортунистической бактерии S. paucimobilis NBRC 13935. Проведенная функциональная и структурная характеристика выявила следующие особенности: при pH менее 7.0 SpaR функционирует как светочувствительная протонная помпа, переносящая протоны наружу из клетки, как в одиночных липидных везикулах, так и в клетках E. coli. Скорость фотоцикла замедляется с ростом pH. Замедление фотоцикла вероятно происходит за счет замедления распада М2-состояния, и следовательно, более длительного репротонирования Шиффова основания.
При защелачивании среды в липидных везикулах или во внеклеточном растворе, помповая активность SpaR практически исчезает. Следовательно, функция белка, возможно, не ограничена pH-зависимым транспортом протонов через мембрану. Не понятна также роль SpaR в жизнедеятельности организма-хозяина, бактерии S. paucimobilis NBRC 13935. Эта бактерия может вызывать опасные оппортунистические инфекции у человека, поэтому не исключено, что установление роли родопсина в ее метаболизме может помочь в разработке нового типа антибактериальных средств [14]. Интересно, что нами был обнаружен родопсин, на 99% идентичный SpaR, в алкалофильной бактерии Sphingomonas sp. S17 [15]. Это может означать, что родопсин SpaR, как и его аналог, адаптирован алкалофильной бактерией для предотвращения закисления цитоплазмы при попадании бактерии в кислую среду, но для окончательного ответа необходимо дальнейшее изучение.
Анализ аминокислотной последовательности SpaR и полученные нами результаты позволяют предположить, что SpaR может иметь функциональную схожесть с родопсинами с DTG-мотивом, механизмы функционирования которых и физиологическая роль тоже не до конца ясны [8]. Таким образом, требуется поиск и дальнейшая структурная и функциональная характеристика большой группы родопсинов как с DTG, так и с DTS-мотивом.
Список литературы
Gushchin I., Gordeliy V. Microbial rhodopsins // Subcellular Biochemistry. 2018. V. 87. P. 19–56.
Kirpichnikov M.P., Ostrovsky М.А. Оптогенетика и зрение // Вестник Российской Академии наук. 2019. Т. 89. № 2. С. 125–130.
Luecke H., Schobert B., Richter H.T., et al. Structure of bacteriorhodopsin at 1.55 Å resolution // J. Mol. Biol. 1999. V. 291. № 4. C. 899–911.
Ushakov A., Grudinin S., Okhrimenko I., et al. Knowledge-based prediction model for characterization of microbial rhodopsins for optogenetics // FEBS J. 2016. V. 283. September. C. P-03.03.2-014.
Pan L., Zhou H., Li J., et al. Draft genome sequence of Sphingomonas paucimobilis strain LCT-SP1 isolated from the Shenzhou X spacecraft of China // Stand. Genomic Sci. Standards in Genomic Sciences. 2016. V. 11. № 1. P. 18.
Hardjo Lugito N.P., Cucunawangsih, Kurniawan A. A Lethal Case of Sphingomonas paucimobilis Bacteremia in an Immunocompromised Patient // Case Rep. Infect. Dis. 2016. V. 2016. P. 1–4.
Maragakis L.L., Chaiwarith R., Srinivasan A., et al. Sphingomonas paucimobilis Bloodstream Infections Associated with Contaminated Intravenous Fentanyl1 // Emerg. Infect. Dis. 2009. V. 15. № 1. P. 12–18.
Harris A., Ljumovic M., Bondar A.N., et al. A new group of eubacterial light-driven retinal-binding proton pumps with an unusual cytoplasmic proton donor // Biochim. Biophys. Acta - Bioenerg. Elsevier B.V. 2015. V. 1847. № 12. P. 1518–1529.
Stemmer W.P.C., Crameri A., Ha K.D., et al. Single-step assembly of a gene and entire plasmid from large numbers of oligodeoxyribonucleotides // Gene. 1995. V. 164. № 1. P. 49–53.
Shevchenko V., Mager T., Kovalev K., et al. Inward H + pump xenorhodopsin: Mechanism and alternative optogenetic approach // Sci. Adv. 2017. V. 3. № 9. P. e1603187.
Bratanov D., Kovalev K., Machtens J., et al. Unique structure and function of viral rhodopsins // Nat. Commun. Springer US, 2019. V. 10. № 1. P. 4939.
Chizhov I., Chernavskii D.S., Engelhard M., et al. Spectrally silent transitions in the bacteriorhodopsin photocycle // Biophys. J. Elsevier, 1996. V. 71. № 5. P. 2329–2345.
Yoshizawa S., Kumagai Y., Kim H., et al. Functional characterization of flavobacteria rhodopsins reveals a unique class of light-driven chloride pump in bacteria // Proc. Natl. Acad. Sci. 2014. V. 111. № 18. P. 6732–6737.
Gushchin I., Melnikov I., Polovinkin V., et al. Mechanism of transmembrane signaling by sensor histidine kinases // Science. V. 356. Iss. 6342. eaah6345.
Farias M.E., Revale S., Mancini E., et al. Genome Sequence of Sphingomonas sp. S17, Isolated from an Alkaline, Hyperarsenic, and Hypersaline Volcano-Associated Lake at High Altitude in the Argentinean Puna // J. Bacteriol. 2011. V. 193. № 14. P. 3686–3687.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


