Доклады Российской академии наук. Науки о жизни, 2020, T. 495, № 1, стр. 653-657
ИНГИБИРОВАНИЕ ГИСТОНДЕАЦЕТИЛАЗ 4 И 5 УМЕНЬШАЕТ ПРОТЕОЛИЗ ТИТИНА И ПРЕДОТВРАЩАЕТ СНИЖЕНИЕ УРОВНЯ ЭКСПРЕССИИ ГЕНА TTN ПРИ РАЗВИТИИ АТРОФИИ В M. soleus КРЫСЫ ПОСЛЕ СЕМИСУТОЧНОЙ ГРАВИТАЦИОННОЙ РАЗГРУЗКИ
Ю. В. Грицына 1, А. Д. Уланова 1, С. С. Попова 1, А. Г. Бобылёв 1, В. К. Жалимов 2, Т. Л. Немировская 3, Б. С. Шенкман 3, И. М. Вихлянцев 1, *
1 Инcтитут теоретической и экспериментальной биофизики Российской академии наук
Московской области, Пущино, Россия
2 Институт биофизики клетки Российской Академии наук – обособленное подразделение ФИЦ ПНЦБИ Российской академии наук
Московской области, Пущино, Россия
3 ГНЦ РФ – Институт медико-биологических проблем Российской академии наук
Москва, Россия
* E-mail: ivanvikhlyantsev@gmail.com
Поступила в редакцию 22.07.2020
После доработки 17.08.2020
Принята к публикации 17.08.2020
Аннотация
Исследовано влияние гистондеацетилаз 4 и 5 на развитие атрофии m. soleus крысы, а также на содержание в ней кальпаина-1, титина и уровень экспрессии его гена (TTN) при 7-суточной гравитационной разгрузке. Развитие индуцируемых гравитационной разгрузкой атрофических изменений в m. soleus крысы сопровождалось увеличением содержания кальпаина-1, повышением протеолиза титина и снижением содержания его мРНК. Ингибирование гистондеацетилаз 4 и 5 на фоне разгрузки не устраняло развитие атрофии, но в значительной мере предотвращало протеолиз и снижение экспрессии гена титина.
Известно, что пребывание в условиях гравитационной разгрузки приводит к атрофическим изменениям в антигравитационных мышцах, в частности, в m. soleus [1]. Развитие мышечной атрофии в этих условиях является следствием ингибирования белкового синтеза и повышения протеолиза [2, 3], в частности, гигантского белка титина (коннектина) [4]. Этот эластичный белок, образуя своеобразную молекулярную пружину, соединяющую концы миозиновых нитей с Z-диском саркомера, регулирует актин-миозиновое взаимодействие, участвует в поддержании высокоупорядоченной саркомерной структуры и мышечной жесткости [5]. Повышенный протеолиз титина, сопровождающийся снижением его содержания, является следствием гиперактивации кальций-зависимых протеаз кальпаинов в условиях гравитационной разгрузки [3, 6]. Показано, что значительное снижение содержания титина происходит только на седьмые сутки гравитационной разгрузки [4].
В последние годы обсуждается участие гистондеацетилаз (HDACs), в том числе HDAC 4 и HDAC 5, в развитии мышечной атрофии. У мышей с двойным нокаутом по HDAC4 и HDAC5 14-суточная денервация сопровождалась значительно меньшим снижением массы скелетных мышц голени, чем у контрольных мышей [7]. Применение ингибитора HDAC4 и HDAC5 трихостатина A снижало степень развития атрофических изменений в m. soleus крысы после 14-суточной гравитационной разгрузки [8]. Однако использование этого ингибитора на фоне 3-суточной гравитационной разгрузки не предотвращало развития атрофии m. soleus у крыс [9]. Таким образом, динамика воздействия HDACs 4/5 на мышечную атрофию при разгрузке остается непонятной.
В данной работе мы исследовали, как ингибирование HDAC4 и HDAC5 влияет на степень развития атрофии m. soleus и содержание титина после 7-суточной гравитационной разгрузки, когда протеолитические изменения в титине наиболее выражены.
Использовали самцов крыс Вистар (210 ± 10 г, виварий ИТЭБ РАН, Пущино). Протокол № 24/2019 от 05 апреля 2019 г. комиссии по биологической безопасности и биоэтике ИТЭБ РАН. Животные были распределены на три группы (по 7 крыс в каждой): 1-я – контрольная, 2-я – вывешивание в течение 7 суток; 3-я – вывешивание в течение 7 суток и внутрибрюшинное введение специфического ингибитора гистондеацетилаз 4 и 5 LMK235 (Sigma–Aldrich) [10] в концентрации 1 мг/кг в сутки. Ингибитор LMK235 растворяли в 2.5% ДМСО (Sigma–Aldrich) в физиологическом растворе и вводили в объеме 200 мкл. Животным 1-й и 2-й групп вводили идентичные объемы 2.5% ДМСО в физиологическом растворе. После эвтаназии крыс трибромэтанолом (240 мг/кг–1 интраперитонеально, Sigma–Aldrich) камбаловидную мышцу (m. soleus) взвешивали, замораживали в жидком азоте и хранили при –75°С.
Обратную транскрипцию и ПЦР в режиме реального времени проводили по методу [11]. Использовали праймеры, специфичные к генам исследуемых белков (титину (TTN) и референсному гену GAPDH) [11], а также праймеры к гену кальпаина-1 (For: TGAGTGCTTATGAGATGAGG; Rev: GAGTAGCGGGTGATGATGAG). Экстракцию и ДСН-гель-электрофорез гигантского белка титина проводили по методу [4]. Экстракцию кальпаина-1 (основного фермента, протеолизирующего титин) проводили по методу [12]. ДСН-гель-электрофорез кальпаина-1 и GAPDH (референсного белка) проводили в 10% разделяющем ПААГ, используя минисистему Bio-Rad Laboratories. Для проведения вестерн-блоттинга использовали следующие первичные антитела: к кальпаину-1 (1:1000, ab28258, Abcam) и GAPDH (1:1000, ab37168, Abcam). В качестве вторичных антител использовали антитела, конъюгированные с щелочной фосфатазой (1:3000, ab6722, Abcam). Для визуализации белковых полос использовали раствор NBT/BCIP (Roche). Денситометрию проводили с помощью компьютерной программы Total Lab v1.11 (Newcastle Upon Tyne). Статистический анализ проводили с помощью пакета SigmaPlot 11.0 (Systat Software, Inc.). Различия считали статистически значимыми при р < 0.05. Данные представлены в виде среднего значения (М) ± стандартное отклонение (SD).
Проведенные ранее исследования показали, что гистондеацетилазы класса II (HDAC4 и HDAC5), активируясь в скелетных мышцах в ответ на денервацию, подавляют активность Dach2, который является негативным регулятором миогенина [7]. Миогенин, в свою очередь, активирует атрогин-1- и MuRF1 – Е3 убиквитинлигазы, которые являются частью системы убиквитинопосредованного распада белка в протеасомах. Активация этих ферментов наблюдается в скелетных мышцах при развитии атрофии не только в ответ на денервацию [7], но и в условиях гравитационной разгрузки [13]. При этом увеличивается содержание кальпаина-1 и наблюдается его гиперактивация [3, 6], что вносит существенный вклад в развитие мышечной атрофии за счет повышенного протеолиза белков саркомерного цитоскелета, в частности, титина.
Мы предположили, что ингибирование HDACs 4 и 5 в m. soleus крысы на фоне 7-суточной гравитационной разгрузки должно предотвратить увеличение содержания кальпаина-1, повышенный протеолиз титина и привести к уменьшению уровня развития атрофии. Поскольку HDACs рассматриваются как основные транскрипционные репрессоры, мы предположили, что их ингибирование должно привести к увеличению экспрессии гена TTN.
Различий в массе тела крыс трех групп мы не выявили (табл. 1). Снижение массы m. soleus (на 26.8% и 30.5%, p < 0.01) и индекса “масса m. soleus/масса тела животного” (на 24.7% и 27.8%, p < 0.01) мы обнаружили во второй и третьей группах, соответственно, относительно контроля (табл. 1).
Таблица 1.
Изменение массы животных, массы m. soleus и соотношения массы m. soleus и массы тела у крыс после 7-суточной гравитационной разгрузки (n = 7; M ± SD)
| Группа | Масса животного, г | Масса m. soleus, г | Масса m. soleus/ масса тела, мг/г |
|---|---|---|---|
| 1-я (контроль) | 211.1 ± 8.8 | 0.082 ± 0.006 | 0.389 ± 0.020 |
| 2-я (вывешивание) | 204.8 ± 6.9 | 0.060 ± 0.008** | 0.293 ± 0.035** |
| 3-я (вывешивание + ингибитор LMK235, 1 мг/кг) | 201.1 ± 5.2 | 0.057 ± 0.013** | 0.281 ± 0.062** |
Эти данные свидетельствуют об одинаковом уровне развития атрофических изменений в m. soleus крыс второй и третьей групп. Таким образом, наше предположение, что ингибирование HDACs 4 и 5 должно привести к уменьшению уровня развития атрофии m. soleus на 7 сутки разгрузки, не подтвердилось. Однако нашли подтверждение другие наши предположения. В группе с ингибированием HDACs 4/5 содержание кальпаина-1 не отличалось от такового в контрольной группе, в то время как в m. soleus крыс, вывешенных без ингибитора, содержание этого фермента было существенно выше (p < 0.05, рис. 1). Кальций-активируемая протеаза кальпаин-1 является основным ферментом протеолизирующим титин [12]. Показано, что развитие мышечной атрофии в условиях гравитационной разгрузки сопровождается увеличением содержания кальпаина-1 [3], а также повышением активности этой протеазы уже в первые сутки разгрузки [6]. Таким образом, повышенный протеолиз титина кальпаином-1 можно назвать одним из молекулярных триггеров мышечной атрофии, индуцируемой гравитационной разгрузкой. Несомненно, что уменьшение содержания или активности этой протеазы будет способствовать снижению протеолиза титина и других саркомерных белков. Наши результаты согласуются с этим утверждением.
Рис. 1.
Содержание кальпаина-1 в m. soleus. 1 – контроль, 2 – вывешивание 7 суток, 3 – вывешивание 7 суток+ингибитор LMK235 (1 мг/кг). *p < 0.05 по сравнению с группой 1. Статистически значимых различий в содержании мРНК кальпаина-1 в m. soleus трех исследуемых групп крыс не выявлено (данные не показаны).

На рис. 2а,б представлены данные об изменении содержания титина в m. soleus вывешенных крыс. Снижение в 1.62 раза (р < 0.01) содержания интактных молекул титина (Т1) и увеличение в 2.1 раза (р < 0.01) содержания протеолитических Т2-фрагментов наблюдалось в атрофированной камбаловидной мышце крыс второй группы (рис. 2а, 2б, в сравнении с контролем). В третьей группе животных мы обнаружили существенное снижение протеолиза Т1. В частности, содержание интактного T1 было выше (в 1.29 раза, р < 0.01), а содержание Т2-фрагментов было ниже (в 1.26 раза, р < 0.01) в m. soleus крыс третьей группы в сравнении с группой 2 (рис. 2а, 2б). Снижение протеолиза титина в третьей группе может быть связано с отсутствием статистически значимого увеличения содержания кальпаина-1 (рис. 1).
Рис. 2.
Содержание титина (а,б) и экспрессия гена титина (в) в m. soleus. На электрофореграмме титина (а) указаны полосы тяжелых цепей миозина (ТЦМ), небулина, протеолитических Т2-фрагментов титина и изоформ Т1. Молекулярные массы мышечных белков указаны в соответствии с данными, полученными в работе [4]. 1 – контроль, 2 – вывешивание 7 суток, 3 – вывешивание 7 суток + ингибитор LMK235 (1 мг/кг). ** p < 0.01 по сравнению с группой 1; ##p < 0.01 по сравнению с группой 2.
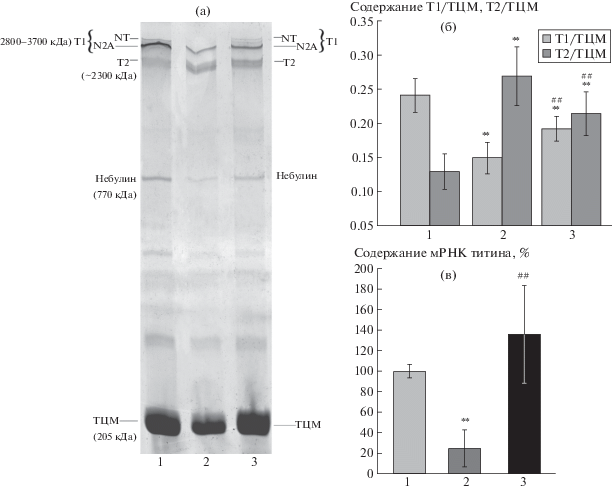
Свой вклад в снижение содержания Т1 в m. soleus крыс второй группы могло внести и значительное уменьшение (в 4.0 раза, р < 0.01) экспрессии гена титина (рис. 2в). В то же время в группе 3 (с ингибированием HDACs4/5) такого снижения не было (рис. 2в).
ВЫВОД
Развитие атрофических изменений в m. soleus крысы после семисуточной гравитационной разгрузки сопровождалось увеличением содержания кальпаина-1, повышением протеолиза титина и снижением экспрессия гена TTN. Ингибирование гистондеацетилаз 4 и 5 на фоне разгрузки не устраняло развитие атрофии, но предотвращало увеличение содержания кальпаина-1, повышенный протеолиз титина и снижение содержания мРНК этого белка.
Учитывая данные о том, что ингибирование HDACs 4/5 предотвращало мышечную атрофию, вызванную 14-суточной гравитационной разгрузкой [8], но не предотвращало атрофию, вызванную 3-суточной [9] и 7-суточной (табл. 1) гравитационной разгрузкой, можно предположить, что эти ферменты вносят меньший вклад в развитие атрофии по сравнению с другими гистондеацетилазами, например, HDAC 1 [11].
Список литературы
Mirzoev T.M., Shenkman B.S. Regulation of Protein Synthesis in Inactivated Skeletal Muscle: Signal Inputs, Protein Kinase Cascades, and Ribosome Biogenesis // Biochemistry (Mosc). 2018. V. 83. № 11. P. 1299–1317. https://doi.org/10.1134/S0006297918110020
Bodine S.C. Disuse-induced muscle wasting // Int. J. Biochem Cell Biol. 2013 V. 45. № 10. P. 2200–2208. https://doi.org/10.1016/j.biocel.2013.06.011
Shenkman B.S., Belova S.P., Lomonosova Yu.N., et al. Calpain-dependent Regulation of the Skeletal Muscle Atrophy Following Unloading // Arch Biochem. Biophys. 2015. V. 584. P. 36–41. https://doi.org/10.1016/j.abb.2015.07.011
Vikhlyantsev I.M., Podlubnaya Z.A. New Titin (Connectin) Isoforms and Their Functional Role in Striated Muscles of Mammals: Facts and Suppositions // Biochemistry (Mosc). 2012. V. 77. № 13. P. 1515–1535. https://doi.org/10.1134/S0006297912130093
Mijailovich S.M., Stojanovic B., Nedic D., et al. Nebulin and Titin Modulate Cross-Bridge Cycling and Length-Dependent Calcium Sensitivity // J. Gen. Physiol. 2019. V. 151. № 5. P. 680–704. https://doi.org/10.1085/jgp.201812165
Enns D.L., Raastad T., Ugelstad I., et al. Calpain/calpastatin Activities and Substrate Depletion Patterns During Hindlimb Unweighting and Reweighting in Skeletal Muscle // Eur. J. Appl. Physiol. 2007. V. 100. № 4. P. 445–455. https://doi.org/10.1007/s00421-007-0445-4
Moresi V., Williams A.H., Meadows E., et al. Myogenin and Class II HDACs Control Neurogenic Muscle Atrophy by Inducing E3 Ubiquitin Ligases // Cell. 2010. V. 143. № 1. P. 35–45. https://doi.org/10.1016/j.cell.2010.09.004
Dupré-Aucouturier S., Castells J., Freyssenet D., et al. Trichostatin A, a Histone Deacetylase Inhibitor, Modulates Unloaded-Induced Skeletal Muscle Atrophy // J. Appl Physiol (1985). 2015. V. 119. № 4. P. 342–351. https://doi.org/10.1152/japplphysiol.01031.2014
Belova S.P., Mochalova E.P., Nemirovskaya T.L. The Role of Class IIa HDACs in the Expression of E3 Ligases ATROGIN-1/MAFbx and MuRF1 under Muscle Unloading // Biochemistry (Moscow), Supplement Series A: Membrane and Cell Biology. 2020. V. 14. № 1. P. 74–80.
Marek L., Hamacher A., Hansen F.K., et al. Histone Deacetylase (HDAC) Inhibitors With a Novel Connecting Unit Linker Region Reveal a Selectivity Profile for HDAC4 and HDAC5 With Improved Activity Against Chemoresistant Cancer Cells // J. Med. Chem. 2013. V. 56. № 2. P. 427–436. https://doi.org/10.1021/jm301254q
Уланова А.Д., Грицына Ю.В. Бобылёв А.Г., и др. Ингибирование гистондеацетилазы-1 предотвращает снижение содержания титина (коннектина) и развитие атрофии в m. soleus крысы после трехсуточной гравитационной разгрузки // Бюллетень экспериментальной биологии и медицины. 2020. Т. 169. № 4. С. 431–438.
Murphy R.M., Snow R.J., Lamb G.D. mu-Calpain and calpain-3 are not autolyzed with exhaustive exercise in humans // Am. J. Physiol. Cell Physiol. 2006. V. 290. № 1. P. C116–C122.
Belova S.P., Shenkman B.S., Kostrominova T.Y., et al. Paradoxical Effect of IKKβ Inhibition on the Expression of E3 Ubiquitin Ligases and Unloading-Induced Skeletal Muscle Atrophy // Physiol. Rep. 2017. V. 5 (16): e13291. https://doi.org/10.14814/phy2.13291
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


