Доклады Российской академии наук. Науки о жизни, 2021, T. 496, № 1, стр. 52-56
ИММОРТАЛИЗАЦИЯ КЕРАТИНОЦИТОВ ЧЕЛОВЕКА С ПОМОЩЬЮ КАТАЛИТИЧЕСКОЙ СУБЪЕДИНИЦЫ ТЕЛОМЕРАЗЫ
А. К. Бейлин 1, 2, Н. Г. Гурская 1, 2, Н. А. Евтушенко 2, Е. В. Алпеева 1, А. В. Косых 1, 2, В. В. Терских 1, член-корреспондент РАН А. В. Васильев 1, 3, член-корреспондент РАН Е. А. Воротеляк 1, 2, 3, *
1 Федеральное государственное бюджетное
учреждение науки Институт биологии развития
имени Н.К. Кольцова Российской академии наук
Москва, Россия
2 Федеральное государственное автономное образовательное учреждение высшего образования “Российский национальный исследовательский медицинский университет имени Н.И. Пирогова” Министерства здравоохранения Российской Федерации
Москва, Россия
3 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: vorotelyak@yandex.ru
Поступила в редакцию 02.09.2020
После доработки 07.09.2020
Принята к публикации 08.09.2020
Аннотация
Путем трансформации первичных кератиноцитов человека с помощью hTERT получена новая стабильная клеточная линия. Клетки обладают видоизмененной морфологией, аномальными хромосомным составом и экспрессией маркеров кератиноцитов, не проявляют контактного торможения и способны к росту на различных культуральных средах, в условиях культивирования обладают ограниченной стратификацией. При трансплантации иммунодефицитным мышам полученная клеточная линия формирует опухоли.
Основными контролерами клеточного старения являются теломеры – участки концов хромосом, которые в первичных соматических клетках постепенно укорачиваются с каждым раундом деления. В половых и некоторых соматических стволовых клетках активен рибонуклеиновый комплекс – теломераза, каталитическая субъединица которого (hTERT) синтезирует теломерные повторы и проявляет свои функции, будучи гетерологически экспрессирована в клетках разных типов [1]. Однако эктопической экспрессии одной hTERT не достаточно для иммортализации кератиноцитов, которые требуют активации циклин-зависимых киназ для прохождения контрольных точек в митотическом цикле [2, 3]. В связи с этим исследователям доступно всего несколько линий спонтанно иммортализовавшихся кератиноцитов: NM1, HaCaT, NIKS [4, 5]. Ранее было показано, что экспрессия в первичных кератиноцитах кДНК hTERT может привести к получению стабильных линий клеток [4], по-видимому, за счет дополнительной спонтанной трансформации.
В данной работе мы провели трансформацию первичных кератиноцитов человека с помощью hTERT, в результате чего была получена стабильная клеточная линия. Целью последующей работы стало изучение свойств полученных клеток.
Выделение и культивирование первичных кератиноцитов были описаны ранее [6]. Иммортализация производилась с помощью трансдукции лентивирусным вектором, несущим кДНК hTERT. Отбор иммортализованных клеток осуществлялся с помощью селекции по устойчивости к пуромицину.
Был произведен цитогенетический анализ клеток методом G-дифференциального окрашивания.
Активность теломеразы была оценена с помощью кита TRAPEZE (S7710) в соответствии с указаниями производителя.
Фазово-контрастную микроскопию клеточных культур осуществляли на микроскопе EVOS FL AUTO.
Трансплантация клеток в семенники иммунодефицитных мышей осуществлялась по стандартному протоколу в условиях SPF-вивария [7].
Создание кожных эквивалентов и изготовление криосрезов осуществляли по ранее описанной методике [6]. В одной из групп вместо культуральной среды CnT-Prime Airlift (Ztn-Bio, США) использовали DMEM/F12 с 10% сыворотки и добавлением ITS (Insulin-Transferrin-Selenium, добавка инсулин-трансферрин-селен) и EGF (Epidermal Growth Factor, рекомбинантный эпидермальный фактор роста человека) (Gibco, США).
Иммунофлуоресцентное окрашивание клеточных культур и криосрезов осуществлялось по методике, описанной ранее [8].
Конфокальную съемку производили на лазерном сканирующем конфокальном микроскопе LSM 880 на базе Axio Observer.Z1.
Культура первичных кератиноцитов перед процедурой иммортализации имела типичную для кератиноцитов морфологию “булыжной мостовой” (рис. 1а). После лентивирусной трансдукции и селективного отбора в среде с антибиотиком в культуре появилась популяция клеток с измененной морфологией, они были меньше в диаметре, имели округлую форму и формировали небольшое число крупных отростков (рис. 1б). После образования монослоя клетки демонстрировали отсутствие контактного торможения. После нескольких пассажей данные клетки полностью вытеснили другие кератиноциты, образовав морфологически гомогенную популяцию, сохранявшуюся на протяжении более 20 пассажей. В среде DMEM/F12 с сывороткой, содержащей более высокую концентрацию ионов кальция, чем среда CnT-07, используемая на первых этапах работы, произошло изменение морфологии и особенностей роста: клетки стали более распластанными, при этом, несмотря на продолжающийся рост, не образовывали монослоя, оставляя промежутки между островками клеток, соединенными перешейками, а также обладали пониженной адгезией к пластику (рис. 1в).
Рис. 1.
Фазово-контрастная микроскопия. Увеличение ×200. (а) культура первичных кератиноцитов; (б) появление трансформированных кератиноцитов после процедуры иммортализации, среда CnT-07; (в) трансформированные кератиноциты, среда DMEM/F12 с 10% сыворотки.

В результате цитогенетического исследования в 100% клеток выявлен гипердиплоидный набор хромосом (модальное число хромосом 55–69) с множественными хромосомными аномалиями: дупликацией участков р31-р32, р12-р36, q25-q44 1-й хромосомы, делеции участков q23-qter длинного плеча 3-й хромосомы и q31-qter длинного плеча 7-й хромосомы, дополнительные материалы неизвестного происхождения на р-плече 4-й хромосомы и на q-плече 13-й хромосомы, от 4 до 8 маркерных хромосом. Также, как и у других иммортализованных линий кератиноцитов, таких как NM1 и NIKs, у данной клеточной линии наблюдается трисомия 8 хромосомы (у HaCaT тетрасомия), увеличение числа генов которой предположительно ответственно за спонтанную иммортализацию кератиноцитов [5].
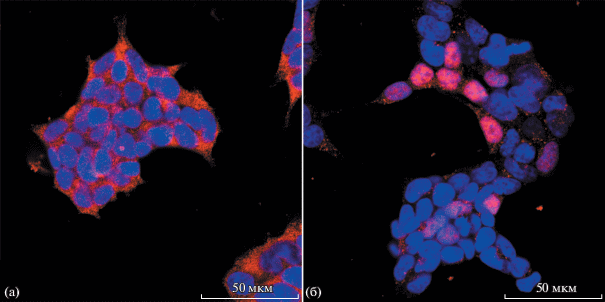
В результате иммунофлуоресцентного окрашивания культуры клеток была выявлена экспрессия маркера базальных кератиноцитов – кератина 14 (K14) (рис. 2а), причем в паттерне экспрессии К14 практически отсутствует сеть филаментов. Также клетки показывают отрицательную окраску по кератину 5. Ранее сообщалось, что экспрессия этих кератинов является маркером онкотрансформации и оба кератина являются активными участниками сохранения способности к активной пролиферации [9], поэтому пути, способствующие трансформации полученных нами клеток, еще предстоит выяснить в последующих работах. Клетки также имеют негативное окрашивание по кератину 10 (K10) и транскрипционному фактору p63, а часть ядер клеток положительно окрашивается на теломеразу (рис. 2б).
Рис. 2.
Культура трансформированных кератиноцитов. Иммунофлуоресцентное окрашивание. Конфокальная микроскопия. Синий – ДНК (DAPI). Красный – кератин 14 (а), теломераза (б).
При трансплантации в мышей линии Nude Crl:NU(NCr)-Foxn1nu (Charles River, Германия) данные клетки образовывают опухоли, в которых обнаруживаются клетки, экспрессирующие теломеразу (рис. 3г). Среди них есть клетки, экспрессирующие К14 и K10, выявляется также маркер поздней стратификации эпидермиса – лорикрин (рис. 3а, 3б, 3в). Также наблюдаются большие тканевые образования без выраженных ядерных структур, но положительные при окраске антителами против материала ядер человека, что может быть следствием терминальной дифференцировки клеток в опухоли. Такая особенность в стратификации отмечалась исследователями ранее для спонтанно иммортализованной линии клеток кератиноцитов – HaCaT в условиях трансплантации иммунодефицитным мышам [10].
Рис. 3.
Срез семенника мыши после трансплантации в него трансформированных кератиноцитов. Конфокальная микроскопия. Синий – ДНК (DAPI). Зеленый – человеческие ядра. Красный – кератин 14 (а), кератин 10 (б), лорикрин (в), теломераза (г). Белые стрелки указывают на клетки с тройным окрашиванием.

При создании кожных эквивалентов иммортализованные нами кератиноциты ведут себя схожим образом вне зависимости от используемой среды. Они образуют пласт, состоящий из 15–30 слоев клеток. Все клетки в пласте экспрессируют К14, а клетки в верхних слоях и отдельные клетки в толще экспрессируют К10 подобно клеткам HaCaT (рис. 4б, 4д). При этом наблюдается нормальная экспрессия коллагена 7 в районе базального слоя (рис. 4в, 4е).
Рис. 4.
Срезы кожных эквивалентов, полученных из трансформированных кератиноцитов и первичных дермальных фибробластов человека. Конфокальная микроскопия. а, б, в – среда DMEM/F12 для стратификации. г, д, е – среда CnT-Prime Airlift. Синий – ДНК (DAPI). Зеленый – кератин 14 (а, г), кератин 10 (б, д), коллаген 7 (в, е).

Мы показали с помощью метода TRAPEZE telomerase detection kit (Millipore), что уровень активности теломеразы в полученной нами новой линии клеток сохраняется на протяжении почти 20 пассажей и выше, чем в HaCaT и HeLa (рис. 5), и что вкупе с другими изменениями говорит о глубокой трансформации метаболизма клеток.
Рис. 5.
Результаты теста TRAPeze. hKC hTERT – иммортализованные кератиноциты человека. В отрицательном контроле (первичные кератиноциты) активность теломеразы ниже порога чувствительности теста. По оси ординат – активность теломеразы (амоль/мг белка/мин).

Можно предположить, что поскольку сверхэкспрессии теломеразы недостаточно для иммортализации кератиноцитов, в данной линии клеток произошли геномные перестройки и были сформированы дополнительные эпигенетические изменения, позволившие, независимо от теломеразы, перейти клеткам этой культуры к другому состоянию, приведшему к иммортализации.
Данная клеточная линия может стать ценным инструментом во многих исследованиях, связанных с изучением механизмов межклеточных взаимодействий, опухолеобразования и клеточной дифференцировки.
Список литературы
Kim N.W. et al. Specific association of human telomerase activity with immortal cells and cancer // Science. American Association for the Advancement of Science, 1994. V. 266, № 5193. P. 2011–2015.
Dickson M.A. et al. Human Keratinocytes That Express hTERT and Also Bypass a p16INK4a-Enforced Mechanism That Limits Life Span Become Immortal yet Retain Normal Growth and Differentiation Characteristics // Mol Cell Biol. 2000. V. 20. № 4. P. 1436–1447.
Kiyono T. et al. Both Rb/p16 INK4a inactivation and telomerase activity are required to immortalize human epithelial cells: 6706 // Nature. Nature Publishing Group, 1998. V. 396. № 6706. P. 84–88.
Smits J.P.H. et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models: 1 // Scientific Reports. Nature Publishing Group, 2017. V. 7. № 1. P. 11838.
Allen-Hoffmann B.L. et al. Normal Growth and Differentiation in a Spontaneously Immortalized Near-Diploid Human Keratinocyte Cell Line, NIKS // Journal of Investigative Dermatology. 2000. V. 114. № 3. P. 444–455.
Beilin A.K. et al. The Reconstructed Human Epidermis in vitro – a Model for Basic and Applied Research of Human Skin: 2 // Vestnik dermatologii i venerologii. 2020. V. 96, № 2. P. 24–34.
Miyawaki S. et al. Teratoma Formation Assay for Assessing Pluripotency and Tumorigenicity of Pluripotent Stem Cells // Bio-protocol. 2017. V. 7. № 16. P. e2518–e2518.
Kosykh A. et al. Postnatal neural crest stem cells from hair follicle interact with nerve tissue in vitro and in vivo // Tissue and Cell. 2018. V. 54. P. 94–104.
Srivastava S.S. et al. Keratin 5/14-mediated cell differentiation and transformation are regulated by TAp63 and Notch-1 in oral squamous cell carcinoma‑derived cells // Oncology reports. Spandidos Publications, 2018. V. 39. № 5. P. 2393–2401.
Breitkreutz D. et al. Epidermal differentiation and basement membrane formation by HaCaT cells in surface transplants // Eur. J. Cell Biol. 1998. V. 75. № 3. P. 273–286.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


