Доклады Российской академии наук. Науки о жизни, 2021, T. 496, № 1, стр. 104-108
РЕКОМБИНАНТНАЯ ЛЮЦИФЕРАЗА ГРИБА Neonothopanus nambi: ПОЛУЧЕНИЕ И СВОЙСТВА
А. Ю. Гороховатский 1, Т. В. Чепурных 1, А. С. Щеглов 1, Ю. А. Мокрушина 1, М. Н. Баранова 1, С. А. Гончарук 1, К. В. Пуртов 2, *, В. Н. Петушков 2, Н. С. Родионова 2, И. В. Ямпольский 1
1 Институт биоорганической химии им. академиков
М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
2 Институт биофизики Федерального исследовательского центра “Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
* E-mail: purtovk@mail.ru
Поступила в редакцию 15.10.2020
После доработки 27.10.2020
Принята к публикации 29.10.2020
Аннотация
Ключевым компонентом недавно описанной биолюминесцентной системы высших грибов является люцифераза, относящаяся к новому классу белков. Свойства грибной люциферазы и их взаимосвязь с ее строением интересны как для улучшения уже созданных на ее основе автолюминесцентных систем, так и для создания новых. Поэтому крайне важным является понимание пространственной структуры этого белка. Нами выполнены гетерологическая экспрессия и очистка люциферазы Neonothopanus nambi, получен белок, пригодный для последующей кристаллизации, а также определены некоторые биохимические свойства рекомбинантной люциферазы.
Биолюминесцентные системы широко применяются как в исследовательских целях, так и для разработки лекарств и диагностики [1–6]. Недавно расшифрованная биолюминесцентная система грибов является перспективным инструментом для биомедицинских исследований [7]. На ее основе уже созданы автономно люминесцирующие дрожжи [8] и растения [9]. Однако ключевой компонент этой системы – люцифераза (nnLuz) – остается малоизученной. Отсутствие гомологии с другими ферментами не позволяет смоделировать пространственную структуру этого белка, а сложность выделения из природного источника препятствует получению достаточного количества белка для кристаллизации и характеризации его свойств. Таким образом, получение рекомбинантной люциферазы N. nambi сегодня является актуальной задачей.
На первом этапе работы мы сравнили активность люциферазы N. nambi при экспрессии в трех стандартных системах: кишечной палочке E. coli, дрожжах Pichia pastoris и линии клеток человека HEK293T. Максимальную люминесценцию в ответ на добавление люциферина грибов продемонстрировали дрожжи P. pastoris. Поэтому для дальнейших экспериментов было решено использовать штамм дрожжей, продуцирующий люциферазу с последовательностью из 6 остатков гистидина на С-конце белка. Культивацию дрожжей проводили по стандартной методике, используя штамм GS115 [10].
Биомассу дрожжей лизировали в 100 мМ Na-фосфатном буфере, pH 7.0, содержащем 100 мМ NaCl, 5 мМ EDTA, 10 мМ 2-меркаптоэтанол и 1 мМ PMSF, при помощи гомогенизатора высокого давления (600 бар, IKA HPH). Лизат центрифугировали (8000 g × 30 мин) при 4°С, мембранную фракцию, содержащую люциферазу, осаждали ультрацентрифугированием (150 000 g × 90 мин) при 4°С. Для подбора условий солюбилизации люциферазы мембраны суспензировали в 50 мМ HEPES-Na буфере, pH 8.0, содержащем 500 мМ NaCl, 20% глицерин (буфер А) и различные детергенты, при 4°С в течение ночи (рис. 1). Почти все рассмотренные детергенты показали приблизительно одинаковую способность экстрагировать люциферазу, кроме детергента OG (октил-гликозида). Для препаративной экстракции был использован именно DDM в концентрации 10 мМ, ввиду его доступности и хорошей применимости для хроматографии с УФ-детекцией. Все хроматографии проводили на холоду. Детергент-солюбилизированную фракцию мембран наносили на колонку с сорбентом TALON для металл-аффинной хроматографии, уравновешенную буфером А с 0.02% DDM, и промывали колонку этим же буфером. Далее колонку промывали 20 мМ MES-Na, 0.5 М NaCl, 10% глицерин буфером, pH 6.2 (буфер B), содержащим 0.02% DDM. Сорбированную люциферазу элюировали буфером B, содержащим 0.1% DDM и 200 мМ имидазол. Фракции с наибольшей люминесцентной активностью наносили на колонку с Sephacryl S-300 в 50 мМ Na-фосфатном буфере, pH 7.0, содержащем 150 мМ NaCl и 0.04% DDM, для гель-фильтрации. В результате была получена рекомбинантная люцифераза N. nambi с чистотой более 95% (рис. 2) и с выходом 10 мг с литра культуры P. pastoris.
Рис. 1.
Солюбилизация люциферазы nnLuz из мембран P. pastoris, суспендированных в буфере (см. текст) с добавками различных детергентов в концентрации 10 мМ (100 мМ для OG) в течение 16 ч при 4°C. После центрифугирования (150 000 g × 90 мин) при 4°С биолюминесцентную активность люциферазы в супернатанте измеряли в 200 мМ Na-фосфатном буфере, pH 8.0, содержащем 500 мМ Na2SO4, 0.1% DDM и 50 мкМ люциферина грибов. Представлены средние значения ± стандартное отклонение.

Рис. 2.
Электрофорез в денатурирующих условиях фракций в ходе выделения рекомбинантной люциферазы N. nambi. 1 – маркеры молекулярной массы; 2 – мембранная фракция клеток P. pastoris; 3 – фракция, содержащая рекомбинантную люциферазу N. nambi, после металл-хелатной хроматографии; 4 – фракция, содержащая рекомбинантную люциферазу N. nambi, после гель-фильтрационной хроматографии. Гель окрашен Кумасси G250.

При гель-фильтрации на колонке Superdex200 в присутствии мицелл детергента DDM люцифераза элюируется одним пиком, соответствующим молекулярной массе около 60 кДа. C одной стороны, люцифераза может представлять собой димер, так как расчетная масса мономера, определенная по аминокислотной последовательности, 31.4 кДа. Однако с учетом размеров мицеллы DDM (40–70 кДа) и условий гель-фильтрации, люцифераза более вероятно является мономером, связанным с детергентом, хотя точная стехиометрия такого комплекса остается неизвестной.
Полученный после гель-фильтрации препарат люциферазы был исследован методом спектроскопии кругового дихроизма. Спектр получен в 20 mM Na-фосфатном буфере, содержащем 100 mM NaCl, 0.04% DDM, pH 7.4, 5°C на спектрополяриметре J-810 (JASCO, Япония) при концентрации белка 11 мкМ в кювете толщиной 0.01 см. Для обсчета данных использованы программа CONTINLL (пакет CDPro), набор референсных спектров: SMP56. Результат анализа полученного спектра представлен в табл. 1. Наличие представленных в таблице бета-структур и альфа-спиральных участков говорит о высокой вероятности наличия белка с нативной структурой в очищенном препарате люциферазы.
Таблица 1.
Анализ полученного спектра кругового дихроизма
| Число а.о. | Альфа-спираль, % | Бета-структура, % | Поворот, % | Неупоряд., % | NRMSD |
|---|---|---|---|---|---|
| 275 | 21.5 | 26.8 | 22.5 | 29.1 | 0.05 |
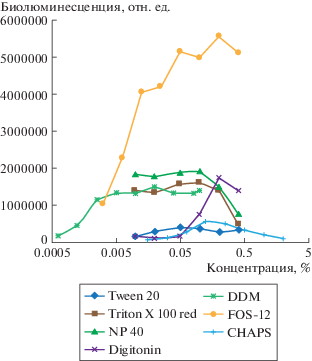
Активность люциферазы in vitro радикально зависит от наличия детергентов в среде (рис. 3). Мы провели сравнение биолюминесцентной активности рекомбинантной nnLuz в присутствии Tween-20, Triton X-100, NP-40, дигитонина, DDM, FOS-12 и CHAPS. Различные детергенты в разной степени способствуют люминесцентной реакции. Наибольшая активность люциферазы наблюдалась в присутствии FOS-12 (n-Dodecylphosphocholine). Однако нами было показано, что при хранении в присутствии детергента FOS-12 очищенная nnLuz теряет активность, при хранении в присутствии DDM потери активности люциферазы не наблюдалось. Поэтому очистку и измерение ее активности производили также в DDM, чтобы избежать образования смешанных мицелл при измерении.
Рис. 3.
Влияние детергентов на биолюминесценцию люциферазы. Реакцию проводили в 200 mM Na-фосфатном буфере pH 8.0, содержащем указанную концентрацию детергента и 50 мкМ люциферина грибов. Измерения проводили в течение 30 сек. Представлены интегрированные значения интенсивности света.
Оптимальный рН для биолюминесцентной реакции составляет 8.0 (рис. 4а). Рекомбинантная люцифераза является термочувствительным ферментом, инкубация в течение 10 мин при температуре 30°C практически полностью инактивирует фермент (рис. 4б).
Рис. 4.
pH-зависимость (а) и термостабильность (б) биолюминесценции люциферазы N. nambi. Измерение люминесценции проводили после инкубации в течение 10 мин при указанной температуре в 100 мМ Na-фосфатном буфере pH 7.0. Реакцию проводили в 100 mM буфере указанного pH, содержащем 0.1% DDM и 50 мкМ люциферина грибов при комнатной температуре. Свет интегрировали в течение 60 с. Представлены средние значения ± стандартное отклонение.

Была определена константа Михаэлиса-Ментен для реакции окисления люциферина, катализируемой рекомбинантной люциферазой N. nambi. Реакцию проводили при концентрации люциферазы 50 нМ в 200 мМ Na-фосфатном буфере, pH 8.0, содержащем 500 мМ Na2SO4, 0.1% DDM при комнатной температуре, концентрацию люциферина грибов варьировали от 2 нМ до 50 мкМ. Значения начальной интенсивности биолюминесценции аппроксимировали функцией Михаэлиса-Ментен при помощи программного пакета Origin. Km составила 1.09 ± 0.06 мкМ.
Таким образом, в результате проделанной работы получена и охарактеризована рекомбинантная люцифераза N. nambi. Разработанная методика выделения этого фермента будет далее использована для наработки достаточных количеств белка для кристаллизации и исследования пространственной структуры люциферазы методом ЯМР.
Список литературы
Yan Y., Shi P., Song W., Bi S. Chemiluminescence and Bioluminescence Imaging for Biosensing and Therapy: in vitro and in vivo Perspectives. // Theranostics. 2019. V. 9. P. 4047–4065. https://doi.org/10.7150/thno.33228
Fleiss A., Sarkisyan K.S. A brief review of bioluminescent systems. // Current Genetics. 2019. V. 65. P. 877–882. https://doi.org/10.1007/s00294-019-00951-5
Pomper M.G., Gelovani J.G. Molecular Imaging in Oncology. // CRC Press. 2008. 744 p. https://doi.org/10.1102/1470-7330.2004.0060
Shimomura O. Bioluminescence: Chemical Principles and Methods. // World Scientific Publishing, Singapore. 2006. 470 p. https://doi.org/10.1142/6102
van Leeuwen F.W., Hardwick J.C., van Erkel A.R. Luminescence-based Imaging Approaches in the Field of Interventional Molecular Imaging. // Radiology. 2015. V. 276 (1). P. 12–29. https://doi.org/10.1148/radiol.2015132698
England C.G., Ehlerding E.B., Cai W. NanoLuc: A Small Luciferase Is Brightening Up the Field of Bioluminescence. // Bioconjugate Chemistry. 2016. V. 27 (5). P. 1175–1187. https://doi.org/10.1021/acs.bioconjchem.6b00112
Ямпольский И.В., Осипова З.М., Щеглов А.С. Новая биолюминесцентная система грибов: перспективы использования в медицинских исследованиях. // Вестник РГМУ. 2018. V. 1. P. 80–83. https://doi.org/10.24075/vrgmu.2018.004
Kotlobay A.A., Sarkisyan K.S., Mokrushina Y.A., et al. Genetically encodable bioluminescent system from fungi. // Proceedings of the National Academy of Sciences of the United States of America U S A. 2018. V. 115. P.12728–12732. https://doi.org/10.1073/pnas.1803615115
Mitiouchkina T., Mishin A.S., Somermeyer L.G., et al. Plants with genetically encoded autoluminescence. // Nature Biotechnology. 2020. https://doi.org/10.1038/s41587-020-0500-9
Pichia expression kit. A manual of methods for expression of recombinant proteins using pPICZ and PICZ-alpha in Pichia pastoris. // Invitrogen ES. Catalog. 2009.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


