Доклады Российской академии наук. Науки о жизни, 2021, T. 496, № 1, стр. 80-84
ИНГИБИТОР GSK3 КИНАЗЫ CHIR ПОДАВЛЯЕТ ТРАНСКРИПЦИЮ ТКАНЕСПЕЦИФИЧЕСКИХ ИЗОФОРМ POU2F1 В КЛЕТКАХ ЛИМФОМЫ БЕРКИТТА Namalwa
Е. В. Панкратова 1, *, Т. Н. Порцева 1, А. А. Макарова 1, академик РАН Ю. В. Ильин 1, А. Г. Степченко 1, член-корреспондент РАН С. Г. Георгиева 1
1 Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии
им. В.А. Энгельгардта Российской академии наук
(ИМБ РАН)
Москва, Россия
* E-mail: panliz@mail.ru
Поступила в редакцию 23.09.2020
После доработки 15.10.2020
Принята к публикации 16.10.2020
Аннотация
POU2F1(Oct-1) транскрипционный фактор, оверэкспрессия которого обнаружена во многих злокачественных опухолях человека, значительное повышение его уровня в клетках определяет злокачественный потенциал опухоли. POU2F1 представлен несколькими изоформами, транскрибирующимися с альтернативных промоторов. В В-клеточной лимфоме Беркитта Namalwa концентрация тканеспецифичной изоформы Oct-1L в несколько раз выше, чем в нормальных В-клетках. Мы проверили потенциальную возможность ингибировать транскрипцию отдельных изоформ Oct-1, используя ингибитор GSK3 киназы – CHIR – производное аминопиримидина. Нами было показано, что CHIR специфически влияет на экспрессию тканеспецифической изоформы Oct-1L, значительно снижая уровень мРНК и белка Oct-1L, при этом CHIR не вызывает изменения количества мРНК и белка убиквитарной изоформы Oct-1A в опухолевых клетках Namalwa. Полученные результаты показывают, что возможно разработать систему избирательного ингибирования изоформ фактора транскрипции Oct-1 в клетках человека для подавления лекарственной устойчивости опухолевых клеток с высоким содержанием POU2F1.
Белок POU2F1 (Oct-1) принадлежит к POU-семейству транскрипционных факторов [1, 2]. Oct-1 экспрессируется во всех клетках человека и контролирует эмбриональное развитие, дифференцировку, клеточный ответ на стресс [3, 4]. Способность Oct-1 регулировать широкий спектр функционально различных генов и процессов основан на его способности взаимодействовать с различными сайтами ДНК [5] и подвергаться множественным посттрансляционным модификациям. Изоформы Oct-1, различающиеся по последовательности N-концевого домена, транскрибируются с альтернативных промоторов и регулируют большое количество генов-мишеней, как индивидуальных для каждой изоформы, так и общих для всех изоформ Oct-1 [4, 6–8].
Высокий уровень POU2F1(Oct-1) обеспечивает стрессоустойчивость клетки при окислительном и цитотоксическом стрессах, а также при радиационном облучении, а степень его участия в этих процессах зависит от его концентрации в клетке [3, 9]. POU2F1(Oct-1) является проонкогенным фактором и имеет прогностическое значение в развитии и лечении широкого спектра злокачественных опухолей. Высокий уровень экспрессии POU2F1(Oct-1) в опухоли связан с плохим диагностическим прогнозом. Таким образом, Oct-1 значимый транскрипционный фактор, определяющий злокачественный потенциал опухоли [9, 10].
В большом количестве типов опухолей отмечается повышенная экспрессия Oct-1, однако довольно высокий уровень его экспрессии присутствует и во многих типах нераковых клеток и тканей. Это осложняет применение противоопухолевой терапии, основанной на полном или частичном подавлении Oct-1, без учета конкретной изоформы, которая подавляется.
Изоформы Oct-1экспрессируются в нормальных клетках в некоторых относительно стабильных, для конкретных типов клеток, соотношениях [4, 7, 8]. Нарушение уровня экспрессии отдельных изоформ Oct-1 отмечается во многих типах тканей опухолевой природы и связано с нарушением регуляции альтернативных промоторов гена POU2F1(Oct-1) в опухолевых клетках. Так, например, в В-клеточной лимфоме Беркитта Namalwa концентрация тканеспецифичной изоформы Oct-1L в несколько раз выше, чем в нормальных В-клетках [4, 8].
Существование альтернативных промоторов в гене POU2F1(Oct-1) делает перспективной возможность влиять не только на экспрессию тотального Oct-1, но также на экспрессию отдельных его изоформ, уровень которых возрастает в опухолевых клетках.
В данной работе мы исследовали возможность избирательно влиять на экспрессию изоформ Oct-1А и Oct-1L, транскрибирующихся с альтернативных промоторов. Анализ распределения сайтов связывания в областях двух альтернативных промоторов гена POU2F1(Oct-1) показал, что транскрипция этого гена может находиться под контролем белков-мишеней для GSK3 (гликогенсинтаза киназы-3) – TCF/LEF и FOXO. В обоих промоторах присутствуют сайты связывания для транскрипционных факторов семейства TCF/LEF, через которые В-катенин заякоривается на промоторах генов-мишеней Wnt-сигнального пути, а также в промоторе L присутствуют сайты связывания для FOXO. Основываясь на анализе распределения сайтов связывания, мы предположили, что вещества, способные влиять на активность GSK3, могут избирательно влиять на активность этих промоторов.
Для фактора транскрипции POU2F1 и GSK3 показано их участие в канцерогенезе. Однако связь GSK3 и гена POU2F1 в регуляции канцерогенеза не изучена. Функции GSK3 в развитии опухоли неоднозначны. GSK3 может быть как супрессором опухолей, так и активатором опухолевого роста, в зависимости от типа опухоли. Высокий уровень GSK3 в клетке ингибирует опухолевый рост при опухолях молочной железы и при меланоме, но усиливает рост опухоли поджелудочной железы и при лейкемии.
Плейотропный эффект GSK3 связан с ее центральной ролью в разных сигнальных путях: Notch, Wnt, Hedgehog, NF-kB [11].
Мы проверили потенциальную возможность ингибировать отдельные изоформы Oct-1, используя ингибитор GSK3– CHIR – производное аминопиримидина, обладающее высоким сродством к GSK3α основной киназе и инактивирующее ее. CHIR является активатором Wnt-сигнального пути, а одной из наиболее изученных мишеней GSK3 является В-катенин – ключевой компонент Wnt-сигнального пути. Инактивация В-катенина осуществляется активной киназой GSK3, которая фосфорилирует B-катенин, после чего он попадает в протеосомы и деградирует. Активный нефосфорилированный B-катенин взаимодействует с транскрипционными факторами семейства TCF/LEF и активирует транскрипцию генов Wnt-сигнального пути, но также В-катенин может участвовать в альтернативных путях регуляции транскрипции [12, 13].
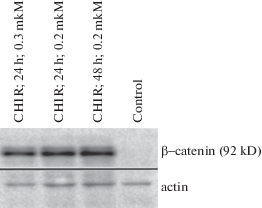
Поскольку белок В-катенин является одним из самых изученных субстратов для GSK3, сначала мы исследовали влияние CHIR на экспрессию этого белка в клетках линии Namalwa. Нами были использованы первичные антитела, способные связывать только нефосфорилированный (транскрипционно активный) свободный В-катенин.
В данном эксперименте мы показали, что CHIR значительно увеличивает концентрацию свободного B-катенина в цитоплазме клеток лимфомы Беркитта Namalwa. Таким образом, было установлено, что CHIR, подходит для дальнейшей работы c линией клеток Namalwa. Помимо представленных на рис. 1, нами были опробованы различные концентрации CHIR: 0.6, 0.4, 0.1 и 0.05 мкМ. Минимальная концентрация СHIR достаточная для визуально определимого повышения уровня В-катенина в клетках Namalw, составила 0.05 мкМ.
Рис. 1.
Изменение количества B-катенина в клетках Namalwa при обработке CHIR. Вестерн-блот гибридизация с антителами к нефосфорилированному В-катенину. На дорожку нанесено по 10 мкг тотального клеточного белка.
CHIR подавляет транскрипцию с тканеспецифического промотора гена POU2F1.
На следующем этапе нами было изучено влияние CHIR на транскрипцию с двух альтернативных промоторов гена POU2F1 методом обратной транскрипции и ПЦР в реальном времени. Для ПЦР были использованы праймеры: Oct-1A A-Forw 5'-tattcaaaatggcggacgga-3'; Oct-1L L-Forw 5'-ccaccccaaactgctacctgt-3'; реверсный праймер для всех изоформ Rev-A,L 5'-ctgacggattgttcattcttgagt-3'. Нами было показано, что при культивировании клеток Namalwa в течение 24 ч в среде, содержащей CHIR, количество мРНК изоформы Oct-1L, транскрибирующейся с альтернативного тканеспецифического промотора L, снижается примерно в 1.8 раза, тогда как количество мРНК убиквитарной изоформы Oct-1A не изменяется (рис. 2). Уровень снижения количества мРНК Oct-1L зависит от концентрации CHIR.
Рис. 2.
Влияние CHIR на транскрипцию с альтернативных промоторов U и L гена POU2F1(Oct–1). Количественный ПЦР.

Из представленных результатов видно, что CHIR подавляет транскрипцию с промотора L (с которого транскрибируется тканеспецифическая изоформа Oct-1L), но не влияет на транскрипцию промотора U (с которого транскрибируются убиквитарная изоформа Oct-1A).
CHIR вызывает снижение количества белка Oct-1L в клетках линии Namalwa.
Одновременно мы анализировали изменение количества белка изоформ Oct-1L и Oct-1A методом Вестерн-блот гибридизации с антителами, специфичными к изоформе Oct-1L или к изоформе Oct-1A [4]. Из результатов эксперимента следует, что под действием CHIR значительно уменьшается количество изоформы Oct-1L, тогда как количество изоформы Oct-1A не изменяется (рис. 3).
Рис. 3.
Влияние CHIR на экспрессию изоформ Oct-A и Oct-L в клетках Namalwa. Вестерн-блот гибридизация с антителами к изоформе Oct-1A или Oct-1L. На дорожку нанесено по 15 мкг тотального клеточного белка.

Таким образом, CHIR специфически влияет на экспрессию тканеспецифической изоформы Oct-1L, значительно снижая уровень мРНК и белка Oct-1L, при этом CHIR не вызывает изменения количества мРНК и белка Oct-1A. Анализ сайтов связывания показал, что в регуляторной области промотора L присутствует несколько потенциальных сайтов связывания для белков-мишеней GSK3 – транскрипционных факторов семейств TCF и FOXO, а в промоторе U обнаружен участок связывания для TCF7L2.
CHIR считается активатором Wnt сигнального пути, так как высокоспецифично связывает GSK3, инактивируя ее, тем самым предотвращая фосфорилирование В-катенина этой киназой и его дальнейшую деградацию. Известно, что комплекс TCL-В-катенин на промоторе генов-мишеней вызывает активацию транскрипции. В обоих промоторах гена POU2F1 есть сайты связывания для TCL, но под действием CHIR наблюдается репрессия транскрипции с тканеспецифичного промотора, но одновременно не изменяется транскрипция с убиквитарного промотора. Это дает возможность предположить, что GSK3 изменяет транскрипцию с альтернативных промоторов гена POU2F1 не через Wnt-сигнальный путь. Для подтверждения этого предположения мы использовали высокоспецифичный ингибитор Wnt-сигнального пути – пирвиниум. Обработка клеток Namalwa в течение 24 или 48 ч пирвиниумом в концентрации 2.2 мкМ не привела к изменению уровня транскрипции с альтернативных промоторов гена POU2F1, этот факт является подтверждением нашего предположения, что ингибитор GSK3 подавляет транскрипцию с тканеспецифичесого промотора гена POU2F1 не через Wnt-сигнальный путь.
Мы предполагаем, что мишенью GSK3 является FOXO, сайты связывания для которого обнаружены нами в тканеспецифичном промоторе L. Из литературных данных известно, что у человека GSK3 позитивно регулирует активность FOXO1 и стимулирует экспрессию IGF-IR [14], также показано, что у Drosophila melanogaster GSK3 напрямую активирует dFOXO.
Фосфорилирование белков GSK3 киназой может как позитивно, так и негативно влиять на функции белка-мишени. Фосфорилирование белков MafA, SRC-3, BCL-3 индуцирует или активацию или деградацию и изменяет их активность [9, 14, 15].
Нами было показано влияние CHIR – ингибитора GSK3 – на снижение количества мРНК и белка изоформы Oct-1L в опухолевых клетках Namalwa, и мы предполагаем, что это влияние осуществляется через FOXO. Ранее нами было показано, что в клетках лимфомы Бэркитта Namalwa уровень экспрессии этой изоформы повышен в несколько раз по сравнению с нормальными В-клетками. Полученные результаты демонстрируют, что возможно разработать систему избирательного ингибирования изоформ фактора транскрипции Oct-1 в клетках человека для подавления лекарственной устойчивости опухолевых клеток с высоким содержанием Oct-1.
Список литературы
Herr W.S.R. The POU domain: a large conserved region in the mammalianpit-1, oct-1, oct-2, and Caenorhabditis elegansunc-86 gene products. // Genes Dev., 1988. V. 2(12A), P. 1513–1516. https://doi.org/10.1101/gad.2.12a.1513
Stepchenko A.G. The nucleotide sequence of mouse OCT-1 cDNA. // Nucl. Acids Res. 1992. V. 20. № 6. P. 1419.
Maddox J., Shakya A., South S., et al. Transcription Factor Oct1 Is a Somatic and Cancer Stem Cell Determinant. // PLoS Genet., 2012. V. 8 (12), e1003048. https://doi.org/10.1371/journal.pgen.1003048
Pankratova E.V., Stepchenko A.G., Portseva T., Mogila V.A., Georgieva S.G. Different N-terminal isoforms of Oct-1 control expression of distinct sets of genes and their high levels in Namalwa Burkitt’s lymphoma cells affect a wide range of cellular processes. // Nucleic Acids Res, 2016. V. 44(19), P. 9218–9230. https://doi.org/10.1093/nar/gkw623
Stepchenko A.G., Luchina N.N., PankratovaE.V. Cysteine 50 of the POU H domain determines the range of targets recognized by POU proteins. // Nucl. Acids Res. 1997. V. 25 39. P. 2847–2853, 5401–5411.
Pankratova E.V., Deyev I.E., Zhenilo S.V., Polanovsky O.L. Tissue-specific isoforms of the ubiquitous transcription factor Oct-1 (2001) Mol. Genet. Genom. V. 266. № 2. P. 239–245.
Luchina N.N., Krivega I.V., PankratovaE.V. Human Oct-1L isoform has tissue-specific expression pattern similar to Oct-2. // Immunol. Lett. 2003. V. 85. P. 237–241.
Pankratova E.V., Stepchenko A.G., Krylova I.D., Portseva TN, Georgieva SG. The regulatory interplay between Oct-1 isoforms contributes to hematopoiesis and the isoforms imbalance correlates with a malignant transformation of B cells. // Oncotarget, 2018. V. 9. P. 29892–29905. https://doi.org/10.18632/oncotarget.25648
Vázquez-Arreguín K, Tantin D. The Oct1 transcription factor and epithelial malignancies: Old protein learns new tricks. // Biochim Biophys Acta, 2016. V. 1859. P. 792–804. https://doi.org/10.1016/j.bbagrm.2016.02.007
Qian J, Kong X, Deng N, et al. OCT1 is a determinant of synbindin-related ERK signalling with independent prognostic significance in gastric cancer. // Gut. 2015. V. 64 (1). P. 37–48. https://doi.org/10.1136/gutjnl-2013-306584
Beurel E, Grieco SF, Jope RS. Glycogen synthase kinase-3 (GSK3): regulation, actions, and diseases. // Pharmacol Ther. 2015. V. 148, P. 114–131. https://doi.org/10.1016/j.pharmthera.2014.11.016
Doumpas N, Lampart F, Robinson MD, et al. TCF/LEF dependent and independent transcriptional regulation of Wnt/β-catenin target genes. // EMBO J, 2019. V. 38 (2), e98873. https://doi.org/10.15252/embj.201798873
Valenta T, Hausmann G, Basler K. The many faces and functions of β-catenin. // EMBO J. 2012. V. 31 (12). P. 2714–2736. https://doi.org/10.1038/emboj.2012.150
Sakamaki J, Daitoku H, Kaneko Y, et al GSK3 regulates gluconeogenic gene expression through HNF4 and FOXO1. // J. Recept. Signal. Transduct. Res. 2012. V. 32. P. 96–101.
Viatour P, Dejardin E, Warnier M, et al. GSK3-mediated BCL-3 phosphorylation modulates its degradation and its oncogenecity. // Mol. Cell. 2004. V. 16. P. 35–45.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


