Доклады Российской академии наук. Науки о жизни, 2021, T. 496, № 1, стр. 85-88
ЭФФЕКТИВНОСТЬ ПОСЛЕДОВАТЕЛЬНОГО ПРИМЕНЕНИЯ ПЛАСТИКОВЫХ И ТИТАНОВЫХ ИМПЛАНТАТОВ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ЗАМЕЩЕНИИ ДЕФЕКТА НИЖНЕЙ ЧЕЛЮСТИ У ЖИВОТНЫХ С ПОМОЩЬЮ ПРЕДВАРИТЕЛЬНОГО ЦИФРОВОГО ПРОЕКТИРОВАНИЯ
Ал. Ал. Долгалев 1, Д. С. Святославов 2, В. А. Путь 2, 3, академик РАН И. В. Решетов 2, 3, И. В. Кастыро 3, 4, *
1 ФГБОУ ВО Ставропольский государственный медицинский университет
Ставрополь, Россия
2 ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
Москва, Россия
3 ЧОУ ВПО Московский университет им. С.Ю. Витте
Москва, Россия
4 ФГАОУ ВО Российский университет дружбы народов
Москва, Россия
* E-mail: ikastyro@gmail.com
Поступила в редакцию 03.10.2020
После доработки 09.10.2020
Принята к публикации 10.10.2020
Аннотация
По предварительно изготовленным методами 3D-проектирования и прототипирования шаблонам в ходе эксперимента созданы дефекты бокового участка нижней челюсти баранов с использованием пьезохирургической техники. Проведено замещение дефектов пластиковыми имплантатами, полученными методом послойного наплавления FDM-печати – fusing deposition modeling и фиксацией титановыми винтами к телу челюсти. Во временном интервале пластиковые имплантаты заменены титановыми, полученными по технологии селективного лазерного спекания (SLS) с использованием 3D-принтера. С целью изучения процессов репаративного остеогенеза были анализированы микропрепараты тканей периимплантационной зоны. В результате были выявлены признаки остео- и фибро-остеоинтеграции. Полученные данные расцениваются как предпосылка для дальнейших клинических испытаний разработанных протоколов последовательного замещения дефектов челюстей с использованием 3D-печати.
ВВЕДЕНИЕ
Костные аллогенные имплантаты имеют ряд недостатков: медленная остеоинтеграция, существует риск передачи от донора к реципиенту бактерий и/или вирусов, развитие реакции гистонесовместимости и хронического гранулематозного воспаления [1–3]. Основным недостатком синтетических материалов, в отличие от ауто-, алло- и некоторых ксенотрансплантатов, является слабая способность к остеоиндукции [4–6].
Лечение дефектов и деформаций дефектов челюстно-лицевой области строится на профилактических принципах предсказуемости и персонализации лечения [7]. Основными этапами такого лечения являются: цифровая диагностика, виртуальное планирование лечения, подбор материала для 3D-прототипирования имплантата, установка имплантата и контроль функциональной нагрузки [8]. Методы провизорной имплантации и последующего системного внедрения постоянных протезных конструкций, изготовленных из чистого титана при лечении пациентов с дефектами лицевого скелета актуальны в связи с малым количеством исследований в данной области [9].
Цель исследования: оценить эффективности последовательного применения пластиковых и титановых имплантатов при замещении дефекта нижней челюсти у животных (овцы) с помощью предварительного цифрового проектирования.
МАТЕРИАЛЫ И МЕТОДЫ
В эксперименте были использованы 4 половозрелых овцы Северо-Кавказской мясошерстной породы в возрасте от 6 мес до 1 года с полностью сформированными корнями зубов. Масса тела животных составляла 37.6 ± 1.73 кг. Овец содержали в вольерах опытной станции Всероссийского научно-исследовательского института овцеводства и козоводства (Россия, Ставропольский край, г. Михайловск) на обычном пищевом рационе.
Протокол эксперимента включал цифровое проектирование и прототипирование в 3D-печати на пластиковых прототипах и последующее двухэтапное замещение бокового дефекта нижней челюсти животных. Под общей анестезией (внутримышечно: раствор тиопентала натрия; 50 мг/кг, 0.25% раствор дроперидола 0.2 мл/кг; 0.5% раствор диазепама, 0.2 мл/кг; 5% раствор трамадола, 1 мл) и с применением местной инфильтрационной анестезии 4% раствором артикаина с эпиневрином 1:200 000 проводилась резекция наружной кортикальной пластинки нижней челюсти, после чего установался пластиковый имплантат, изготовленный по цифровому прототипу (рис. 1).
Рис. 1.
Схема эксперимента. Несквозная резекция, в пределах здоровых тканей (1) в зоне имплантации пластины (2).

До операции под общим наркозом проводили мультиспиральную компьютерную томографию нижней челюсти, с помощью индивидуальных ложек делали оттиски зубных рядов, изготавливались гипсовые модели, которые затем сканировали с помощью внеротового сканера и экспортировались в программу “Implant-Assistent” для моделирования цифрового прототипа имплантата, который накладывали на 3D-реконструкцию зубного ряда, полученного с помощью компьютерной томографии. Далее моделировался хирургический цифровой прототип с учетом состояния будущего костного ложа. Компьютерный проект распечатывался на 3D-принтерах в виде пластикового и титанового имплантатов (рис. 2).
Рис. 2.
Вид гипсовой модели нижней челюсти (а), компьютерная томография нижней челюсти подопытного животного (б).

Экспериментальную часть исследования по установке имплантатов проводили в условиях отделения экспериментальной медицины Ставропольского государственного медицинского университета. Опыты производили в соответствии с положением приказа № 775 МЗ СССР от 12.08.77 г., и с правилами лабораторной практики Российской Федерации № 267 от 2003 г. и стандартом GLP.
Имплантацию пластиковых пластин осуществляли через наружный разрез в поднижнечелюстной области справа длиной 6–7 см после удаления фрагмента наружной кортикальной пластинки в подготовленное ложе. Через 1, 3, 6 мес проводилось удаление пластикового имплантата с одномоментной установкой титанового. Вокруг пластиковой пластины с забором окружающих тканей выполнялся пропил. В ложе устанавливался титановый имплантат. В обоих случаях фиксация имплантатов осуществлялась с помощью винтов для фиксации костных пластин, мягкие ткани послойно ушивали резорбируемым материалом, кожу ушивали нерезорбируемым материалом. Овец начинали кормить мягкой пищей через сутки. Швы снимали на десятые сутки после операции.
Забор материала для морфологических методов исследования проводили с помощью остеотомов, дисковой пилы, костных кусачек через 1, 3 и 6 мес при замене пластикового имплантата на титановый и при выведении животных из эксперимента через 1, 3 и 6 мес после установки титанового имплантата. Фрагменты кости фиксировали в 10% растворе забуференного нейтрального формалина в течение 10 дней, а после проводили декальцинацию. Срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизону, толуидиновым синим, по Маллори в модификации Гейденгайна, проводили ШИК-реакцию.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
При проведении оценки соответствия разработанного протокола поставленной цели исследования на пластиковых прототипах и изготовлении шаблонов предстоящей операции выявлена следующая особенность. Для крупных животных изготовление шаблонов, устанавливаемых в полости рта, не имеет смысла, так как при внесении любого инородного тела в полость рта у животного возникает непроизвольный жевательно-глотательный рефлекс. Таким образом, пластиковый шаблон для данного вида животного, используемый во рту, не эффективен.
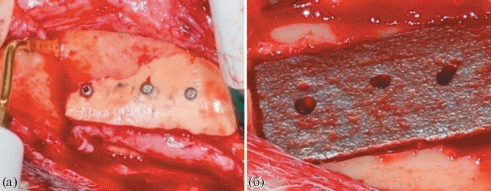
Макроскопически в области пластиковой пластины признаков воспаления не было. На границе соприкосновения кости с краем имплантата местами костная ткань наросла на поверхность пластины, а местами определялась тонкая полоска мягких тканей (рис. 3а). Латеральные края титановых имплантатов были плотно фиксированы к костной ткани, ячейки имплантата заполнены костной тканью, краевые зоны были плотно сращены с костной и окружающей фиброзной-мышечной тканью, гранулематозной ткани не было (рис. 3б).
Во всех случаях микроскопически определялись губчатая кость с неравномерно утолщенной надкостницей и кортикальным слоем, участки лакунарной резорбции костных балок, в костно-мозговых ячейках определялся красный костный мозг. В периимплантационной зоне – слой плотной фиброзной ткани с фибробластами и формированием волокнистых структур с трабекулярным строением незрелой костной ткани с петлистой структурой, слой формирующихся костных балочек с большим количеством остеобластов по их периферии. Процесс перестройки незрелой кости происходил активно. По краям новых костных трабекул выявлялись остеокласты.
Во всех 4 случаях непосредственный контакт костной ткани с титановым имплантатом установлен хорошо, что свидетельствует о хорошем процессе остеоинтеграции. Имелись участки реорганизации тканей нижней челюсти на поверхности раздела имптантат/кость с признаками фиброзно-костной интеграции. В других работах также было показано, что титановые имплантаты не только по своей структуре, но и по физико-механическим свойствам близки к костным тканям – они имеют трабекулярную структуру, сходную со структурой кости [10, 11].
ЗАКЛЮЧЕНИЕ
Последовательное применение пластиковых и титановых имплантатов, изготовленных методами 3D-печати после предварительного цифрового моделирования, вызвало нормальную остео- и фиброинтеграцию тканей с имплантируемым материалом. Такой подход можно использовать в клинической практике у пациентов для замещения хирургических дефектов нижней челюсти. Предварительное моделирование имплантатов позволяет достичь прогнозируемого результата хирургического вмешательства и оценить возможности и перспективы приживаемости имплантата.
Список литературы
Barchenko G. N. Application of artificial calcium-phosphate biomaterials in traumatology and orthopedics], Sbornic rabot Vserossijskoj nauchno-prakticheskoj konferencii [Collection of works of the All-Russian Scientific and Practical Conference], Moscow. 2010: 3–5 (in Russian).
Meyer U., Joos U., Wiesmann H.P. Biological and biophysical principles in extracorporal bone tissue engineering. Part III // Int. J. Oral. Maxillofac Surg. 2004. V. 7. P. 635–641.
Urist M. R. Bone: formation by autoinduction // Science. 1965. V. 150. P. 893–899.
Antonov E. N. Atomic force microscopic study of the surface morphology of apatute films deposited by pulsed laser ablation // Biomaterials. 1997. V. 15. P. 1043–1049.
Qu S. X. Evaluation of the expression of collagen type I in porous calcium phosphate ceramics implanted in an extraosseous site // Biomaterials. 2004. V. 25. P. 659–661.
Seeherman H. J. Recombinant human bone morphogenetic protein-2 delivered in an injectable calcium phosphate paste accelerates osteotomy-site healing in a nonhuman primate model // J Bone Joint Surg. 2004. V. 86-A. P. 1961–1972.
Karpyuk V.B., Perova M.D., Porkhanov V.A., Reshetov I.V., Gilevich I.V., Sevostyanov I.A. The use of the stromal-vascular fraction of adipose tissue in regenerative surgery of the alveolar ridge // Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2019. V. 7 (4). P. 18–26 (in Russian).
Reshetov I.V., Samoilova S.I., Sukortseva N.S., Gaboyan A.G., Svyatoslavov D.S., Put V.A., Kudrin K.G. In vivo modeling of a prefabricated cartilaginous autograft for reconstruction of the auricle in an experiment // Golova i sheya. Rossijskij zhurnal Head and neck Russian Journal. 2020. V. 8 (1). P. 8–14 (in Russian).
Dolgolev A., Reshetov I., Svyatoslavov D., Sinelnikov M., Kudrin K., Dub V., Put V., Anikin V. Experimental Biointegration of a Titanium Implant in Delayed Mandibular Reconstruction // J. Pers. Med. 2020. V. 10 (1). P. 6. https://doi.org/10.3390/jpm10010006
Medlin D.J., Charlebois S., Swartz D., Shetty R. Metalurgical characterization of a porous tantalum biovaterial (trabecular metal) for orthopedic implant applicayions // Advenced materials and processing. 2003. V. 31. P. 32.
Fratzl P. Structure and mechanical quality of the collagen – mineral nano-composite in bone // J MaterChem. 2004. V. 14. P. 2115–2123.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни