Доклады Российской академии наук. Науки о жизни, 2021, T. 497, № 1, стр. 180-184
ПРОДУКЦИЯ ЦИТОКИНОВ БИОПТАТОМ ОПУХОЛИ НА РАЗНЫХ ПАТОЛОГИЧЕСКИХ ПРОГНОСТИЧЕСКИХ СТАДИЯХ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
А. И. Аутеншлюс 1, 2, *, А. А. Студеникина 1, 2, Н. А. Вараксин 3, академик РАН В. В. Ляхович 2
1 ФГБОУ ВО “Новосибирский государственный медицинский университет”
г. Новосибирск, Россия
2 “Научно-исследовательский институт молекулярной биологии и биофизики” – структурное подразделение ФГБНУ ФИЦ ФТМ
г. Новосибирск, Россия
3 АО “Вектор-Бест”
г. Новосибирск, Россия
* E-mail: lpciip@211.ru
Поступила в редакцию 27.11.2020
После доработки 01.12.2020
Принята к публикации 02.12.2020
Аннотация
Выявлены различия в продукции цитокинов биоптатами опухоли в зависимости от патологических прогностических стадий The American Joint Committee on Cancer (AJCC) инвазивной карциномы молочной железы неспецифического типа (ИКНТ). Пациенты с отсутствием метастазов в сочетании с тройным негативным молекулярным подтипом отличаются по цитокинпродуцирующему ресурсу опухоли IL-18, IL-1β, IL-1Ra, TNF-α, GM-CSF и MCP-1 от пациентов других патологических прогностических стадий.
Цитокины, являющиеся плейотропными молекулами, оказывают влияние на активность опухолевых клеток в зависимости от уровня экспрессии биомаркеров [1]. Большинство исследований, посвященных изучению продукции цитокинов, связанных с риском развития рака молочной железы либо его метастазированием, проводятся на клеточных линиях рака молочной железы [2] или на образцах крови пациентов [3], однако нет исчерпывающей информации и исследований на образцах молочной железы и ее микроокружения у пациентов с инвазивной карциномой неспецифического типа (ИКНТ). Сочетание гормонально-рецепторного статуса и анатомических стадий TNM, предложенное в 8 издании комитета The American Joint Committee on Cancer (AJCC) [4], которое по сравнению с 7 изданием позволяет более точно прогнозировать клинические исходы и ответ на лечение у пациентов ИКНТ. Например, селективные модуляторы ER замедляют прогрессирование ER-позитивных и PR-позитивных опухолей [5], а использование в лечении HER2-таргетных препаратов улучшает прогноз у пациентов с его гиперэкспрессией [6]. В нашем исследовании мы изучали продукцию цитокинов в образцах опухолей пациентов, не получавших химио- или лучевую терапию, с последующим сопоставлением цитокинового профиля со стадиями AJCC, полученными после операционного вмешательства, что дает возможность оценить цитокиновый профиль каждой стадии и спрогнозировать степень тяжести заболевания.
Цель исследования – оценить цитокинпродуцирующий ресурс биоптатов больных раком молочной железы на разных патологических прогностических стадиях 8-го издания AJCC 2017 г.
МАТЕРИАЛЫ И МЕТОДЫ
Исследовали образцы опухолей молочной железы 111 пациентов с ИКНТ в возрасте от 23 до 75, средний возраст 56 лет, которым была проведена мастэктомия молочной железы на базе онкологического отделения ГКБ № 1 г. Новосибирска. Неоадъювантная терапия пациентам не проводилась, у них не было обострения очагов хронической инфекции. Сведения о TNM и иммуногистохимических маркёрах предоставлены патологоанатомами. Пациенты были распределены на основе патологической прогностической классификации 8-го издания AJCC и представлены в табл. 1. Все пациенты имели размер опухоли T1-T2 и G2 – умеренную дифференцировку опухоли. Из-за малого количества пациентов, а также наличия лимфогенного метастазирования и большего размера опухоли, пациенты IIB стадии (5 пациентов), IIIA стадии (5 пациентов) и IIIC стадии (1 пациент) были объединены в одну группу – III, в которую вошли 11 пациентов.
Таблица 1.
Клиническая характеристика пациентов
| 8-ed AJCC | T | N | ER | PR | HER2 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T1 | T2 | N0 | N1 | N2 | N3 | + | – | + | – | + | – | |
| IA n = 61 | 62% | 38% | 84% | 16% | – | – | 97% | 3% | 92% | 8% | 31% | 69% |
| IB n = 22 | 18% | 82% | 27% | 55% | 18% | – | 95% | 5% | 73% | 27% | 50% | 50% |
| IIA n = 17 | 18% | 82% | 94% | 6% | – | – | 6% | 94% | – | 100% | 23% | 77% |
| III n = 11 | 9% | 91% | – | 45% | 18% | 37% | 27% | 73% | 36% | 64% | 45% | 55% |
У пациентов IA стадии средний возраст составил 57 лет (от 35 до 75), у IB – 55 лет (от 23 до 75), у IIA – 57 лет (от 38 до 75), у III – 52 года (от 39 до 69).
Парные образцы опухолей объемом 8 мм3 получали методом трепанобиопсии из одного участка опухоли, чем обеспечивался их одинаковый клеточный состав, что исключает необходимость определения опухолевых клеток в каждом из образцов. После чего образцы помещали в 2 флакона: в первый – образец для определения спонтанной продукции (СП) цитокинов, инкубировали в питательной среде DMEM-F12 в объеме 1 мл, а во второй – образец для определения индуцированной продукции (ИП) цитокинов, инкубировали в таком же объеме среды с добавлением в нее поликлональных активаторов (ПА): фитогемагглютинина 4 мкг/мл, конканавалина А 4 мкг/мл и липополисахарида 2 мкг/мл) (набор Стимул Бест, “Вектор-Бест”, Россия). Образцы инкубировали 72 ч при 37°С, затем центрифугировали при 900 g 15 мин, в полученном супернатанте оценивали концентрации IL-2, IL-4, IL-6, IL-8, IL-10, IL-17A, IL-18, IL-1β, IL-1Ra, TNF-α, IFN-γ, G-CSF, GM-CSF, VEGF, MCP-1 с помощью иммуноферментных наборов реагентов производства АО “Вектор-Бест”, Новосибирск. Влияние ПА на продукцию цитокинов биоптатами опухоли оценивали по индексу влияния поликлональных активаторов (ИВПА), выраженного в условных единицах (у.е.) по формуле А/Б, где А – концентрация цитокина при ИП, а Б – концентрация цитокина при СП. Такой подход позволяет получать объективные данные, так как в каждом случае существует свой индивидуальный контроль – спонтанная продукция цитокинов с точно таким же количеством опухолевых клеток, которые находятся в образце ткани молочной железы при культивировании его с поликлональным активатором. Достоверность различий результатов определяли с помощью критерия U Манна–Уитни, используя программный пакет SPSSv17.0 for Windows. Статистически значимыми считали различия при p < 0.05. Результаты исследования представлены как медиана и интерквартильный размах (Me;Q1-Q3).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Данные о спонтанной и индуцированной ПА продукции цитокинов образцами ткани молочной железы пациентов с ИКНТ, достоверно отличающиеся в зависимости от стадий согласно классификации 8 издания AJCC, представлены в табл. 2.
Таблица 2.
Спонтанная и индуцированная ПА концентрация цитокинов (пг/мл) в супернатанте опухоли молочной железы пациентов с инвазивной карциномой неспецифического типа (ИКНТ), распределенных согласно стадиям AJCC
| Цитокины | IA n = 61 | IB n = 22 | IIA n = 17 | III n = 11 |
|---|---|---|---|---|
| СП | ||||
| IL-18 | 42.0 (19.6–102.0) | 64.6 (27.0–160.5) | 217.3 (57.4–1135.3) | 155.2 (43.8–324.0) |
| pIB-IIA = 0.016 | pIA-IIA = 0.006 | pIA-III = 0.021 | ||
| MCP-1 | 1773.0 (294.3–6160.9) | 1404.0 (383.6–2984.3) | 1695.6 (752.4–2664.9) | 375.4 (167.4–1157.0) |
| pIA-III = 0.022 | pIIA-III = 0.010 | |||
| ИП | ||||
| IL-1β | 273.1 (51.4–582.5) | 253.5 (58.9–562.5) | 76.0 (27.2–484.0) | 55.1 (20.0–221.1) |
| pIA-III = 0.033 | ||||
| IL-1Ra | 6850.9 (2702.2–15325.6) | 8853.7 (2799.5–19131.5) | 2261.0 (1331.9–16025.0) | 2977.1 (1307.2–5407.0) |
| pIA-III = 0.030 | ||||
| TNF-α | 16.9 (2.6–53.8) | 8.6 (2.1–23.0) | 3.1 (1.3–11.8) | 3.9 (1.7–33.6) |
| pIA-IIA = 0.020 | ||||
| GM-CSF | 86.3 (14.5–194.1) | 38.2 (10.0–138.0) | 18.7 (4.6–42.9) | 35.3 (8.8–346.0) |
| pIA-IIA = 0.019 | ||||
СП IL-18 у пациентов IIA группы была выше по сравнению с IA и IB группами, кроме того, у пациентов III группы СП этого цитокина выше по сравнению с IA, что отражает роль IL-18 как про-онкогенного цитокина при более злокачественной стадии. СП MCP-1 у пациентов III группы была ниже по сравнению с IA и IIA группами.
У пациентов III группы продукция IL-1β и IL-1Ra при воздействии ПА была низкой по сравнению с группой IA, а стимулированная ПА продукция TNF-α и GM-CSF была ниже у пациентов с ИКНТ IIA по сравнению с пациентами IA группы.
Пациенты с ИКНТ IIA группы отличались низким цитокинпродуцирующим ресурсом по шести цитокинам от пациентов с ИКНТ других групп, что связано как с высокой СП цитокинов, так и со слабым влиянием ПА во IIA группе. Для пациентов с ИКНТ IIA группы характерен низкий ИВПА на продукцию: IL-18 и IL-1Ra по сравнению с IA группой и IL-18, IL-1Ra и TNF-α по сравнению с IA и IB группами (рис. 1), эти цитокины опосредуют активацию внутриклеточных сигнальных путей NF-κB и MAPK, стимулирующих пролиферацию опухоли и ангиогенез [7–9], а также GM-CSF по сравнению с пациентами с ИКНТ других патологических прогностических стадий (рис. 2). Этот цитокин (макрофагальный фактор роста) направляет пролиферацию макрофагов в про-опухолевой фенотип M2 [10]. ИВПА на продукцию MCP-1 пациентов IIA группы был ниже по сравнению с пациентами IA и III групп, MCP-1 в ткани опухоли способствует ангиогенезу и привлекает макрофаги в опухолевый очаг [11]. ИВПА на продукцию IL-1β IIA группы был ниже по сравнению с IA и IB группами.
Рис. 1.
Индекс влияния поликлональных активаторов на продукцию IL-18, IL-1Ra и TNF-α (у.е.) в супернатантах образцов ткани молочной железы пациентов с инвазивной карциномой неспецифического типа (ИКНТ), распределенных согласно стадиям AJCC.
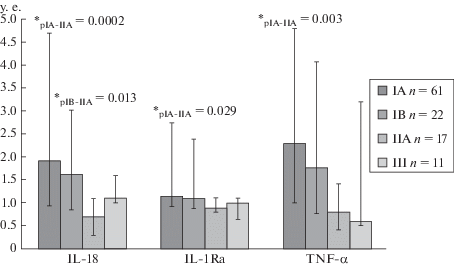
Рис. 2.
Индекс влияния поликлональных активаторов на продукцию IL-1β, GM-CSF и MCP-1 (у.е.) в супернатантах образцов ткани молочной железы пациентов с инвазивной карциномой неспецифического типа (ИКНТ), распределенных согласно стадиям AJCC.
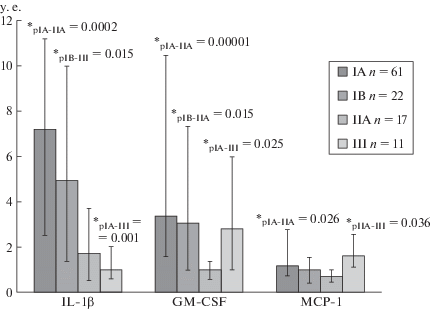
Отличительной чертой пациентов с ИКНТ III группы был более низкий ИВПА на продукцию IL-1β по сравнению с пациентами IA и IB групп, что обусловлено высокой СП этого цитокина в III группе, который в свою очередь повышает экспрессию MCP-1, что согласно данным литературы, способствует ангиогенезу, миграции и инвазии опухолевых клеток [12].
Высокая гетерогенность продукции цитокинов внутри одной прогностической стадии может быть обусловлена несколькими факторами: различной экспрессией рецепторов гормонов и HER2 в рамках одной стадии, возрастными особенностями, а также состоянием иммунной системы у каждого отдельного пациента.
Таким образом, различия в цитокинпродуцирующем ресурсе биоптатов опухоли связаны с патологическими прогностическими стадиями, отражают изменения, происходящие в опухоли и ее микроокружении, и позволяют судить о тяжести опухолевой прогрессии.
Список литературы
Gatti-Mays M.E., Balko J.M., Gameiro S.R. If we build it they will come: targeting the immune response to breast cancer // N.P.J. Breast Cancer. 2019. V. 5. P. 37.
Ortiz-Montero P., Londoño-Vallejo A., Vernot J.P. Senescence-associated IL-6 and IL-8 cytokines induce a self- and cross-reinforced senescence/inflammatory milieu strengthening tumorigenic capabilities in the MCF-7 breast cancer cell line // Cell Commun. Signal. 2017 . V. 15. № 1. P.17.
Ma Y., Ren Y., Dai Z. J. IL-6, IL-8 and TNF-α levels correlate with disease stage in breast cancer patients // Adv. Clin. Exp. Med. 2017. V. 26. № 3. P.421–426.
Gabriel N.H., James L.C., Carl J.D. // American Joint Committee on Cancer staging manual 8th ed. – N.Y.: Springer. 2017. P. 589–628.
Kast K. Impact of breast cancer subtypes and patterns of metastasis on outcome // Breast Cancer Res. Treat. 2015. V. 150. № 3. P. 621–629.
Moasser M.M., Krop I.E. The Evolving Landscape of HER2 Targeting in Breast Cancer // JAMA Oncol. 2015. V. 1. № 8. P. 1154-1161.
Yu P.F., Huang Y., Han Y.Y. TNF alpha-activated mesenchymal stromal cells promote breast cancer metastasis by recruiting CXCR2 (+) neutrophils // Oncogene. 2017. V. 36. P. 482–490.
Yasuda K., Nakanishi K., Tsutsui H. Interleukin-18 in Health and Disease // Int. J. Mol. Sci. 2019. V. 20. № 3. P. 649.
Baker K.J., Houston A., Brint E. IL-1 Family Members in Cancer; Two Sides to Every Story // Front Immunol. 2019. V. 10. P.1197.
Su S., Liu Q., Chen J. A positive feedback loop between mesenchymal-like cancer cells and macrophages is essential to breast cancer metastasis // Cancer Cell. 2014. V. 25. № 5. P. 605–620.
Kersten K., Coffelt S. B., Hoogstraat M. Mammary tumor-derived CCL2 enhances pro-metastatic systemic inflammation through upregulation of IL1β in tumor-associated macrophages // Oncoimmunology. 2017. V. 6. № 8. P. e1334744.
Liubomirski Y., Lerrer S., Meshel T. Tumor-Stroma-Inflammation Networks Promote Pro-Metastatic Chemokines and Aggressiveness Characteristics in Triple-Negative Breast Cancer // Front Immunol. 2019. V. 10. P. 757.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


