Доклады Российской академии наук. Науки о жизни, 2021, T. 497, № 1, стр. 209-212
CTCF ЧЕЛОВЕКА ВЗАИМОДЕЙСТВУЕТ С СР190 ДРОЗОФИЛЫ, НО НЕ С KAISO
К. Ю. Халисова 1, академик РАН П. Г. Георгиев 1, А. Н. Бончук 1, *
1 Федеральное государственное бюджетное учреждение науки Институт биологии гена Российской академии наук (ИБГ РАН)
Москва, Россия
* E-mail: bonchuk_a@genebiology.ru
Поступила в редакцию 04.12.2020
После доработки 13.01.2021
Принята к публикации 14.01.2021
Аннотация
CTCF человека (hCTCF) является основным архитектурным белком млекопитающих. У дрозофилы гомолог CTCF (dCTCF) взаимодействует с ВТВ доменом белка СР190, участвующего в создании открытого хроматина и инсуляции. Ранее было показано, что ВТВ-содержащий белок Kaiso взаимодействует с hCTCF и регулирует его активность. Нами было проведено подробное исследование взаимодействия между белками в дрожжевой двугибридной системе. Неожиданным оказалось, что Kaiso не взаимодействует с hCTCF и его гомологом у дрозофилы. С другой стороны, СР190 взаимодействовал с C-концом hCTCF. Полученные результаты демонстрируют, что взаимодействие между белками CTCF и СР190 является высококонсервативным. Вероятно, что у человека есть другие ВТВ-содержащие белки, которые выполняют функции, описанные для белка СР190 дрозофилы.
Высококонсервативный среди высших эукариот белок CTCF имеет неструктурированные концевые домены и расположенный в центральной части кластер, состоящий из 11 цинковых пальцев С2Н2 типа [1]. У млекопитающих CTCF является основным охарактеризованным архитектурным белком, который поддерживает дистанционные контакты между удаленными участками хромосом [2]. У дрозофилы гомолог CTCF (dCTCF) участвует в организации инсуляторов и дистанционных взаимодействий совместно с белком СР190 [3, 4]. Согласно современным представлениям, подкрепленным многочисленными экспериментальными результатами, у млекопитающих CTCF в кооперации с когезиновым комплексом формирует границы хроматиновых петель и определяет границы большей части топологически ассоциированных доменов (ТАДов) [5]. Также у белков CTCF были идентифицированы N-концевые гомодимеризующие домены, которые могут быть вовлечены в организацию специфичных дистанционных взаимодействий [6]. Роль других партнеров белка hCTCF в организации архитектуры хромосом остается слабо исследованной.
Ранее было показано, что ВТВ домен белка Kaiso взаимодействует с С-концевым неструктурированным районом белка hCTCF [7]. Белок Kaiso человека имеет на N-конце BTB/POZ домен и 3 цинковых пальца, которые узнают метилированный сайт на ДНК [8]. ВТВ/POZ является высококонсервативным доменом у высших эукариот, который формирует гомодимеры и участвуют в белок-белковых взаимодействиях для привлечения транскрипционных комплексов на хроматин [9]. Для Kaiso было показано участие в метилзависимой репрессии путем привлечения корепрессоров N-CoR и SMRT [10].
К семейству белков, содержащих N-концевой ВТВ/POZ домен, также относится белок СР190, который преимущественно связывается с промоторами генов домашнего хозяйства и инсуляторами и участвует в поддержании их активности [11]. Нами было показано, что белок CР190 может взаимодействовать с ДНК-связывающими архитектурными белками с помощью ВТВ и M домена [1, 4]. В том числе ВТВ домен белка СР190 взаимодействует с С-концевым участком белка dСTCF [4]. Белки Kaiso и CP190 имеют во многом сходное строение, что предполагает вероятный консерватизм их функций. Целью исследования стала проверка, насколько консервативны могут быть взаимодействия между CTCF и ВТВ-содержащими белками у человека и дрозофилы.
Так как взаимодействие между С-концевой областью hCTCF и ВТВ доменом Kaiso было исследовано только в дрожжевой двугибридной системе, было решено протестировать взаимодействие между Kaiso и hCTCF in vitro. С этой целью были проэкспрессированы в бактериях С-концевой домен белка CTCF человека (575-727), соединенный с мальтозо-связывающим белком (MBP) и BTB домены белков СР190 (1-126), Каiso (1-130) и GAF (1-134), сшитые с полигистидиновой меткой (6xHis) для дальнейшего соосаждения белков in vitro на аффинном носителе (иммобилизованной амилозе или Ni-NTA сефарозе). Очистка белков за 6xHis использовалась в качестве положительного контроля экспрессии ВТВ доменов в бактериях. В результате было показано, что ВТВ Каiso и CP190 не взаимодействуют с С-концом CTCF человека (рис. 1). В то же время ВТВ домен СР190 соосаждается с С-концевым участком dCTCF. Таким образом, не было подтверждено взаимодействие между Kaiso и hCTCF in vitro.
Рис. 1.
Анализ взаимодействия между слитыми с MBP С-концевыми доменами белков СTCF человека и дрозофилы (hCTCF и dCTCF) и ВТВ доменами Kaiso, СР190, GAF, слитыми с 6xHis, in vitro при помощи соосаждения на иммобилизованной амилозе (MBP-pulldown). Соосаждение на Ni-NTA (6xHis-pulldown) использовалось как контроль уровня экспрессии ВТВ-доменов. Соосажденные белки были разделены при помощи SDS-PAGE и окрашены Coomassie. Позиции аминокислотных остатков указаны в квадратных скобках.

Для подтверждения непредвиденного результата было проведено исследование взаимодействия между белками в дрожжевой двугибридной системе, которая позволяет изучать целые белки, а не их отдельные домены (рис. 2). Белок Kaiso имеет один-два района, которые могут приводить к сильной активации транскрипции репортерных генов, в том случае если они соединены с ДНК-связывающим доменом GAL4, что ограничивало применение данных конструкций полноразмерного белка для оценки взаимодействий в дрожжевой двугибридной системе. Исследования полноразмерного Kaiso возможны лишь в случае соединения его с активационным доменом GAL4. Для полной картины нами также были исследованы меньшие фрагменты белка, содержащие BTB домен, ВТВ домен и прилежащие неструктурированные участки, кластер цинковых пальцев (рис. 2в). Для оценки консервативности взаимодействия ВТВ-содержащих белков с CTCF были тестированы взаимодействия белка СР190 с CTCF человека (рис. 2а, 2б). Положительными контролями эксперимента служила способность ВТВ-содержащих белков (Kaiso, CP190) к димеризации.
Рис. 2.
Исследование взаимодействий между белками dСTCF, hCTCF, Kaiso и CP190 в дрожжевой двугибридной системе. (а) Исследование взаимодействия между CP190 и hCTCF. Фрагменты CP190 были слиты с ДНК-связывающим доменом GAL4 (BD) и исследовано их взаимодействие с hCTCF, слитым с активационным доменом GAL4 (AD). На схеме полноразмерного CP190 белковые домены обозначены прямоугольниками, линии показывают исследуемые фрагменты белка (соответствующие аминокислотные остатки указаны слева). Результаты представлены в колонках справа, где + и – означают наличие или отсутствие взаимодействия соответственно. В качестве положительного контроля проверялась способность ВТВ доменов к димеризации, а в качестве отрицательного контроля – тестирование на наличие взаимодействия только с активационным (AD) или ДНК-связывающим (BD) доменом белка GAL4. (б) Локализация домена белка hCTCF, необходимого для взаимодействия с СР190. Различные фрагменты hCTCF были слиты с ДНК-связывающим доменом GAL4 и исследовано их взаимодействие с СР190, слитым с активационным доменом GAL4. Остальные обозначения такие же, как в (а). (в) Исследование взаимодействия между белками Kaiso и hCTCF, dСTCF. Полноразмерный Kaiso был слит с активационным доменом GAL4, различные фрагменты Kaiso были соединены как с ДНК-связывающим, так и с активационным доменом GAL4. Все полученные производные были протестированы в дрожжевой двугибридной системе на способность к взаимодействию с CTCF человека и дрозофилы. Остальные обозначения такие же, как в (а).
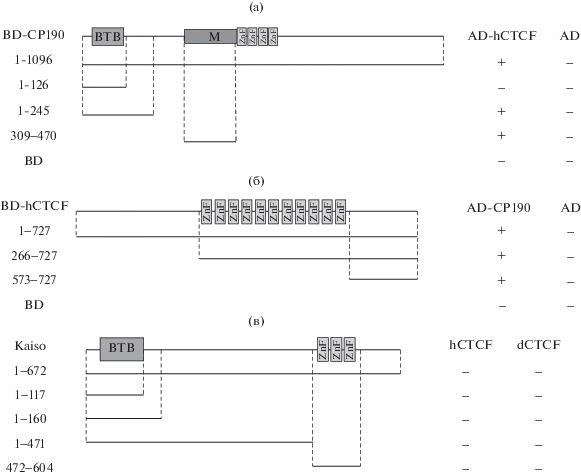
В результате всех проведенных исследований нами не было показано взаимодействие между BTB Kaiso и hCTCF. Интересно, что большие фрагменты белка Kaiso, включающие прилежащие неструктурированные участки белка, также не взаимодействуют с hCTCF, что противоречит ранее полученным в дрожжевой системе данным [7]. Также с Kaiso не взаимодействует dCTCF. При исследовании взаимодействия белка СР190 было обнаружено, ВТВ домен белка СР190 взаимодействовал только с С-концевым районом CTCF дрозофилы. Неожиданным оказалось, что М-домен белка СР190 одновременно взаимодействует с С-концами белков CTCF дрозофилы и человека, что указывает на консервативность взаимодействия.
Отсутствие взаимодействия между белками Kaiso и hCTCF нельзя считать неожиданным. Эти белки являются антагонистами в регуляции экспрессии и связывании с геномными сайтами. Белок CTCF обеспечивает создание открытого хроматина и теряет способность связываться с метилироваными сайтами, что приводит к инактивации транскрипции [2]. Наоборот, Kaiso связывается с метилированной ДНК и может рекрутировать комплексы, которые усиливают метилирование ДНК и репрессию транскрипции [12, 13]. Вследствие этого можно предположить, что hCTCF и Kaiso формируют на хроматине альтернативные комплексы. Обратная ситуация наблюдается в случае dCTCF и CP190, которые функционируют совместно в организации активных промоторов и инсуляторов [4, 11, 14]. Можно предположить, что взаимодействие между CTCF и СР190-подобными белками является высококонсервативным и М-подобный домен осуществляет взаимодействие между неидентифицированным ВТВ-содержащим белком и hCTCF при активации промоторов человека. В настоящее время не найдено стабильных ВТВ-содержащих партнеров белка hCTCF, поэтому направленный поиск партнеров hCTCF между ВТВ белками человека является актуальной задачей.
Список литературы
Fedotova A.A., Bonchuk A.N., Mogila V.A., et al. // Acta Naturae. 2017. V. 9. № 2. P. 47–58.
Arzate-Mejía R.G., Recillas-Targa F., Corces V.G. // Development. 2018. V. 145. P. 6.
Kyrchanova O., Ivlieva T., Toshchakov S., et al. // Nucleic Acids Res. 2011. V. 39. P. 8. P. 3042–3052.
Bonchuk A., Maksimenko O., Kyrchanova O., et al. // BMC Biol. 2015. V. 13. P. 63.
Szabo Q., Bantignies F., Cavalli G., et al. // Sci Adv. 2019. V. 5. P. 4.
Bonchuk A., Kamalyan S., Mariasina S., et al. // Sci Rep. 2020. V. 10. P. 1.
Defossez P.A., Kelly K.F., Filion G.J., et al. // J. Biol. Chem. 2005. V. 280. № 52. P. 43017–43023.
Prokhortchouk A., Hendrich B., Jørgensen H., et al. // Genes Dev. 2001 V. 15. P. 13.
Stogios P.J., Downs G.S., Jauhal J.J., et al. // Genome Biol. 2005. V. 6. № 10. P. 1–18.
Raghav S.K., Waszak S.M., Krier I., et al. // Mol Cell. 2012. V. 46. P. 335–350.
Ahanger S.H., Shouche Y.S., Mishra R.K., et al. // Nucleus. 2013. V. 4. № 2. P. 115–22.
Filion G.J., Zhenilo S., Salozhin S., et al. // Mol Cell Biol. 2006. V. 1. P. 169–181.
Zhenilo S., Deyev I., Litvinova E., et al. // Cell Death Differ. 2018. V. 11. P. 1938–1951.
Bartkuhn M., Straub T., Herold M., et al. // EMBO J. 2009. V. 28(7). P. 877–888.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


