Доклады Российской академии наук. Науки о жизни, 2021, T. 497, № 1, стр. 156-159
АНГИОГЕННЫЕ ЭФФЕКТЫ АНКСИОЛИТИКА ФАБОМОТИЗОЛА
С. А. Крыжановский 1, *, Т. А. Антипова 1, М. Б. Вититнова 1, С. В. Николаев 1, член корреспондент РАН А. Д. Дурнев 1
1 Федеральное государственное бюджетное учреждение “Научно-исследовательский институт фармакологии имени В.В. Закусова”
Москва, Россия
* E-mail: sak-538@yandex.ru
Поступила в редакцию 17.07.2020
После доработки 05.11.2020
Принята к публикации 09.11.2020
Аннотация
В экспериментах in vitro, выполненных на культуре клеток эндотелия человека HUVEC, показано, что анксиолитик фабомотизол, который, помимо собственно анксиолитической, обладает нейропротектерной и кардиопротективной активностью, которую во многом связывают с его агонистическим влиянием на сигма-1 рецепторы, проявляет выраженную ангиогенную активность. Ангиогенная активность фабомотизола реализуется в диапазоне концентраций от 10–5 М до 10–8 М и носит дозозависимый характер. В литературе данных о наличии у агонистов сигма-рецепторов ангиогенной активности ранее представлено не было.
Анксиолитик фабомотизол (5-этокси-2-[2-(морфолино)-этилтио] бензимидазола дигидрохлорид, син. афобазол), синтезирован и фармакологически изучен в НИИ фармакологии имени В.В. Закусова под руководством академика РАН С.Б. Середенина. В основе анксиолитического действия фабомотизола лежит его способность восстанавливать связывание в бензодиазепиновом участке ГАМКА-рецептора, нарушенное вследствие стресс-индуцированных воздействий [1]. Поскольку фабомотизол сам не связывается с ГАМКА-рецепторным комплексом, восстановление функциональной активности рецептора опосредуется взаимодействием препарата с рядом биологических мишеней.
Показано, что фабомотизол обладает довольно высоким аффинитетом к мелатониновым М1-рецепторам (Ki = 1.4 × 10–5 М), мелатониновым М3-рецепторам (Ki = 9.7 × 10–7 М), рецепторному участку моноаминооксидазы А (МАО-А) (Ki = = 3.6 × 10–6 М) и к сигма-1 рецепторам (Ki = 5.9 × × 10–6 М) [2]. Помимо анксиолитической, фабомотизол обладает выраженной антимутагенной [3] и цитопротектерной, в частности нейропротектерной [4, 5] и кардиопротективной [6] активностью. Нейропротекторную активность препарата изначально связывали с его агонистическим влиянием на сигма-1 рецепторы (σ1-R) [4, 5]. Однако позднее было показано, что она обусловлена агонистическим влиянием препарата как на σ1-R, так и на σ2-R [7]. Исходя из имеющихся данных, кардиопротективная активность препарата реализуется путем активации σ1-R, поскольку в настоящее время отсутствуют какие-либо убедительные данные об экспрессии в кардиомицитах σ2-R. Если механизмы, посредством которых агонисты σ-R реализуют свою нейро- и кардиопротективную активность, в определенной мере известны [8, 9], то вклад σ-R в физиологию и патологию сосудистого русла практически не изучен, имеется лишь несколько сообщений о наличии у агонистов σ-R NO-обусловленной вазодилатирующей активности [10]. Данные о наличии/отсутствии у агонистов σ-R ангиогенной активности в литературе отсутствуют.
Оценку ангиогенной активности фабомотизола проводили в экспериментах in vitro на культуре клеток эндотелия человека HUVEC.
Клетки эндотелия HUVEC рассаживали в среде ДМЕМ (HyClone, США), содержащей 20 мМ Hepes (ICN, Германия), 2 мМ L-глутамина (ICN, Германия), гепарин (5 Ед/мл) (Панфарма, Германия), ECGF (20 мкг/мл) (Sigma, США), 10% FBS (Gibco, США) с плотностью 4.0 тыс. на 96-луночные планшеты, покрытые 0.1% желатином (БиолоТ, Россия). Фабомотизол (диапазон концентраций 10–5, 10–6, 10–7 и 10–8 М) вносили через 30 мин после рассеивания клеток на планшеты и затем каждые 48 ч (всего 3 внесения). Через 24 ч после последнего внесения фабомотизола клетки фотографировали с помощью микроскопа Nikon Eclipse TS100-F (Nikon, Япония) в фазовом контрасте при увеличении ×100. Длину микротрубочек измеряли в 5 полях зрения каждой лунки с использованием программы WCIF ImageJ и выражали в микрометрах.
Полученные данные обрабатывали с помощью методов математической статистики. Нормальность распределения проверяли с помощью критерия Лилиефорса. Так как распределение полученных данных значительно отличалось от нормального, статистическую значимость различий между выборками определяли с помощью непараметрического аналога однофакторного дисперсионного анализа по Краскелу–Уоллису с дальнейшей обработкой методом множественных сравнений по Данну. Полученные данные представляли виде медиан и нижнего и верхнего квартилей. Критический уровень значимости α = 0.05.
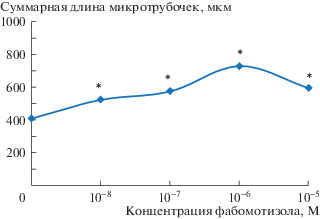
Как следует из полученных данных, фабомотизол во всех использованных концентрациях стимулирует ангиогенез, о чем свидетельствует статистически значимое (р ≤ 0.05) увеличение суммарной длины микротрубочек (табл. 1). Наибольший ангиогенный эффект фабомотизол оказывал в концентрации 10–6 М. В этом случае длина микротрубочек увеличилась с 408 мкм до 729 мкм, т.е. практически на 80%. Ангиогенное действие препарата носит классический куполообразный дозозависимый характер с минимальной точкой при концентрации фабомотизола в 10–8 М и максимальной – 10–6 М (рис. 1).
Таблица 1.
Суммарная длина микротрубочек в культуре клеток сосудистого эндотелия (HUVEC) после внесения фабомотизола в различных концентрациях
| Группа | Суммарная длина микротрубочек, мкм | ||
|---|---|---|---|
| Нижний квартиль | Медиана | Верхний квартиль | |
| Контроль | 209 | 408 | 596 |
| Фабомотизол, 10–5 М | 380 | 596* | 832 |
| Фабомотизол, 10–6 М | 578 | 729* | 997 |
| Фабомотизол, 10–7 М | 418 | 575* | 762 |
| Фабомотизол, 10–8 М | 321 | 523* | 818 |
Рис. 1.
Суммарная длина микротрубочек в культуре клеток HUVEC после внесения фабомотизола в различных концентрациях.
Хорошо известно, что при многих заболеваниях головного мозга и сердца ангиогенез или подавляется, или недостаточно эффективен, в силу чего изучение механизмов и способов регуляции ангиогенеза как инструмента терапевтического ремоделирования недостаточного неоангиогенеза имеет стратегически важное значение, особенно в тех случаях, когда применение высокоэффективных хирургических и/или эндоваскулярных методов лечения или невозможно, или сопряжено с высоким риском развития тяжелых осложнений. Такой подход к лечению ишемических состояний получил название “терапевтический ангиогенез” или “биологическое шунтирование” [11, 12 и др.]. В основе этого направления лежит поиск лекарственных средств, преимущественно биоподобных препаратов, аналогов эндогенных стимуляторов ангиогенеза, обладающих способностью усиливать естественные, но недостаточные в критических ситуациях, процессы неоваскуляризации тканей [13, 14]. Как правило, оригинальные химические соединения не биоподобной структуры в качестве потенциальных стимуляторов неоангиогенеза не рассматриваются, в силу чего наличие у фабомотизола, препарата не биоподобной структуры, выраженной ангиогенной активности может носить не только практическое, но и фундаментальное значение.
Как уже было отмечено выше, в настоящее время отсутствуют данные о наличии у агонистов σ-R ангиогенной активности. В литературе представлена единственная публикация, свидетельствующая о том, что метаболит (±) галоперидола – II valproate ester [(±)-MRJF22], который является неселективным антагонистом σ1-R и σ2-R, подавляет ангиогенез в микрососудах сетчатки глаза [15], что позволило авторам этой статьи высказать предположение о том, что антиангиогенное действие метаболита может реализоваться путем блокады σ-R. Исходя из этого, поскольку для фабомотизола показано агонистическое влияние в отношении σ-R, можно полагать, что именно с этим в той или иной мере связана его ангиогенная активность. Также есть все основания полагать, что в нейро- и кардиопротективное [6, 7] действие фабомотизола, реализующееся в условиях систематической экспериментальной терапии, может вносить вклад его способность стимулировать неоангиогенез в ишемизированной ткани.
Изучение механизмов, лежащих в основе этого эффекта фабомотизола, – это предмет дальнейших скрупулезных исследований, особенно с учетом того, что поскольку σ1-R рассматривают как уникальный эволюционный комплекс, обладающий шаперонной активностью, нельзя исключить, что ангиогенная активность агонистов σ1-R может быть и не связана с известными механизмами, ответственными за стимуляцию ангиогенеза. Только после этих исследований можно будет ответить на вопрос, посредством стимуляции каких индукторов ангиогенеза реализуется этот вид активности агонистов σ1-R.
Таким образом, нами впервые показано, что лиганд σ-R анксиолитик фабомотизол обладает значимой ангиогенной активностью. В литературе данных о наличии у агонистов σ-R ангиогенной активности ранее представлено не было.
Список литературы
Середенин С.Б., Воронина T.А., Незнамов Г.Г., и др. Фармакогенетическая концепция анксиоселективного эффекта // Вестник РАМН. 1998. № 11. С. 3–9.
Середенин С.Б., Воронин М.В. Нейрорецепторные механизмы действия афобазола // Эксп. и клин. фармакология. 2009. Т. 1. № 72. С. 3–11.
Durnev A.D., Zhanataev A.K., Shreder O.V., Seredenin S.B. Antimutagenic and antiteratogenic properties of afobazole // Ekspp. Klin. Farmakol. 2009. V. 72. № 1. P. 46–51.
Zenina T.A., Gavrish I.V., Melkumyan D.S., et al. Neuroprotective properties of afobazol in vitro // Bull. Exp. Biol. Med. 2005. V. 140. № 2. P. 194–196. https://doi.org/10.1007/s10517-005-0443-7
Cuevas J., Behensky A., Deng W., Katnik C. Afobazole modulates neuronal response to ischemia and acidosis via activation of sigma-1 receptors // J. Pharmacol. Exp. Ther. 2011. V. 339. № 1. P. 152–160. https://doi.org/10.1124/jpet.111.182774
Середенин С.Б., Цорин И.Б., Вититнова М.Б., и др. К механизму противоишемического действия афобазола // Бюлл. эксперим. биологии и медицины. 2013. Т. 155. № 6. С. 723–727.
Katnik C., Garcia A., Behensky A.A., et al. Activation of σ1 and σ2 receptors by afobazole increases glial cell survival and prevents glial cell activation and nitrosative stress after ischemic stroke // J. Neurochem. 2016. V. 139. № 3. P. 497–509. https://doi.org/10.1111/jnc.13756
Середенин С.Б., Воронин М.В., Абрамова Е.В. Сигма-1 рецепторы – новая мишень фармакологической регуляции // Эксперим. и клин. фарм. 2017. Т. 80. № 9. С. 9–19.
Lewis R., Li J., McCormick P.J., L-H Huang C., Jeevaratnam K. Is the sigma-1 receptor a potential pharmacological target for cardiac pathologies? A systematic review // Int. J. Cardiol. Heart. Vasc. 2019. V. 26. 100449. https://doi.org/10.1016/j.ijcha.2019.100449
Trujillo A.N., Katnik C., Cuevas J., et al. Modulation of mesenteric collecting lymphatic contractions by σ1-receptor activation and nitric oxide production // Am. J. Physiol. Heart Circ. Physiol. 2017. V. 313. P. 839–853. https://doi.org/10.1152/ajpheart.00702.2016
Парфенова Е.В., Ткачук В.А. Терапевтический ангиогенез: достижения, проблемы, перспективы. // Кардиологический вестник. 2007. Т. II (XIV). № 2. С. 5–15.
Veith A.P., Henderson K., Spencer A., et al. Therapeutic strategies for enhancing angiogenesis in wound healing // Adv. Drug. Deliv. Rev. 2019. V. 146. P. 97–125. https://doi.org/10.1016/j.addr.2018.09.010
Макаревич П.И., Рубина К.А., Дыйканов Д.Т. и др. Терапевтический ангиогенез с применением факторов роста: современное состояние и перспективы развития // Кардиология. 2015. Т. 59. № 9. С. 59–71.
Wang J., Fu X., Yu L., Li N., et al. Preconditioning with VEGF enhances angiogenic and neuroprotective effects of bone marrow mononuclear cell transplantation in a rat model of chronic cerebral hypoperfusion // Mol. Neurobiol. 2016. V. 53. № 9. P. 6057–6068. https://doi.org/10.1007/s12035-015-9512-8
Olivieri M., Amata E., Vinciguerra S., et al. Antiangiogenic effect of (±)-haloperidol metabolite II valproate ester [(±)-MRJF22] in human microvascular retinal endothelial cells // J. Med. Chem. 2016. V. 59. № 21. P. 9960–9966. https://doi.org/10.1021/acs.jmedchem.6b01039
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


