Доклады Российской академии наук. Науки о жизни, 2021, T. 497, № 1, стр. 160-164
ФАКТОРЫ ИММУНОСУПРЕССИИ PD-1, PD-L1, IDO1 И КОЛОРЕКТАЛЬНЫЙ РАК
О. В. Ковалева 1, *, М. А. Рашидова 1, А. Н. Грачев 1, В. В. Масленников 1, И. В. Булычева 1, Е. С. Герштейн 1, Е. А. Короткова 1, Н. Ю. Соколов 1, З. З. Мамедли 1, академик РАН Н. Е. Кушлинский 1
1 ФГБУ “Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина” Минздрава России
Москва, Россия
* E-mail: ovkovaleva@gmail.com
Поступила в редакцию 05.10.2020
После доработки 16.10.2020
Принята к публикации 17.10.2020
Аннотация
В связи с низкой эффективностью иммунотерапии колоректального рака (КРР) крайне перспективным и актуальным является изучение механизмов иммуносупрессии. В данной работе впервые проведено комплексное исследование экспрессии растворимых и тканевых форм PD-1 и PD-L1 в сыворотке крови и опухолях больных КРР, а также IDO1 в опухолях. Определена диагностическая и прогностическая значимость исследованных показателей. Выявлены статистически значимое снижение содержания растворимых форм PD-1 и PD-L1 в сыворотке крови и ассоциация количества PD-L1+ клеток в строме опухолей со стадией КРР. Показано отсутствие корреляций между растворимыми и тканевыми формами исследуемых белков, указывающее на наличие независимых механизмов иммуносупрессии при КРР, что может объяснять неэффективность иммунотерапии данного типа опухолей.
Важной особенностью развития злокачественной опухоли считают ее уход от иммунологического надзора, что способствует его прогрессированию заболевания. Опухолевые клетки и инфильтрирующие иммунные клетки продуцируют факторы, которые модифицируют микроокружение, придавая ему иммуносупрессивный фенотип. Одними из основных факторов, опосредующих иммуносупрессию, являются PD-1, PD-L1 и IDO1. PD-1 – мембранный рецептор I типа, принадлежащий к семейству CD28/CTLA-4 регуляторов Т-клеток и экспрессирующийся на их поверхности. PD-L1 (B7-H1, CD274) [1] и PD-L2 (B7-DC, CD273) [2] – основные лиганды рецептора PD-1. Активация ключевой точки PD-1/PD-L1 стимулирует апоптоз антиген-специфичных Т-лимфоцитов и подавляет апоптоз регуляторных супрессорных Т-клеток, что является одним из механизмов иммуносупрессии опухоли [3]. IDO1 (indoleamine-2,3-dioxygenase) – фермент, активация которого приводит к деградации L-триптофана (Trp) с образованием N-формилкинуренина [4], а далее целого ряда продуктов, что способствует гибели эффекторных Т-клеток и привлечению Т-клеток регуляторного фенотипа [5, 6].
Целью данной работы было проведение комплексного исследования содержания растворимых форм PD-1, PD-L1 (sPD-1, sPD-L1) в сыворотке крови и уровня их экспрессии в опухоли, а также экспрессии IDO1 в опухолях больных колоректальным раком (КРР), с последующим анализом их ассоциации с клинико-морфологическими характеристиками заболевания и корреляционных связей между указанными маркерами.
В исследование включили 85 первичных больных КРР и 27 здоровых доноров, составивших группу контроля, проходивших обследование и лечение в ФГБУ “НМИЦ онкологии им. Н.Н. Бло-хина” Минздрава России. Все процедуры, выполненные в исследовании с участием больных и здоровых людей, соответствуют этическим стандартам этического комитета организации и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. От каждого из включенных в исследование участника получено информированное добровольное согласие. Клинический диагноз у всех пациентов подтвержден данными морфологического исследования опухоли согласно Международной гистологической классификации опухолей пищеварительной системы (ВОЗ, 2019), у всех пациентов выявлена аденокарцинома толстой кишки. Характеристика исследуемой выборки больных КРР представлена в табл. 1.
Таблица 1.
Клинико-морфологические характеристики больных КРР
| Характеристика | Всего |
|---|---|
| Возраст | |
| ≤60 | 30 (35%) |
| >60 | 55 (65%) |
| Пол | |
| мужской | 46 (54%) |
| женский | 39 (46%) |
| Стадия | |
| I–II | 57 (67%) |
| III–IV | 28 (33%) |
| T – размер опухоли | |
| T1-2 | 27 (32%) |
| T3-4 | 58 (42%) |
| N – регионарные метастазы | |
| N– | 62 (73%) |
| N+ | 23 (27%) |
| M – отдаленные метастазы | |
| M– | 73 (86%) |
| M+ | 12 (14%) |
| Дифференцировка опухоли | |
| G1 | 21 (25%) |
| G2/3 | 64 (75%) |
| Локализация опухоли | |
| прямая кишка | 31 (36%) |
| слепая и ободочная кишка | 54 (64%) |
Концентрацию sPD-L1 и sPD-1 определяли в сыворотке крови методом прямого иммуноферментного анализа Human PD-L1 Platinum ELISA и Human PD-1 ELISA kit (Affimetrix, eBioscience, США). Разделение на группы с низким и высоким содержанием sPD1 и sPD-L1 в сыворотке крови проводили относительного их средних значений. Оценку уровня экспрессии PD-L1 и IDO1 в опухолях проводили методом иммуногистохимии (ИГХ) по стандартной методике с использованием антител к PD-L1 (клон 4Е12; Р-Фарм, Россия) и IDO1 (клон D5J4E, Cell Signaling Technology, USA). Для IDO1 и PD-L1 оценивали экспрессию в опухолевых клетках и строме. В зависимости от экспрессии IDO1 и PD-L1 в опухолевых клетках образцы разделены на 2 группы: с наличием и отсутствием экспрессии.
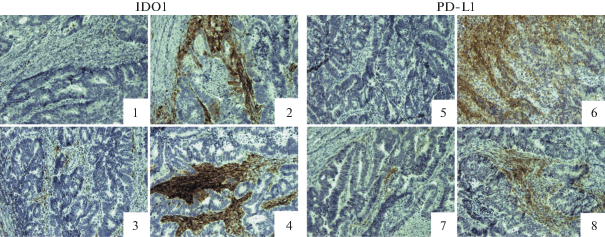
При оценке стромы образцы опухолей разделили на 3 группы с учетом количества PD-L1+ клеток: 0 – отсутствие PD-L1+ клеток, 1 – низкое содержание PD-L1+ клеток, 2 – высокое содержание PD-L1+ клеток. По экспрессии IDO1 в строме опухоли образцы разделили на 2 группы: 1 – отсутствие или низкое содержание IDO1+ клеток; 2 – высокое содержание IDO1+ клеток (рис. 2).
Рис. 1.
1) Сравнительный анализ уровня экспрессии sPD-1 и sPD-L1 у больных КРР и здоровых доноров. 2) ROC-анализ для sPD1 и sPD-L1 у больных КРР: площадь под ROC-кривой составляет 0.694 (69%) для sPD-L1 и 0.649 (64%) для sPD1.
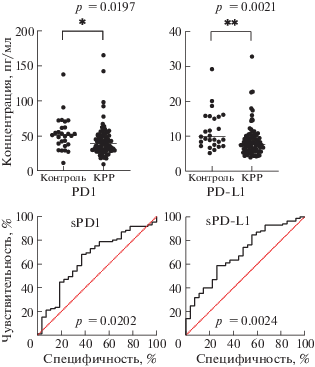
Рис. 2.
Экспрессия IDO1 и PD-L1 при КРР. Отсутствие экспрессии IDO1 (1) в опухолевых клетках и PD-L1 (5) в опухолевых и стромальных клетках. Экспрессия IDO1 (2) и PD-L1 (6) в опухолевых и стромальных клетках. Низкое содержание IDO1+ (3) и PD-L1+ (7) клеток в строме опухоли. Высокое содержание IDO1+ (4) и PD-L1+ (8) клеток в строме опухоли.
sPD-1 и sPD-L1 при КРР. Анализ результатов исследования показал, что среднее содержание sPD-1 в сыворотке крови здоровых доноров составило 53.07 ± 24.23 пг/мл (11.37–137.8), в группе пациентов с аденокарциномой толстой кишки 47.99 ± 39.32 пг/мл (9.51–287.0). Среднее содержание sPD-L1 в сыворотке крови здоровых доноров составило 13.25 ± 10.17 пг/мл (5.19–56.6), в группе пациентов с аденокарциномой 8.82 ± 4.52 пг/мл (3.19–32.81). Результаты представлены на рис. 1.
Проведенный анализ показал, что у больных КРР наблюдается статистически значимое снижение содержания sPD-1 и sPD-L1 (p = 0.0021 и p = 0.0197 соответственно) в сыворотке крови по сравнению с контролем. Для оценки диагностической значимости снижения уровня содержания PD-1 и PD-L1 в сыворотке крови в качестве маркера КРР проведен ROC анализ. Площадь под ROC-кривой, равная 0.694 для PD-1 и 0.649 для PD-L1, свидетельствует о среднем качестве модели, что не позволяет использовать полученные данные для диагностических целей.
Уровни sPD-1, sPD-L1 и клинико-морфологические характеристики КРР. Провели анализ уровней sPD-1 и sPD-L1 в сыворотке крови больных КРР в зависимости от основных клинико-морфологических характеристик заболевания, результаты представлены в табл. 2.
Таблица 2.
Ассоциация содержания sPD1 и sPD-L1 с клинико-морфологическими характеристиками КРР
| sPD-1 (пг/мл) | p | sPD-L1 (пг/мл) | p | |||
|---|---|---|---|---|---|---|
| низ-кий | вы-сокий | низ-кий | вы-сокий | |||
| Возраст | <0.05 | 0.49 | ||||
| ≤60 | 23 | 7 | 20 | 10 | ||
| >60 | 20 | 35 | 32 | 23 | ||
| Пол | 0.49 | 0.19 | ||||
| мужской | 33 | 13 | 25 | 21 | ||
| женский | 25 | 14 | 27 | 12 | ||
| Стадия | 0.14 | 0.23 | ||||
| I–II | 42 | 15 | 39 | 18 | ||
| III–IV | 16 | 12 | 15 | 13 | ||
| Размер опухоли | 0.62 | >0.99 | ||||
| T1-T2 | 17 | 10 | 17 | 10 | ||
| T3-T4 | 41 | 17 | 35 | 23 | ||
| N – регионар-ные метастазы | <0.05 | <0.05 | ||||
| N0 | 46 | 16 | 40 | 22 | ||
| N+ | 9 | 14 | 9 | 14 | ||
| M – метастазы | 0.74 | 0.20 | ||||
| M0 | 49 | 24 | 47 | 26 | ||
| M+ | 9 | 3 | 5 | 7 | ||
| Дифференци-ровка опухоли | 0.79 | 0.31 | ||||
| G1 | 14 | 7 | 15 | 6 | ||
| G2/3 | 48 | 21 | 37 | 27 | ||
| Локализация опухоли | 0.47 | 0.65 | ||||
| прямая кишка | 23 | 8 | 20 | 11 | ||
| слепая и обо- дочная кишка | 35 | 19 | 32 | 22 | ||
Выявили, что содержание в сыворотке крови рецептора sPD-1 связано с возрастом, у пациентов в возрасте ≤60 лет уровень маркера ниже по сравнению со старшей возрастной группой (>60 лет). Необходимо отметить, что концентрация sPD-1 и sPD-L1 ассоциирована с наличием метастазов в регионарных лимфоузлах. В группе пациентов с регионарными метастазами КРР наблюдали более высокое содержание исследуемых маркеров по сравнению с пациентами без распространения опухолевого процесса в лимфоузлах.
Экспрессия PD-L1 и IDO1 при КРР. Методом ИГХ провели анализ экспрессии PD-L1 и IDO1 в опухолях больных КРР. Обнаружено, что в опухолевых клетках PD-L1 экспрессируется в 26% случаев (22 из 85), а IDO1 в 36% (31 из 85). В строме опухолей IDO1 обнаружен в большинстве образцов, однако сильную инфильтрацию IDO1+ клетками стромы наблюдали в 34% случаев (29 из 85). Для PD-L1 результаты отличались. А именно, 35% образцов (30 из 85) не содержали PD-L1+ клеток в опухолевой строме. В остальных исследованных образцах отмечено наличие PD-L1+ клеток в строме: 35% образцов (30 из 85) составили группу с низкой инфильтрацией и 29% образцов (25 из 85) составили группу с высокой инфильтрацией (рис. 2).
Далее провели анализ ассоциации уровней экспрессии PD-L1 и IDO1 в опухолях с клинико-морфологическими характеристиками КРР. Результаты представлены в табл. 3.
Таблица 3.
Ассоциация уровня экспрессии PD-L1 и IDO1 в опухоли с клинико-морфологическими характеристиками КРР
| PD-L1 (опухоль) | PD-L1 (строма)) | IDO1 (опухоль) | IDO1 (строма)) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| низкий | высокий | p | низкий | высокий | p | низкий | высокий | p | низкий | высокий | p | |
| Возраст | 0.44 | 0.63 | 0.480 | 0.34 | ||||||||
| ≤60 | 24 | 6 | 12 | 18 | 21 | 9 | 22 | 8 | ||||
| >60 | 39 | 16 | 18 | 37 | 33 | 22 | 34 | 21 | ||||
| Пол | >0.99 | >0.99 | 0.654 | >0.99 | ||||||||
| мужской | 34 | 12 | 16 | 30 | 28 | 18 | 30 | 16 | ||||
| женский | 29 | 10 | 14 | 25 | 26 | 13 | 26 | 13 | ||||
| Стадия | 0.60 | <0.05 | 0.154 | 0.48 | ||||||||
| I–II | 41 | 16 | 16 | 41 | 33 | 24 | 36 | 21 | ||||
| III–IV | 22 | 6 | 14 | 14 | 21 | 7 | 20 | 8 | ||||
| Размер опухоли | 0.60 | 0.63 | 0.34 | 0.63 | ||||||||
| T1-T2 | 8 | 19 | 8 | 19 | 15 | 12 | 19 | 8 | ||||
| T3-T4 | 14 | 44 | 22 | 36 | 39 | 19 | 37 | 21 | ||||
| N | 0.40 | 0.20 | 0.13 | 0.44 | ||||||||
| N0 | 44 | 18 | 19 | 43 | 36 | 26 | 39 | 23 | ||||
| N+ | 19 | 4 | 11 | 12 | 18 | 5 | 17 | 6 | ||||
| M | 0.49 | 0.10 | 0.52 | 0.21 | ||||||||
| M0 | 55 | 18 | 23 | 50 | 45 | 28 | 46 | 27 | ||||
| M+ | 8 | 4 | 7 | 5 | 9 | 3 | 10 | 2 | ||||
| Дифферен- цировка опухоли | 0.78 | 0.20 | 0.44 | >0.99 | ||||||||
| G1 | 15 | 6 | 19 | 43 | 15 | 6 | 14 | 7 | ||||
| G2/3 | 48 | 16 | 11 | 12 | 39 | 25 | 42 | 22 | ||||
| Локализа-ция опухоли | >0.99 | 0.81 | 0.82 | 0.49 | ||||||||
| прямая кишка | 23 | 8 | 10 | 21 | 19 | 12 | 22 | 9 | ||||
| слепая и ободочная кишка | 40 | 14 | 20 | 34 | 35 | 19 | 34 | 20 | ||||
Нами выявлено, что только содержание PD-L1+ клеток в строме опухолей ассоциировано со стадией КРР. На начальных I-II стадиях заболевания чаще наблюдали высокую инфильтрацию стромы опухоли PD-L1+ клетками по сравнению с поздними III-IV стадиями.
Корреляционные связи между растворимыми и тканевыми формами PD1, PD-L1 и IDO1. Провели корреляционный анализ экспрессии исследуемых белков с помощью определения коэффициента ранговой корреляции Спирмена. Результаты представлены на рис. 3.
Рис. 3.
Корреляционный анализ между экспрессией растворимых и тканевых форм PD-1, PD-L1 и IDO1 (коэффициент корреляции Спирмена).
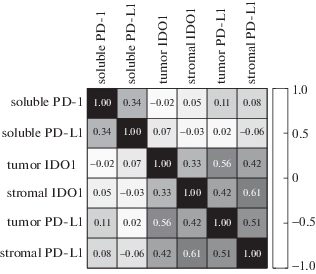
Показано, что растворимые формы исследованных белков (sPD-1 и sPD-L1) статистически значимо коррелировали между собой (r = 0.34; p = 0.001). Также была выявлена корреляционная связь между экспрессией IDO1 в опухолевых клетках и клетках стромы (r = 0.33; p = 0.002) и PD-L1 в опухолевых клетках и строме (0.51; p < 0.001).
Кроме того, обнаружена корреляционная зависимость между количеством PD-L1 и IDO1 в опухолевых клетках (r = 0.56; p < 0.001) и в строме (r = 0.61; p < 0.001). Статистически значимых корреляционных зависимостей между концентрациями sPD-1, sPD-L1 в сыворотке крови больных КРР и уровнями экспрессии этих маркеров в первичной опухоли не было выявлено. Полученные данные указывают на необходимость дополнительных исследований с целью подтверждения возможности использования исследованных маркеров для диагностических целей.
ИСТОЧНИК ФИНАНСИРОВАНИЯИсследование выполнено при финансовой поддержке Российского Фонда Фундаментальных Исследований, проект 20-015-00479.
Список литературы
Keir M.E., Butte M.J., Freeman G.J., et al. PD-1 and its ligands in tolerance and immunity // Annu Rev Immunol. 2008. V. 26. P. 677–704.
Latchman Y., Wood C.R., Chernova T., et al. PD-L2 is a second ligand for PD-1 and inhibits T cell activation // Nat Immunol. 2001. V. 2. № 3. P. 261–8.
Sun C., Mezzadra R., Schumacher T.N. Regulation and Function of the PD-L1 Checkpoint // Immunity. 2018. V. 48. № 3. P. 434–452.
Platten M., Wick W., Van den Eynde B.J. Tryptophan catabolism in cancer: beyond IDO and tryptophan depletion // Cancer Res. 2012. V. 72. № 21. P. 5435–40.
Wang R., Green D.R. Metabolic reprogramming and metabolic dependency in T cells // Immunol Rev. 2012. V. 249. № 1. P. 14–26.
Zhai L., Ladomersky E., Lenzen A. et al. IDO1 in cancer: a Gemini of immune checkpoints // Cell Mol Immunol. 2018. V. 15. № 5. P. 447–457.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


