Доклады Российской академии наук. Науки о жизни, 2021, T. 498, № 1, стр. 233-240
ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ ДЛИТЕЛЬНОСТИ ФЛУОРЕСЦЕНЦИИ ТРИПТОФАНА КАК ПОКАЗАТЕЛЬ ДИНАМИКИ ЕГО МИКРООКРУЖЕНИЯ
В. В. Горохов 1, *, Б. Н. Корватовский 1, П. П. Нокс 1, Н. П. Гришанова 1, С. Н. Горячев 1, В. З. Пащенко 1, член-корреспондент РАН А. Б. Рубин 1
1 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: Gorokhgiceron149@gmail.com
Поступила в редакцию 08.12.2020
После доработки 29.01.2021
Принята к публикации 05.02.2021
Аннотация
Исследованы спектрально-кинетические характеристики флуоресценции молекулы триптофана в водном растворе и в составе белка (альбумин) в диапазоне температур от –170 до 25°C. Для объяснения наблюдаемых изменений в спектрах и длительности флуоресценции триптофана от температуры использована модель переходов между возбужденным и основным состояниями с привлечением состояния с переносом заряда, которая учитывает нелинейный характер динамики этих переходов. В данных процессах важную роль играют взаимодействие молекул триптофана с его микроокружением, а также перестройки в системе водородных связей водно-белковой матрицы, окружающей молекулу триптофана.
Изучение влияния температуры на активность функциональных белков давно является одним из важнейших подходов для выяснения физико-химических механизмов их работы [1]. Для исследования внутримолекулярной конформационной динамики белков, тесно связанной с их функциональной активностью, в качестве природного внутреннего индикатора широко используется флуоресценция триптофановых остатков в составе белков. Источником информации о характере внутримолекулярной динамики ближайшего окружения возбужденной молекулы триптофана (Trp), в том числе о роли водородных связей в этом окружении, являются зависимости от температуры спектров и длительности флуоресценции Trp в воде и в составе белка [2–5]. Роль водородных связей как в структурно-динамическом устройстве белков в целом, так и в определении ими спектрально-кинетических характеристик внутренних триптофанилов в частности, до настоящего времени остается актуальной темой исследований [1, 5]. Кинетика затухания флуоресценции Trp в растворе, а также в составе пептидов и белков многокомпонентна. В зависимости от типа растворителя, pH, наблюдают 2–3 компоненты кинетики флуоресценции триптофана с временами от сотен пикосекунд до ~10 нс. В белках также регистрируют 2–3-компонентную кинетику флуоресценции Trp в аналогичном временном интервале [5–9].
Время жизни возбужденных электронных состояний при разных температурах во многом обусловлено процессом переноса электрона с индольного кольца возбужденной молекулы Trp на амидные группы основного скелета молекулы либо в систему водородных связей (Н-связей), образованную между молекулами Trp и их окружением [10]. В последнем случае перенос электрона сопровождается образованием состояния с переносом заряда (Charge Transition State, CTS) [9]. Сольватация возбужденных молекул за счет взаимодействия с ближайшим окружением может индуцировать сдвиги их спектров поглощения и флуоресценции в зависимости от температуры [5, 11].
В работе [12] методом квазиупругого рассеяния нейтронов определены три основных температурных области, определяющих динамику протонов водородных связей в водно-белковой среде. В области I (T < –150°C) происходят чисто гармонические колебания протонов около равновесных положений, в области II (–150°C ≤ ≤ T < –30°C) динамика водно-белковой среды характеризуется скачкобразной диффузией протонов вдоль Н-связей в пикосекундном диапазоне. В температурной области III (T > –30°C) динамика водно-белковой среды определяется более медленными масштабными движениями крупных молекулярных фрагментов [12].
В водном растворе Trp в температурной области III формируется стабильный цвиттерионный комплекс Н-связей молекулы Trp с водным окружением [13]. В белке вокруг образовавшегося цвиттерионного комплекса формируется водная оболочка с частично упорядоченными Н-связями за счет их взаимодействия с полярными группами пептидных связей Trp [12, 13]. В электронно-возбужденном состоянии молекулы Trp может происходить дополнительное упорядочивание Н-связей за счет увеличения их жесткости [13]. В результате в достаточно упорядоченной системе Н-связей может образоваться квазизона проводимости, в которой электрон, находящийся на индольном кольце возбужденной молекулы Trp, делокализуется и затем может перейти на N–H группы пептидных связей с образованием CTS [13]. Данный эффект возможен при достаточно низких температурах, причем скорость переноса электрона от индольного кольца Trp* в систему водородных связей должна увеличиваться при понижении температуры. При высоких температурах за счет тепловых колебаний молекул квазизона проводимости разрушается, а перенос электрона с индольных колец на амидные группы будет проходить по термоактивационному механизму. В температурной области II возможно также дополнительное упорядочивание Н-связей аналогично структурному фазовому переходу в сегнетоэлектрических кристаллах с Н-связями типа сегнетовой соли [14]. Этот процесс может происходить при таких низких температурах, когда взаимодействие диполей Н-связей молекул воды достаточно велико для их взаимного упорядочивания, но энергия теплового движения еще слишком мала, чтобы вызвать их разупорядочивание. В результате этого происходит диффузионный перескок протонов по Н-связям [12], что приводит к образованию суммарного дипольного момента в окрестности Trp*, электрическое поле которого вызывает эффект дополнительной сольватации возбужденной молекулы Trp. В результате за счет кулоновского взаимодействия Trp* с диполями Н-связей происходит сильный красный сдвиг спектра флуоресценции в водном растворе.
Ранее мы исследовали температурную зависимость флуоресценции триптофана в разных растворителях и рассмотрели возможность использования состояния с переносом заряда для описания процессов дезактивации возбужденного состояния молекулы Trp [9]. В настоящей работе разработана адекватная физическая модель переходов молекулы Trp между возбужденным и основным состояниями с привлечением состояния с переносом заряда. Именно включение CTS в процесс дезактивации приводит к возникновению нелинейной динамики этих переходов. Для подтверждения модели были детально изучены температурные зависимости многокомпонентного свечения молекул Trp в водном растворе и в составе белка (бычий сывороточный альбумин), также приготовленного в водном растворе. При этом особый акцент сделан на выяснение роли динамики водородных связей ближайшего окружения триптофана, а также на изучение особенностей спектральных и кинетических характеристик его флуоресценции в широком диапазоне изменений температуры.
Согласно схеме электронных переходов в молекуле Trp, показанной на рис. 1, кинетика затухания флуоресценции Trp имеет двухкомпонентный характер.
Рис. 1.
Модельная схема кинетических переходов в триптофане. n1, n2 – населенности возбужденного состояния молекул Trp и состояния с переносом заряда, Trp+R– – состояние с переносом заряда (CTS), где R может обозначать как систему водородных связей в окружении молекулы Trp, так и амидные группы с электрон-акцепторными свойствами, связанные с Trp, kR1 – константа скорости затухания возбужденного состояния Trp, включающая флуоресценцию (kf1) и безызлучательную релаксацию (kr1): $~{\text{Trp*}}\mathop \to \limits^{{{k}_{{R1}}}} {{{\text{S}}}_{0}}$, (kR1 = kf1 + kr1), k12 – скорость перехода Trp* в состояние CTS; k21 – скорость рекомбинации CTS → Trp*, kR2 – скорость затухания CTS за счет флуоресценции и безызлучательной релаксации (${\text{CTS}}\mathop \to \limits^{{{k}_{{R2}}}} {{{\text{S}}}_{0}},~$ kR2 = kf2 + kr2); ΔG – разность уровней свободной энергии состояний Trp* и CTS, Er – энергия реорганизации образования CTS. Горизонтальными штрихованными линиями показаны некоторые колебательные уровни основного и возбужденных состояний Trp.
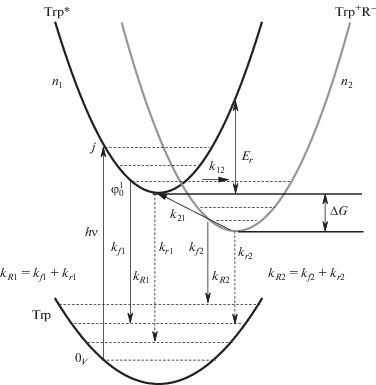
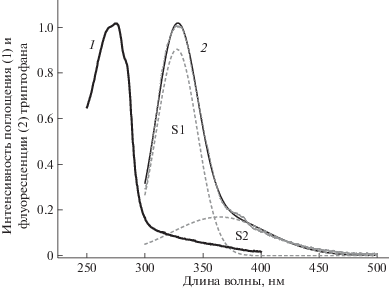
Дезактивация возбужденного состояния триптофана происходит по двум каналам – с испусканием флуоресценции (kf1) и безызлучательной релаксацией (kr1) в основное состояние ${\text{S*}}\mathop \to \limits^{{{k}_{{R1}}}} {{{\text{S}}}_{0}}$, (kR1 = kf1 + kr1), а также с переходом в промежуточное состояние (состояние с переносом заряда, CTS) Trp* → Trp+R– со скоростью k12, рекомбинирующего затем со скоростью k21 обратно в ${\text{S*}}$ состояние: ${\text{S*}}\mathop \to \limits^{{{k}_{{12}}}} {\text{CTS}}\mathop \to \limits^{{{k}_{{21}}}} {\text{S*}}\mathop \to \limits^{{{k}_{{R1}}}} {{{\text{S}}}_{0}}$. Согласно [13], помимо обратного перехода в S* состояние распад CTS также может происходить с испусканием флуоресценции и безызлучательной релаксацией в основное состояние (${\text{CTS}}\mathop \to \limits^{{{k}_{{R2}}}} {{{\text{S}}}_{0}}$) (kR2 = kf2 + kr2). Двухкомпонентное свечение Trp* характеризуется двумя спектральными формами S1 и S2, присутствующими в разложении спектра флуоресценции с различными временами жизни (рис. 2). Мы предполагаем, что форма S1 в спектре флуоресценции Trp соответствует излучательному переходу S* состояния в основное состояние, тогда как компонента S2 соответствует излучательному переходу CTS в основное состояние. Из рис. 2 видно, что форма S2 спектра флуоресценции уширена по сравнению с S1, что может быть связано с увеличенной скоростью дезактивации CTS за счет большей скорости безызлучательной релаксации kr2. Спектр поглощения Trp в водном растворе, рис. 2, имеет длинное широкое крыло в красной области. Как показано в [16], возникновение свечения в красной области спектра может быть связано с прямым переходом возбужденной молекулы триптофана в CTS .
Рис. 2.
Спектры поглощения (1) и флуоресценции (2) триптофана в водном растворе при комнатной температуре. Приведено разложение спектра флуоресценции Trp на две гауссовы компоненты (формы) S1 и S2.
Мы детально исследовали кинетики затухания флуоресценции Trp в воде и в составе альбумина в водном растворе в диапазоне температур от –170 до 25°С. Кинетики затухания флуоресценции измеряли с помощью установки с коррелированным по времени и длине волны счетом единичных фотонов PML-16 (Becker and Hickl, Германия). Установка снабжена 16-канальным мультианодным фотоумножителем Hamamatsu R5900, содержащим 16 раздельных выходных анодных элементов и общую катодную и динодную систему. Сигнал флуоресценции проходит через полихроматор, снабженный дифракционной решеткой 600 штрихов/мм, обеспечивающей спектральную полосу измерительной системы 200 нм с разрешением 12.5 нм/канал. Это позволяет регистрировать трехмерную картину флуоресценции, отражающую изменения длительности (τ), спектра (λ) и интенсивности (I) свечения. Флуоресценцию образца возбуждали при 280 нм с помощью пикосекундного полупроводникового диода EPLED 280 (“Edinburg Photonics”, Шотландия), длительность импульса составляла 870 пс, спектральная ширина – 10 нм, частота следования импульсов – 10 МГц, время накопления сигнала – 30 с. Таким образом, регистрируя трехмерное (t, λ, I) изображение свечения триптофанилов, мы могли измерять кинетики затухания флуоресценции для любого спектрального канала в области 286–423 нм. Кроме того, система регистрации позволяла воспроизвести спектры флуоресценции образца в любой момент времени после его возбуждения импульсом света. Образец при измерениях находился в охлаждаемой жидким азотом кювете, температуру которой контролировали с помощью термопары. Время охлаждения до –180°C составляло ~10 мин, скорость последующего нагревания – 5–7 град/мин.
Аппроксимацию кинетических кривых суммой экспонент, свернутых с аппаратной функцией системы регистрации, проводили с учетом того, что дезактивация Trp* протекает с образованием промежуточного состояния с переносом заряда Trp+R– (CTS). Составив и решив систему дифференциальных уравнений, описывающих переходы в молекуле Trp (рис. 1), мы получили выражения для населенностей n1 и n2, констант скоростей затухания компонент k1, k2 и, соответственно, длительности τ1 и τ2 двух компонент разложения в кинетике затухания флуоресценции. Эти выражения имеют вид:
(1)
$\left\{ \begin{gathered} {{k}_{1}} = \frac{1}{2}({{g}_{1}} + {{g}_{{2{\text{\;}}}}} + \sqrt {{{{({{g}_{1}} - {{g}_{2}})}}^{2}} + 4{{k}_{{12}}}{{k}_{{21}}}} ) \hfill \\ {{k}_{2}} = \frac{1}{2}({{g}_{1}} + {{g}_{{2{\text{\;}}}}} - \sqrt {{{{({{g}_{1}} - {{g}_{2}})}}^{2}} + 4{{k}_{{12}}}{{k}_{{21}}}} ) \hfill \\ \end{gathered} \right.$Для a1, a2, b1, b2 выражения имеют следующий вид:
Из данных выражений следует, что a1 + a2 =1; b2 = –b1.
Обозначения параметров в уравнении (1) указаны в подписи к рис. 1.
Согласно уравнениям (1), если в некоторой области температур значение τ1= 1/k1 уменьшается за счет увеличения в (1) подкоренного выражения, то значение τ2 в этой же области будет увеличиваться. Это должно приводить к антибатному характеру температурных зависимостей длительности короткой и длинной компонент кинетики флуоресценции Trp в водном растворе в данной температурной области.
Ход экспериментальной температурной зависимости длительности τ1 и τ2 для двух компонент в кинетике флуоресценции Trp в водном растворе показан на рис. 3а. Видно, что температурные зависимости времен затухания короткой и длинной компонент флуоресценции τ1 и τ2 имеют немонотонный характер: в частности, в области температуры около –90°C наблюдается максимум τ1 и минимум τ2. Из рис. 3б видно, что температурная зависимость константы скорости перехода k12 в области T < –125°С носит безактивационный характер: с увеличением температуры k12 уменьшается пропорционально величине 1/$\sqrt {{{T}_{K}}} $, где TK – абсолютная температура. Для Trp в водной среде образование квазизоны проводимости системы Н-связей может происходить уже при температуре T < –125°C, что приводит к безактивационному переносу электрона на амидные группы по системе Н-связей. Наоборот, при T > –90°C с ростом температуры происходит термоактивацион-ное увеличение константы скорости k12. Адекватная аппроксимация экспериментальной температурной зависимости k12 во всей исследованной области температур обеспечивается при условии зависимости свободной энергии перехода ΔG от температуры в области –125°С...–50°С (рис. 3б).
Рис. 3.
(а) – температурная зависимость τ1 быстрого (1) и τ2 медленного (2) компонентов кинетики затухания флуоресценции триптофана в водном растворе; (б) температурная зависимость констант скорости k12 образования состояния с переносом заряда Trp* → Trp+R– (1) и k21 обратного перехода Trp+R– → Trp* в возбужденное состояние триптофана (2); (3) – температурная зависимость ΔG(T) для триптофана в водном растворе; (4) – температурная зависимость скорости сольватационного сдвига Δλm(T)/ΔT спектра флуоресценции триптофана в водном растворе; (в) – температурная зависимость τ1 быстрого (1) и τ2 медленного (2) компонентов кинетики затухания флуоресценции триптофана в составе альбумина; (г) – температурная зависимость констант скорости k12 образования состояния с переносом заряда Trp* → Trp+R–(1) и k21 обратного перехода Trp+R– →Trp* в возбужденное состояние триптофана в составе альбумина (2). (3) – температурная зависимость ΔG(T) для триптофана в составе альбумина; (4) – температурная зависимость скорости сольватационного сдвига спектра флуоресценции Δλm(T)/ΔT триптофана в альбумине. Сплошные линии на (а), (б), (в), (г) получены в результате аппроксимации температурных зависимостей времен затухания τ1, τ2 и констант скорости k12, k21.
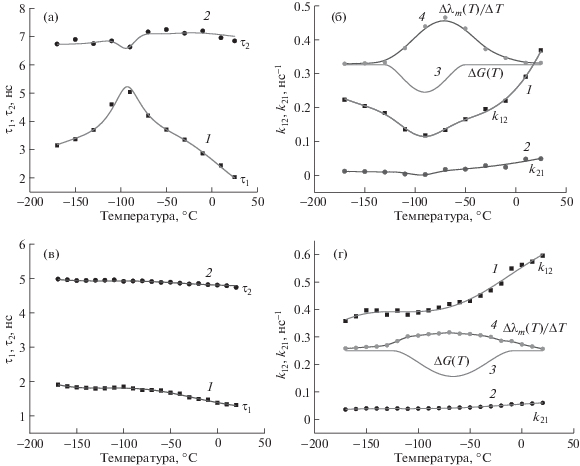
В области температур Т > –125°С реализуется другой, термоактивационный механизм переноса электрона в сетку Н-связей, когда происходит размораживание и перестройка упорядоченных Н-связей. В результате взаимодействия электрического поля возникающего дипольного момента системы элементарных ячеек Н-связей с электрическим полем возбужденной молекулы Trp происходит ее дополнительная сольватация.
Этот эффект приводит к уменьшению свободной энергии перехода ΔG(T) в данной области температур (рис. 3, кривая 3) и одновременно к соответствующему сдвигу максимума флуоресценции Trp в длинноволновую область (рис. 3б, кривая 4). Как видно из рис. 3б, 3г, в температурных областях –125°C < T < –50°C для раствора Trp в воде и в области температур –25°C < T < –10°C для триптофана в альбумине, также растворенного в воде, происходит некоторое уменьшение константы скорости k12 переноса электрона. Для Trp в растворе возникает минимум значения k12 (–90°C) (рис. 3б, кривая 1), максимум величины τ1 (–93°C) (рис. 3а, кривая 1), а также минимум значения τ2 (–93°C) (рис. 3а, кривая 2) в ходе температурных зависимостей величин этих параметров. Одновременно наблюдается антибатное поведение температурных зависимостей значений τ1 и τ2 для Trp в водном растворе (рис. 3а). Для альбумина в воде минимум параметра k12 и соответствующий максимум τ1 не наблюдаются из-за меньшей величины дополнительного сольватационного сдвига ΔG(T) (рис. 3г, кривая 4). Как для Trp в воде при T > –50°C, так и в водном растворе альбумина при T > –10°C за счет тепловых флуктуаций происходит частичное разупорядочивание системы водородных связей, что приводит к исчезновению эффекта уменьшения ΔG (рис. 3б, 3г, кривые 3). При этом согласно термоактивационному механизму переноса электрона скорость переноса электрона k12 в этой области увеличивается с ростом температуры (рис. 3б, 3г, кривые 1).
Температурная зависимость константы скорости k21 (рис 3б, 3г, кривые 2) хорошо аппроксимируется соотношением Аррениуса: k21= k12exp(–ΔG/kBTK), где kB – постоянная Больцмана, TK – абсолютная температура.
Максимальное уменьшение величины ΔG(T) в диапазонах температур от –125 до –50°C для Trp в воде (рис. 3б) и от –125 до –10°C для водного раствора альбумина (рис. 3г) происходит за счет кулоновского взаимодействия диполей Н-связей с возбужденным состоянием Trp. Оно достигает максимального значения около 60 см–1 для триптофана в водном растворе и около 25 см–1 для альбумина (рис. 3б, 3г).
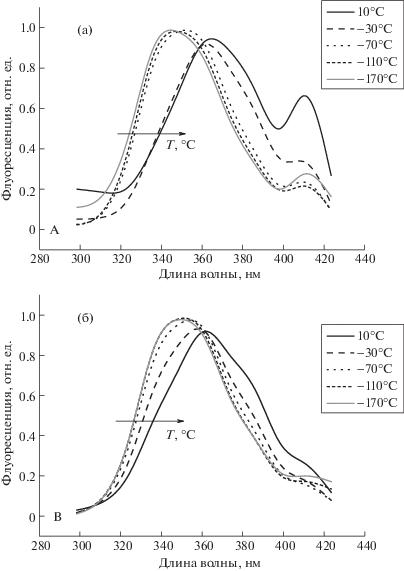
Для водного раствора триптофана в составе альбумина в температурной области T < –100°C безактивационный перенос электрона не наблюдается (рис. 3в, 3г). Причиной этому служит недостаточное упорядочивание системы Н-связей при замораживании. Как следствие, не происходит образования квазипроводящей зоны между индольным кольцом и амидными группами. Соответственно, наблюдаемый эффект сольватации возбужденного состояния в альбумине в два раза более слабый. Этот вывод прямо подтверждается тем, что “красный” сдвиг спектров флуоресценции в исследованной температурной области примерно в два раза меньше, чем для триптофана в воде (рис. 4а и 4б, рис. 3б и 3г, кривые 4). Мы считаем, что обнаруженное различие в спектрах флуоресценции объясняется бóльшим расстоянием системы Н-связей от молекулы Trp, фиксированной в белковой структуре по сравнению с молекулой Trp в водном растворе. На возможность такого эффекта указывалось, например, в [5].
Рис. 4.
Спектры флуоресценции триптофана в водном растворе (а) и в составе альбумина (б), полученные при импульсном лазерном возбуждении при температуре от –170 до 20°C. Стрелкой показано направление сольватационного сдвига спектров от низкой температуры (–170°C) до комнатной (20°C).
Таким образом, полученные результаты подтверждают существенное влияние состояния водородных связей на микроконформационную динамику белка, тестируемую с помощью флуоресцентных характеристик (форма и положение спектра, длительность свечения) молекулы триптофана. Необходимая информация о механизмах протекающих при этом процессов может быть получена путем сравнительного анализа температурных зависимостей параметров флуоресценции триптофана в воде и в нативном белке. Все эти результаты имеют принципиальное значение для физической интерпретации получаемых в эксперименте данных о зависимости функциональной активности белка от деталей его структурно-динамического состояния.
Список литературы
Rubin A.B. // Fundamentals of biophysics. 1st ed, Wiley-Scrivener; 2014.
Dashnau J.L., Zelent B., Vanderkooi J.M. // Biophys. Chem. 2005. V. 114. P. 71–83.
Schlamadinger D.E., Gable J.E., Kim J.E. // J. Phys. Chem. B. 2009. V. 113. P. 14769–14778.
Reshetnyak Y.K., Burstein E.A. // Biophys. J. 2001. V. 81. P. 1710–1734.
Lakowicz J.R. // Principles of fluorescence spectroscopy. 3nd ed., Springer. New York. 2006.
Szabo A.G., Rayner D.M. // J. Am. Chem. Soc. 1980. V. 102. P. 554–563.
Adams P.D., Chen Y., Ma K. et al. // J. Am. Chem. Soc. 2002. V. 124. P. 9278–9286.
Ross J.A., Jameson D.M. // Photochem. Photobiol. Sci. 2008. V. 7. P. 1301–1312.
Knox P.P., Gorokhov V.V., Korvatovsky B.N. et al. // J. Photochem. Photobiol. A: Chemistry. 2020. V. 393. P. 112435.
Han K.L., Zhao G.J. Hydrogen Bonding and Transfer in the Excited State. John Wiley & Sons Ltd. Chichester. UK. 2011.
Knox P.P., Lukashev E.P., Gorokhov V.V. et al. // J. Photochem. Photobiol. B: Biology. 2018. V. 189. P. 145–151.
Doster W., Settles M. // Biochim. et Biophys. Acta. 2005. V. 1749. P. 173–186.
Liu H., Zhang H., Jin B. // Spectrochim. Acta Part A: Molecular and Biomolecular Spectroscop. 2013. V. 106. P. 54–59.
Blinc R., Zeks B. // Soft Modes in Ferroelectrics and Antiferroelectrics. American Elsevier Publishing Company. Inc. New York. 1974.
Vandewal K. // Annu. Rev. Phys. Chem. 2016. V. 67. P. 113–146.
Renger Th. // Phys. Rev. Lett. 2004. V. 93. P. 188101–188104.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


