Доклады Российской академии наук. Науки о жизни, 2021, T. 499, № 1, стр. 354-359
УНИВЕРСАЛЬНЫЙ СТРЕССОВЫЙ БЕЛОК GRUSP ВОВЛЕЧЕН В ГИББЕРЕЛЛИН-ЗАВИСИМУЮ ИНДУКЦИЮ ЦВЕТЕНИЯ РАСТЕНИЙ Arabidopsis thaliana
Д. С. Горшкова 1, 2, И. А. Гетман 1, Л. И. Сергеева 1, 3, член-корреспондент РАН Вл. В. Кузнецов 1, 2, Е. С. Пожидаева 1, *
1 Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
2 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
3 Вагенингенский университет и Исследовательский центр
Вагенинген, Нидерланды
* E-mail: alenapoj@mail.ru
Поступила в редакцию 23.12.2020
После доработки 05.04.2021
Принята к публикации 08.04.2021
Аннотация
Исследовано влияние инсерции Т-ДНК в 3'-UTR область гена At3g58450 Arabidopsis thaliana, кодирующего универсальный стрессовый белок GRUSP (Germination-Related Universal Stress Protein). Установлено, что данная мутация замедляет переход трансгенной линии grusp-115 к цветению на длинном дне из-за сниженного содержания эндогенных биоактивных гиббереллинов ГК1 и ГК3 по сравнению с растениями дикого типа Col-0. Экзогенные ГК ускоряли цветение растений обеих линий, однако не изменяли временную разницу наступления цветения между Col-0 и grusp-115. Помимо изменений в метаболизме ГК, у grusp-115, очевидно, имеются нарушения процессов реализации сигнала, индуцирующего цветение. Это подтверждается результатами экспрессии генов флорального интегратора FLOWERING LOCUS T (FT) и флорального репрессора FLOWERING LOCUS C (FLC), являющихся ключевыми регуляторами цветения и действующими разнонаправленно. Мы предполагаем, что на формирование фенотипа grusp-115 также может влиять низкий уровень экспрессии FT, обусловленный повышенной экспрессией FLC.
Переход к репродуктивной фазе является важнейшим этапом в онтогенезе цветковых растений. У растения длинного дня (ДД) Arabidopsis thaliana (L.) Heynh ключевыми фитогормонами, контролирующими индукцию цветения, являются гиббереллины (ГК) [1], которые строго необходимы и в условиях короткого дня (КД) [2]. На ДД гиббереллины вовлекаются в индукцию цветения опосредованно через регуляцию экспрессии и функционирования основных флоральных интеграторов фотопериодического пути цветения FLOWERING LOCUS T (FT) и SOC1. Накопление ГК в листьях приводит к деградации транскрипционных репрессоров группы DELLA и индуцирует транскрипцию гена FT [3, 4] за счет активации транскрипционных факторов CO и SPL [5]. В апикальной меристеме ГК-зависимая деградация DELLA-белков приводит к активации экспрессии LEAFY и SOC1, что, в свою очередь, обеспечивает переход к цветению [6].
Помимо гиббереллинов, важная роль в зацветании принадлежит абсцизовой кислоте (АБК). В зависимости от условий произрастания и физиологического состояния растения воздействие АБК способно как ускорять, так и задерживать переход от вегетативной стадии онтогенеза к репродуктивной [7]. В основе задержки цветения растений в условиях ДД лежит функционирование АБК-зависимых транскрипционных факторов ABI4 и ABI5 [8, 9]. ABI4 ингибирует переход к цветению, подавляя биосинтез ГК и стимулируя экспрессию флорального репрессора FLOWERING LOCUS C (FLC) [8–10]. Дополнительный вклад в активацию FLC вносят DELLA-белки, обеспечивая тем самым тесную взаимосвязь с ГК-зависимыми ответами [11].
Универсальный стрессовый белок GRUSP (Germination-Related Universal Stress Protein), кодируемый геном At3g58450 A. thaliana [12, 13], является потенциальным участником механизмов, контролирующих баланс между АБК и ГК на разных стадиях развития растения. Экспрессия At3g58450 значительно возрастает в проростках Col-0, обработанных АБК, а нарушение его транскрипции приводит к АБК–гиперчувствительности трансгенных семян grusp-115 [12].
Цель данного исследования заключается в том, чтобы впервые изучить взаимосвязь позднецветущего фенотипа трансгенной линии grusp-115, характеризующейся пониженной экспрессией гена At3g58450 из-за вставки Т-ДНК в его 3’-UTR область, с содержанием эндогенных гиббереллинов и экспрессией генов, контролирующих переход растения к репродуктивному развитию.
В исследовании использовали растения дикого типа A. thaliana (L.) Heynh экотипа Columbia (Col-0) и гомозиготной трансгенной линии GABI_kat 115C08 (grusp-115) [12]. Растения выращивали в почве в климатической камере с 16-часовым фотопериодом при интенсивности освещения 100 мкE м–2 с–1 и температуре +21°С.
Развитие растений Col-0 и grusp-115 анализировали в соответствии со шкалой стадий роста, которая используется для идентификации и интерпретации фенотипических различий и определения конкретных стадий роста у A. thaliana так, как описано ранее [14]. Индикатором наступления генеративной стадии является появление головки соцветия в розетке растения. Время цветения выражено в количестве дней после стратификации или количестве розеточных листьев на момент появления цветочной почки.
Содержание активных ГК определяли в 10 мг лиофилизированных образцов, полученных из розеточных листьев 4-недельных растений Col-0 и grusp-115 [15]. Из исследований, основанных на использовании изотопов, известно, что обработка экзогенными ГК приводит к эффективному поглощению ГК листьями и к их последующему транспорту в апексы побегов в биологически активной форме [16]. В связи с чем реакцию растений на экзогенные ГК изучали с использованием 100 мкМ водного раствора ГК4 + 7 (“Sigma”, США). Для этого проростки, начиная с возраста 14 дней, дважды в неделю в течение 12 нед опрыскивали раствором ГК в присутствии 0.02% (v/v) Твин-20. Контрольные растения опрыскивали раствором, содержавшим только 0.2% (v/v) Твин-20.
Уровни транскриптов генов FLC (At5g10140) и FT (At1g65480) оценивали методом ПЦР в режиме реального времени (qRT-PCR) так, как было описано ранее [13]. Для амплификации фрагментов генов использовали пары праймеров: FLC 5'–AAAGTAGCCGACAAGTCACC–3' и 5'-GGATGCGTCACAGAGAACAG–3'; FT 5'–GCCAGAACTTCAACACTCGC–3' и 5ʹ-AGCCACTCTCCCTCTGACAA–3'. Эксперименты проводили в 3-кратной биологической повторности. Достоверность различий проверяли при помощи критерия Стьюдента (t-критерий).
Установлено, что задержка прорастания трансгенных семян grusp-115 является результатом изменений в экспрессии генов метаболизма ГК, в том числе генов биосинтеза, GA20ox1 и GA3ox1 [13]. Снижение интенсивности экспрессии генов биосинтеза ГК также может быть причиной и более длительной стадии вегетативного роста, наблюдаемой у grusp-115 (рис. 1а).
Рис.1.
Характеристика растений Col-0 и grusp-115 в условиях роста на длинном дне: а – диаграмма развития растений согласно Бойес (Boyes) [14]. Цифрами обозначена группа растений, чей возраст соответствует (1) – 23, (2) – 34 и (3) – 42 дням роста после стратификации, и у которых были собраны образцы розеточных листьев для анализа содержания транскриптов генов FT и FLC методом qRT-PCR; б – внешний вид (1) – 23, (2) – 34 и (3) – 42- дневных растений.
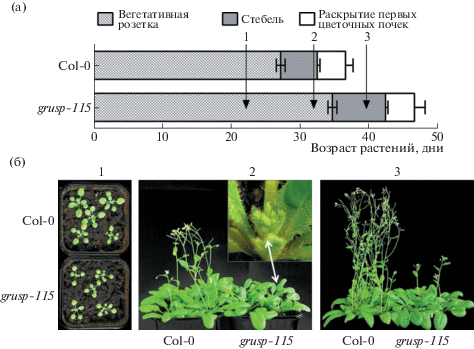
У Col-0 через 28–30 дней после стратификации сформировалась хорошо видимая головка соцветия, в то время как у grusp-115 наблюдалась задержка формирования соцветия до 35 дней. Более того, удлинение стебля у Col-0 началось через 3–5 дней после появления цветочной почки, в то время как у grusp-115 этого не происходило, и головка соцветия дольше сохранялась внутри листьев розетки (рис. 1б; номер 2 – растения 35-дневного возраста). Полноразмерные побеги с цветками и стручками сформировались у 45-дневных растений Col-0, в то время как grusp-115 в этом возрасте находился на стадии удлинения побега и раскрытия первых цветочных почек (рис. 1б, номер 3–45-дневные растения). Таким образом, временная разница между Col-0 и grusp-115 составила 10 дней с момента образования соцветия и удлинения побега. Впоследствии grusp-115 сформировал полукарликовый побег со стручками, измененными по длине и форме, с небольшим количеством семян (рис. 1б). Полноценные побеги с развитыми стручками развились только через 50–55 дней.
На ДД как минимум два фактора могут играть ключевую роль при переходе растения от вегетативной стадии развития к генеративной: фотопериодизм и гиббереллины [4]. При этом фотопериодический путь играет основную роль в индукции цветения, а ГК выполняют вспомогательную функцию [4].
Наши результаты демонстрируют, что позднее зацветание grusp-115, вероятно, связано со сниженным содержанием биологически активных ГК1 и ГК3 (рис. 2) и может быть устранено обработкой растений экзогенными ГК (рис. 3). Важным параметром роста и развития A. thaliana является количество розеточных листьев [2, 14]. В условиях ДД Col-0 формирует 10–14 розеточных листьев, после чего апикальная меристема побега перестраивается в меристему соцветия [14]. В нашем исследовании растения Col-0 сформировали в среднем по 11 розеточных листьев за период вегетативного роста, в то время как grusp-115 переходили к цветению только при наличии 14 листьев (рис. 3а). Обработка растений экзогенными ГК ускоряла переход к репродуктивной стадии Col-0, который наблюдался при наличии у растений не 11, а лишь 9 листьев. Растения grusp-115 реагировали на обработку ГК сходным образом (рис. 3б). Они зацветали так же, как Col-0, после формирования 9 розеточных листьев (рис. 3а). Таким образом, отставание в переходе к цветению, выраженное в количестве розеточных листьев, полностью устранялось у grusp-115 при обработке экзогенными гиббереллинами. ГК-зависимое восстановление позднецветущего фенотипа grusp-115 до фенотипа Col-0 подтверждает идею о том, что трансгенная линия испытывает дефицит эндогенных ГК (рис. 2). В то же время обработка ГК grusp-115 не устраняла более поздний (на 10 дней) переход к цветению трансгенной линии по сравнению с Col-0 (рис. 3а).
Рис. 2.
Содержание биоактивных гиббереллинов ГК1 и ГК3 в тканях 4-недельных вегетативных розеток растений Col-0 и grusp-115. Звездочкой обозначены статистически достоверные различия между Col-0 и grusp-115 согласно критерию Стьюдента (* – p < 0.1).
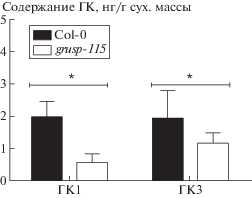
Рис. 3.
Реакция растений Col-0 и grusp-115 на обработку 100 мкМ раствором экзогенных гиббереллинов ГК4+7: а – время цветения растений, выраженное в количестве дней после стратификации и количестве розеточных листьев на момент появления цветочной почки в розетке; б – фенотип растений до и после обработки ГК через 42 дня роста. Звездочками обозначены статистически достоверные различия между Col-0 и grusp-115 согласно критерию Стьюдента (** – p < 0.05).

Для поиска других возможных причин временного отставания перехода к цветению линии grusp-115 от Col-0 был проанализирован уровень экспрессии ключевых флоральных генов FT и FLC в розетках двух сравниваемых линий на разных стадиях развития растений (рис. 4). Для этого использовали розеточные листья растений 23-, 34- и 42-дневного возраста, обозначенные под номерами 1, 2, и 3 соответственно. Ген FT экспрессировался на низком уровне в листьях любого возраста (рис. 4), но с максимальной интенсивностью в возрасте 42 дней (3), что соответствует цветущему растению со сформированными соцветиями (рис. 1б). Растения grusp-115 демонстрировали сниженный уровень экспрессии гена FT как на стадии вегетативного роста в возрасте 23 дней (1), так и на стадии перехода к цветению в возрасте 42 дней (рис. 4; (3)).
Рис. 4.
Относительный уровень экспрессии генов FT и FLC в розеточных листьях растений Col-0 и grusp-115. Образцы отбирали на разных стадиях роста растений, соответствующих их возрасту в 23 (1), 34 (2) и 42 (3) дня после стратификации. Звездочками обозначены статистически достоверные различия между Col-0 и grusp-115 согласно критерию Стьюдента (* – p < 0.1, ** – p < 0.05).

Репрессор цветения FLC, подавляющий экспрессию ряда флоральных генов, в том числе и FT, тормозит переход к генеративной стадии развития [6]. На рис. 4 видно, что уровень экспрессии гена FLC выше у grusp-115 на всех изученных стадиях роста (1–3; рис. 1а), чем у Col-0. Эта разница максимальна в возрасте 34 дней (2), когда растения Col-0 уже находятся на стадии формирования побегов соцветия, а grusp-115 все еще находятся в вегетативном состоянии. Более того, уровень транскриптов FLC повышен у grusp-115 даже после появления бутонов (3), что объясняет у него пониженную экспрессию гена FT.
Таким образом, мы впервые показали, что в основе более позднего перехода к цветению Т-ДНК инсерционной трансгенной линии grusp-115 A. thaliana по сравнению с диким типом является низкое содержание биологически активных эндогенных ГК1 и ГК3, а также слабая экспрессия гена FT из-за повышенного накопления флорального репрессора FLC. Мы предполагаем, что белок GRUSP является новым регуляторным компонентом в сигнальных путях, обеспечивающих переход к цветению.
Список литературы
Kinoshita A., Richter R. Genetic and molecular basis of floral induction in Arabidopsis thaliana // Journal of Experimental Botany. 2020. V. 71. № 9. P. 2490–2504.
Wilson R.N., Heckman J.W., Somerville C.R. Gibberellin is required for flowering in Arabidopsis thaliana under short days // Plant Physiology. 1992. V. 100. P. 403–408.
Galvão V.C., Horrer D., Küttner F., et al. Spatial control of flowering by DELLA proteins in Arabidopsis thaliana // Development. 2012. V. 139. P. 4072–4082.
Porri A., Torti S., Romera-Branchat M., et al. Spatially distinct regulatory roles for gibberellins in the promotion of flowering of Arabidopsis under long photoperiods // Development. 2012. V. 139. P. 2198–2209.
Wang H., Pan J., Li Y., et al. The DELLA-CONSTANS transcription factor cascade integrates gibberellic acid and photoperiod signaling to regulate flowering // Plant Physiology. 2016. V. 172. P. 479–488.
Moon J., Lee H., Kim M., et al. Analysis of flowering pathway integrators in Arabidopsis // Plant Cell Physiology. 2005. V. 46. № 2. P. 292–299.
Shu K., Luo X., Meng Y., et al. Toward a molecular understanding of abscisic acid actions in floral transition // Plant Cell Physiology. 2018. V. 59. № 2. P. 215–221.
Wang Y., Li L., Ye T., et al. The inhibitory effect of ABA on floral transition is mediated by ABI5 in Arabidopsis // Journal of Experimental Botany. 2013. V. 64. № 2. P. 675–684.
Shu K., Chen Q., Wu Y., et al. ABI4 mediates antagonistic effects of abscisic acid and gibberellins at transcript and protein levels // The Plant Journal. 2016. V. 85. P. 348–361.
Shu K., Chen Q., Wu Y., et al. ABSCISIC ACID-INSENSITIVE 4 negatively regulates flowering through directly promoting Arabidopsis FLOWERING LOCUS C transcription // Journal of Experimental Botany. 2016. V. 67. № 1. P. 195–205.
Li M., An F., Li W., et al. DELLA proteins interact with FLC to repress flowering transition // Journal of Integrative Plant Biology. 2016. V. 58. P. 642–655.
Горшкова Д.С., Гетман И.А., Воронков А.С., и др. Ген универсального стрессового белка AtUSP регулируется фитогормонами и вовлекается в прорастание семян Arabidopsis thaliana // Доклады Академии Наук. 2018. Т. 479. № 5. С. 578–581.
Gorshkova D.S., Pojidaeva E.S. Members of the Universal Stress Protein family are indirectly involved in gibberellin-dependent regulation of germination and post-germinated growth // Russian Journal of Plant Physiology. 2021. V. 68. № 3. P. 451–462.
Boyes D.C., Zayed A.M., Ascenzi R., et al. Growth stage-based phenotypic analysis of Arabidopsis: a model for high throughput functional genomics in plants // Plant Cell. 2001. Vol. 13. № 7. P. 1499–1510.
Kolachevskaya O.O., Sergeeva L.I., Floková K. et al. Auxin synthesis gene tms1 driven by tuber-specific promoter alters hormonal status of transgenic potato plants and their responses to exogenous phytohormones // Plant Cell Rep. 2017. V. 36. P. 419–435.
Eriksson S., Böhlenius H., Moritz T., et al. GA4 is the active gibberellin in the regulation of LEAFY transcription and Arabidopsis floral initiation // The Plant Cell. 2006. V. 18. P. 2172–2181.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


