Доклады Российской академии наук. Науки о жизни, 2021, T. 499, № 1, стр. 364-369
ВЛИЯНИЕ ГИПОХЛОРИТ- И ПЕРОКСИД-ИНДУЦИРОВАННОГО ОКИСЛЕНИЯ ФИБРИНОГЕНА НА СТРУКТУРУ ФИБРИНА
Л. В. Юрина 1, *, А. Д. Васильева 1, Л. А. Вассерман 1, Н. А. Подоплелова 2, 3, член-корреспондент РАН М. А. Пантелеев 2, 3, М. А. Розенфельд 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Центр теоретических проблем физико-химической фармакологии Российской академии наук
Москва, Россия
3 Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии
им. Дмитрия Рогачева
Москва, Россия
* E-mail: lyu.yurina@gmail.com
Поступила в редакцию 29.12.2020
После доработки 11.04.2021
Принята к публикации 12.04.2021
Аннотация
Впервые методами динамического и упругого светорассеяния, а также конфокальной лазерной сканирующей микроскопии исследовались нарушения пространственной структуры фибрина при пероксид- и гипохлорит индуцированном окислении фибриногена. В то время как перекись водорода оказывала слабый эффект на структурную организацию фибрина, действие гипохлорита вызывало образование аномального фибрина с тонкими волокнами и мелкопористой структурой. Измерения распределения по размерам нативного и окисленного ФГ обнаружили уменьшение гидродинамического размера молекулы ФГ при увеличении концентрации окислителей. Это свидетельствовало о росте гидрофобности поверхности белка и снижении его коллоидной устойчивости. В работе анализируется возможная роль окислительных сайтов в сборке аномального по структуре фибрина.
Образование фибринового сгустка, являющееся одним из важнейших процессов свертывания крови, включает катализируемую тромбином генерацию молекул мономерного фибрина из фибриногена и последующую их спонтанную полимеризацию, в результате которой формируется сеть произвольно ориентированных стержнеподобных волокон фибрина.
Фибриноген (ФГ) представляет собой высоко уязвимую потенциальную мишень для окислителей [1], вследствие чего посттрансляционные модификации ФГ, возникающие как in vitro при индуцированном окислении, так и in vivo при развитии окислительного стресса, способны вызывать нарушение пространственной организации фибрина, его вязко-эластических и биохимических свойств. Морфология такого фибрина характеризуется преимущественно тонкими волокнами, обладающими уменьшенной механической прочностью, мелкопористой структурой, что, в конечном итоге, обусловливает возрастающую резистентность фибриновой сети к фибринолизу [2, 3]. Эти данные легли в основу концепции взаимосвязи между окислительным стрессом, нарушениями структуры фибрина и риском возникновения кардиоваскулярных заболеваний [4, 5].
Полагают, что доминирующий вклад в нарушение пространственной организации окисленного фибрина вносит окислительная модификация метионина АαMet476, локализованного в αC-доменах ФГ [3]. Окисление этого остатка, как полагают [3], ослабляет взаимодействия между соседними αC-доменами, играющими важную роль в латеральной агрегации фибриновых протофибрилл. Однако образование аномального, “грубого” фибрина, образованного из озонированного ФГ, не подтверждает этот вывод [6, 7].
Ранее методом масс-спектрометрии было показано, что гипохлорит-индуцированное окисление ФГ вызывает в белке множественные модификации, затрагивающие широкий набор аминокислотных остатков [8, 9], в то время как пероксид-индуцированное окисление ФГ ограничивалось лишь модификациями некоторых остатков Met, Trp и His [10].
В настоящей работе совокупностью методов упругого и динамического светорассеяния, а также конфокальной микроскопии исследуется влияние гипохлорит- и пероксид-индуцированного окисления ФГ на архитектуру образующегося фибрина и анализируется возможная природа такого влияния.
ФГ был выделен из цитратной плазмы крови доноров методом глицинового осаждения. Окисление ФГ индуцировали либо раствором H2O2 (Sigma-Aldrich, США), либо гипохлоритом (Sigma-Aldrich, США) в концентрациях 25, 50 и 300 мкМ/2.94 мкМ белка соответственно. Реакции протекали в течение часа при температуре 37°C, после чего останавливались 10-молярным избытком L-метионина [3]. Удаление метионина из раствора проводили центрифугированием с помощью фильтров Amicon Ultra (10 kDa, UFC501096, Merck, Darmstadt, Germany).
Реакция превращения ФГ в фибрин, катализируемая тромбином, проводилась в микропланшетах при 37°C в течение 60 мин [10]. Кинетику реакции регистрировали на xMark™ Microplate Absorbance Spectrophotometer (США) при длине волны 350 нм.
Метод динамического светорассеяния был использован для получения распределения молекул ФГ по размерам. Измерения проводили на приборе Zetasizer-Nano S (Malvern, Англия). Для каждого образца были выполнены три независимых измерения, каждое из которых включало три технические повторности (30 сканов для каждого измерения).
Угловые зависимости упругого светорассеяния образцов фибрина были получены на cпектрометре Malvern (Англия) с гелий-неоновым лазером (длина волны лазера λo = 632.8), как описано ранее [11]. Анализ экспериментальных данных осуществлялся в рамках приближения Carr и Hermans [12] для ансамблей длинных, произвольно ориентированных стержневидных макромолекул. Данные были получены на основании трех независимых экспериментов, каждый из которых имел три технические повторности.
Для ковалентного мечения молекул белка в качестве флуоресцентной метки использовали флуоресцеин изотиоционат (ФИТЦ). Молярное отношение краски к белку в реакционной смеси MR = 5. Реакцию проводили в 0.1 М бикарбонатным буфером (pH 9.0) в течение 2 ч (+4°C) при постоянном перемешивании. После чего останавливали реакцию получасовой инкубацией с 30 мМ гидроксиламингидрохлоридом (pH 8.5). Для очистки конъюгата от непрореагировавшей флуоресцентной метки реакционную смесь центрифугировали в течение 1 мин при 16 000 g на микроцентрифужных колонках с Sephadex G-25. Степень мечения и концентрацию белка контролировали спектрофотометрически. Для образования фибринового геля смесь (9:1) немеченого и меченого фибриногена (конечная концентрация белка 3 мкМ), хлорид кальция (конечная концентрация 5 мM) и тромбин (конечная концентрация 5 нM) поочередно вносили в реакционную лунку на предметном стекле. Общий объем раствора составлял 30 мкл. После внесения реагентов лунку накрывали покровным стеклом и инкубировали в течение часа при +37°С во влажной камере и исследовали сразу после окончания инкубации. Для получения микрофотографий использовали микроскоп Zeiss Axio Observer Z1 с конфокальным модулем CSU-X1M 5000 (Carl Zeiss, Jena, Germany), снабженный объективом со 100-кратным увеличением.
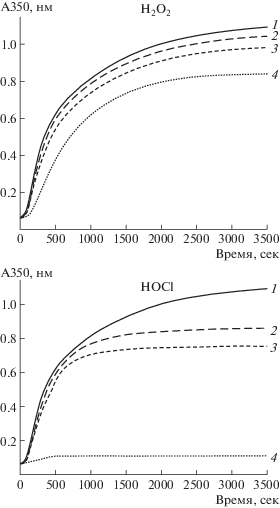
Исследование кинетики реакции превращения ФГ в фибрин под действием тромбина показало, что окисление ФГ гипохлоритом вызывает существенное ингибирование реакции и снижение мутности геля, но имеет относительно слабый эффект на сборку фибрина при использовании перекиси водорода (рис. 1).
Рис. 1.
Кинетика образования фибрина, образованного из окисленного ФГ: 1 – неокисленный ФГ; 2, 3, 4 – ФГ, окисленный 25, 50 и 300 мкМ гипохлорита или такими же количествами перекиси водорода.
Данные динамического светорассеяния (рис. 2) выявили интересную особенность действия окислителей на молекулы фибриногена. Как видно из рис. 2, при концентрациях HOCl/–OCl, 25 и 50 мкМ распределение молекул по размерам оставалось унимодальным. Однако средний размер молекул фибриногена незначительно уменьшался с 22.92 ± 1.12 нм для нативного фибриногена, до 21.45 ± 1.02 и 20.64 ± 1.02 нм при инкубации белка с 25 и 50 мкМ HOCl/–OCl соответственно. Для фибриногена, обработанного 300 мкМ HOCl/–OCl, средний размер молекул фибриногена составлял 17.97 ± 1.08 нм. Однако при этом можно наблюдать едва визуально различимое появление относительно высокоразмерных кластеров фибриногена со средним размером ~36 нм. При обработке фибриногена 25 и 50 мкМ H2O2 распределение молекул по размерам, также как и в случае гипохлорита, было одномодальным со средними размерами молекул фибриногена, равными 21.5 ± 0.82 и 22.26 ± 0,90 нм соответственно. При окислении фибриногена 300 мкМ H2O2 распределение молекул по размерам становилось бимодальным, характеризующееся средними размерами, равными 15.26 ± 1.76 и 28.54 ± 1.60 нм соответственно.
Рис. 2.
Распределение по размерам молекул ФГ, окисленных 25, 50 и 300 мкМ гипохлорита или такими же количествами перекиси водорода.

Выраженное бимодальное распределение по размерам фибриногена, обработанного H2O2 (рис. 2), можно объяснить следующими причинами. Изменение молекулярного распределения по размерам наблюдается в результате изменения гидратации молекул фибриногена. Подобно другим белкам [13], окисление остатков метионина в фибриногене, вызванное H2O2, вызывает увеличение гидрофобности поверхности белка, которое обусловливает уменьшение степени гидратации молекул. С увеличением концентрации H2O2 этот эффект также усиливается. При обработке фибриногена 300 мкМ низкоразмерные молекулы (т.е. поверхность которых обладает наибольшей гидрофобностью) агрегируют с образованием кластеров большей размерности.
Как было показано ранее методом масс-спектрометрии высокого разрешения (ВЭЖХ-МС/МС) [10], окисление фибриногена, вызванное 300 мкМ H2O2, происходит в основном за счет модификации остатков метионина (18 остатков), наряду с четырьмя остатками Trp и двумя остатками His. Окисление только этих остатков, как мы полагаем, обеспечивает описанный выше механизм снижения коллоидной стабильности молекул фибриногена, обработанных H2O2. В отличие от H2O2, HOCl/–OCl является мощным окислителем. При обработке фибриногена HOCl/–OCl наряду с вышеупомянутыми остатками многие другие аминокислотные остатки, такие как Tyr, His, Ser, Asp, Asn, Lys, Pro, Trp, Phe , Arg и Glu были идентифицированы [8, 9]. В этой связи можно предположить, что участие этих остатков в окислительной модификации в той или иной степени нейтрализует влияние окисления метионинов на возрастающую гидрофобность поверхности фибриногена. По этой причине, в отличие от пероксида водорода, действие HOCl/–OCl вызывает незначительный эффект на образование высокоразмерных кластеров.
Угловые зависимости отношения Рэлея, R(θ) для нормального и окисленного гелей фибрина, как видно из рис. 3, представляют собой прямые линии, проходящие через начало координат. Согласно теории рассеяния света [12], в случае фибринового геля, который можно рассматривать как сеть прямых волокон разной длины, соединенных вместе в некоторых случайно распределенных узловых точках, отношение Рэлея описывается следующим выражением: R(θ) = cKλ0μ/4n0sin(θ/2), где c – концентрация белка, μ = M/L – отношение массы к длине волокна, выраженное в г/(моль см), и n0 – коэффициент преломления растворителя. K – константа для вертикально поляризованного луча, равная 4π2$n_{0}^{2}$ (dn/dc)2/(NA$\lambda _{0}^{4}$), где NA – число Авогадро, n0 – показатель преломления растворителя, dn/dc – инкремент показателя преломления, равный 0.176 см3/г. Вышеприведенная формула позволяет рассчитать значения μ по наклону прямых линий. В случае полимеров фибрина, образованных из нативного фибриногена, это значение составляет (8.25 ± 0.47) × 1012 г/(моль см), (рис. 3, прямая 1). Так как молекула ФГ может быть аппроксимирована палочкой длиной 45 нм при диаметре ~ 2–5 нм [14], величина μ для ФГ составляет 7.55 × 1010 г/(моль см). Из этого следует, что в условиях модельного эксперимента нативная фибриновая сеть составлена из нитей, толщина которых более чем в сто раз превышает таковую, характерную для ФГ. Обработка ФГ гипохлоритом вызывает значительные структурные нарушения в фибрине, проявляющиеся в образовании существенно более тонких фибрилл, по сравнению с контролем (рис. 3, прямые 2 и 3). Величины μ составляли (6.32 ± 0.37) × 1012 и (3.09 ± ± 0.23) × 1012 г/(моль см) для фибрина, образованного из ФГ, окисленного 25 и 50 мкМ гипохлорита соответственно. В то же время окисление ФГ перекисью водорода практически не влияло на толщину фибрилл. Как следует из рис. 3, прямые 4, 5 в пределах статистической погрешности отношение массы к длине окисленных фибрилл оказалось равным таковому для неокисленного фибрина. Слабый эффект пероксид-индуцированного окисления ФГ на структуру фибрина был также выявлен методом атомно-силовой микроскопии [15].
Рис. 3.
Угловые зависимости упругого светорассеяния фибрина, образованного из нативного ФГ (1); ФГ, окисленного 25 и 50 мкМ гипохлорита (2, 3 соответственно) и ФГ, окисленного 25 и 50 мкМ перекиси водорода (4, 5 соответственно). Для наглядности прямые 4 и 5 смещены вверх по ординате на 1.5 и 1.8 ед. соответственно.

Результаты упругого светорассеяния хорошо согласуются с морфологией фибрина, полученного конфокальной микроскопией (рис. 4). В фибрине, образованном из пероксид-индуцированного ФГ, изменения в структуре незначительны, в то время как в образцах, представленных на рис. 4, отчетливо видно наличие тонких фибрилл и мелкопористой структуры фибрина при обработке ФГ 50 мкМ гипохлорита.
Рис. 4.
Конфокальная лазерная сканирующая микроскопия различных образцов фибрина. Длина отрезка на фотографиях соответствует 10 мкм.

Посттрансляционные модификации в первичной структуре молекулы ФГ при ее окислении и последствия этих модификаций для вторичной и третичной структуры белка [11], очевидно, проявляются в изменении коагуляционного потенциала ФГ формировать нормальную структуру фибрина. Как полагают [3], модификация остатка АαMet476 в αC-доменах благодаря повреждению структуры N-концевых субдоменов нарушает их способность взаимодействовать друг с другом, обусловливая тем самым ингибирование латеральной агрегации фибриновых протофибрилл. Однако вовлечение в модификацию вышеупомянутого остатка во всех случаях при обработке ФГ озоном, гипохлоритом и перекисью водорода и наблюдаемые различные эффекты на самосборку фибрина являются достаточно веским основанием полагать об ошибочной точке зрения, касающейся функциональной роли метионина АαMet476. Если к этому добавить, что метионин АαMet476 является одним из наиболее уязвимых к окислению остатком по сравнению с другими метионинами в ФГ, можно прийти к выводу, что он выполняет антиоксидантную функцию, как постулировалось ранее [10].
Как свидетельствуют результаты данной работы, воздействие умеренных количеств Н2О2 на ФГ не сопровождается значимым эффектом на структуру фибрина. В свою очередь, это подразумевает, что обнаруженные модификации в ФГ в результате пероксид-индуцированного окисления [10] не играют особой функциональной роли в образовании фибрина. Функционально важные остатки могли бы располагаться в ряду модифицированных сайтов, идентифицированных в ФГ при его озонировании или обработке гипохлоритом за исключением тех модифицированных сайтов, которые были обнаружены в пероксид-индуцированном фибриногене. Кроме того, так как озонирование ФГ или его обработка гипохлоритом вызывала образование грубых [6] или тонких гелей [3], соответственно, необходимо исключить из рассмотрения общие окислительные сайты для обоих окислителей в модифицированном белке. Однако и в этом случае функциональная принадлежность сайтов осложняется главным образом двумя факторами. Во-первых, при использовании метода масс-спектрометрии для картирования первичной структуры окисленного (также как и не окисленного) ФГ отдельные сайты или даже пептидные участки, представляющие мишень для окислителей, могут оказываться не детектированными. Во-вторых, латеральная ассоциация протофибрилл обусловлена участием различных структур ФГ, а не только взаимодействием αC-доменов. В процесс сборки фибрилл вовлекаются также С-концевые субдомены и αC–коннекторы, C-концевые участки γ-цепей, соседние участки β-цепей (β-nodules), суперспиральные структуры (coiled-coils) и некоторые другие [14]. Во всех этих структурах ФГ найдены окислительные сайты, которые могли бы влиять в той или иной степени на латеральную агрегацию [6–10]. Однако какие из этих сайтов могли бы вносить преобладающий вклад в окислительное повреждение структуры фибрина, все еще представляется достаточно неопределенным. В этой связи приписывание отдельным окислительным сайтам конкретных функциональных свойств в образовании аномальной структуры фибрина остается сложной и запутанной проблемой, решение которой может быть предметом будущих исследований.
Список литературы
Shacter E., Williams J., Lim M., et al. Differential susceptibility of plasma proteins to oxidative modification: examination by western blot immunoassay. // Free Radic. Biol. Med. 1994. V. 17. P. 429–437.
Martinez M., Weisel J.W., Ischiropoulos H. Functional impact of oxidative posttranslational modifications on fibrinogen and fibrin clots // Free Radic Biol Med. 2013. V. 65. P. 411–418.
Weigandt K.M., White N., Chung D., et al. Fibrin clot structure and mechanics associated with specific oxidation of methionine residues in fibrinogen // Biophys. J. 2012. V. 103. № 11. P. 2399–2407.
Li W., Sigley J., Pieters M., et al. Fibrin fiber stiffness is strongly affected by fiber diameter, but not by fibrinogen glycation // Biophys. J. 2016. V. 110. № 6. P. 1400–1410.
Kattula S., Byrnes J.R., Wolberg A.S. Fibrinogen and fibrin in hemostasis and thrombosis // Arterioscler. Thromb. Vasc. Biol. 2017. V. 37. № 3. P. 13–21.
Розенфельд М.А., Леонова В.Б., Константинова М.Л., и др. Самосборка мономерного фибрина и агрегация фибриногена при окислении озоном // Биохимия. 2009. Т. 74. С. 54–61
Yurina L.V., Vasilyeva A.D, Indeykina M.I.et al. Ozone-induced damage of fibrinogen molecules: identification of oxidation sites by high-resolution mass spectrometry // Free Radic. Res. 2019. V. 53. № 4. P. 430–455.
Юрина Л.В., Васильева А.Д., Бугрова А.Е., и др. Индуцированная гипохлоритом окислительная модификация фибриногена // Доклады академии наук. 2019. Т. 484. № 3. С. 367–371.
Sovová Ž., Štikarová J., Kaufmanová J., et al. Impact of posttranslational modifications on atomistic structure of fibrinogen // PLoS One 2020. V. 15. № 1. P. 0227543.
Юрина Л.В., Васильева А.Д., Кононенко В.Л., и др. Структурно-функциональные повреждения фибриногена в результате пероксид-индуцированного окисления // Доклады Российской академии наук. Науки о жизни. 2020. Т. 492. № 1. С. 287–292.
Rosenfeld M., Shchegolikhin A., Bychkova F., et al. Ozone-induced oxidative modification of fibrinogen: role of the D regions // Free Radic. Biol. Med. 2014. V. 77. P. 106–120.
Carr M.E., Jr., Hermans J. Size and density of fibrin fibers from turbidity // Macromolecules 1978. V. 11. № 1. P. 46–50.
Chao C.C., Ma Y.S., Stadtman E.R. Modification of protein surface hydrophobicity and methionine oxidation by oxidative systems. // Proc. Natl. Acad. Sci. USA 1997. V. 9. P. 2969–2974.
Weisel J.W., Litvinov R.I. Fibrin formation, structure and properties // Subcell Biochem. 2017. V. 82. P. 405–456.
Wang L., Li L., Wang H., Liu J. Study on the influence of oxidative stress on the fibrillization of fibrinogen // Biochem J. 2016. V. 473. № 25. P. 4373–4384.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


