Доклады Российской академии наук. Науки о жизни, 2021, T. 499, № 1, стр. 370-374
ИЗМЕНЕНИЯ ВРЕМЕННОЙ ОБЛАСТИ ВАРИАБЕЛЬНОСТИ СЕРДЕЧНОГО РИТМА И КОРТИКОСТЕРОНА ПОСЛЕ ХИРУРГИЧЕСКОЙ ТРАВМАТИЗАЦИИ ПЕРЕГОРОДКИ НОСА У КРЫС
И. В. Кастыро 1, *, В. И. Попадюк 1, академик РАН И. В. Решетов 2, М. Г. Костяева 1, С. Г. Драгунова 1, Т. Ф. Косырева 1, Г. В. Хамидулин 1, П. Е. Шмаевский 1
1 ФГАОУ ВО Российский университет дружбы народов
Москва, Россия
2 ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет)
Москва, Россия
* E-mail: ikastyro@gmail.com
Поступила в редакцию 08.04.2021
После доработки 12.04.2021
Принята к публикации 16.04.2021
Аннотация
Целью настоящей работы было изучить изменения во временном диапазоне вариабельности сердечного ритма (ВСР) на фоне изменений концентрации кортикостерона в плазме крови у крыс после хирургической травматизации перегородки носа. Было проведено моделирование септопластики у 30 половозрелых крыс-самцов линии Wistar массой 210–290 г. Проводилась запись ЭКГ с последующим анализом временной области ВСР, а также забор крови на изменения концентрации кортикостерона в плазме крови. В результате было установлено, что SDNN достоверно увеличилось, по сравнению с контролем, на 2-е и 3-и сутки (p < 0.001), но снизилось на 4–5-й (p < 0.001) и 6-й дни (p < 0.01). rMSSD изменялся волнообразно с двумя неравномерными пиками на 1-й и 6-й дни. SDNN/rMSSD, по сравнению с 1-м днем послеоперационного периода, на 2-й день увеличилось и продолжило расти (p < 0.05), а на 4-й день начало снижаться (p < 0.01). Общая мощность ВСР была низкой на всем сроке постоперационного периода (p < 0.001), кроме 3-го дня, когда она была равна контрольным данным. Рост показателя общей мощности пришелся на 3-й день после операции (p < 0.01), после чего произошел вновь его спад. Концентрация кортикостерона в плазме крови у крыс была достоверно выше, чем до нее (p < 0.001). Со 2-го по 4-й постоперационный день было определено его плато. Моделирование септопластики ведет к изменениям во временном диапазоне ВСР, увеличению концентрации кортикостерона в плазме крови у крыс с ее максимумом в момент операции и через 24 ч, образованием “плато” со 2-го по 4-й постоперационные дни, что совпадает с изменениями ВСР.
ВВЕДЕНИЕ
Наиболее распространенным хирургическим вмешательством по поводу искривления перегородки носа до сих пор остается септопластика [1, 2], которая может проводиться под местной или общей анестезией [3]. Ранее на биологических моделях нами было показано, что моделирование септопластики приводит к развитию тревожно-подобного состояния вследствие отека слизистой оболочки полости носа, воспалительных явлений [4] и развития дисбаланса со стороны вегетативной нервной системы (ВНС) [5], что проявляется в изменении поведения крыс в открытом поле. Было также показано, что при этом изменяются показатели частотного диапазона вариабельности сердечного ритма (ВСР), которые характеризовали смещение ВНС в сторону симпатикотонии [5]. Данные физиологические явления были подкреплены результатами морфологических исследований гиппокампа у крыс. Так, после провокации хирургического воспаления на перегородке носа увеличивается количество темных нейронов и p53-позитивных нейронов [6, 7].
Некоторые параметры временного диапазона ВСР также могут характеризовать ответ организма на стрессовые воздействия, описывая баланс вегетативной нервной системы. Так, SDNN отражает преимущественно степень ваготонии [8], RMSSD также характеризует активность парасимпатического отдела ВНС [9], а отношение SDNN к rMSSD может характеризовать вагосимпатическое равновесие [10]. В настоящее время не вполне достаточно данных, описывающих баланс вегетативной нервной системы при помощи параметров временного диапазона ВСР после хирургической травматизации перегородки носа.
При воздействии повреждающих факторов активируются симпатическая нервная система и гипоталамо-гипофизарно-надпочечниковая ось и выделяются гормоны и цитокины, облегчающие способность организма справляться со стрессором [11]. Изучение особенностей физиологических стрессовых реакций на биологических объектах при моделировании хирургических вмешательств на перегородке носа обусловливается важностью минимизации развития стрессовых реакций и болевого синдрома у пациентов [12].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить изменения во временном диапазоне вариабельности сердечного ритма и концентрации кортикостерона в плазме крови у крыс после хирургической травматизации перегородки носа.
МАТЕРИАЛЫ И МЕТОДЫ
Хирургическая травматизация под общим обезболиванием раствором золетила 100 была проведена у 30 половозрелых крыс-самцов линии Wistar массой 210–290 г (рис. 1).
Эксперименты с животными были одобрены биоэтическим комитетом ФГАОУ ВО Первого Московского государственного медицинского университета им. И.М. Сеченова, протокол заседания № 6 от 16.02.2021. В день операции до травмы и в течение первых 6 дней после нее проводили контрольную запись ЭКГ в течение 15 мин на исследовательском полиграфе Biopac M30-B (California, USA). При этом крысы находились в свободном состоянии. Записи ЭКГ обрабатывали программе Biopack student lab 4.1. Средняя длина обрабатываемых отрезков ЭКГ составила 115 ± 22 с. Для анализа временного диапазона ВСР интервалы ЭКГ без артефактов обрабатывали в программе Kubios HRV, откуда получали значения следующих величин: стандартное отклонение R-R-интервалов (SDNN, мс2) между нормальными комплексами QRS, квадратный корень из суммы квадратов разности величин последовательных пар нормальных R-R-интервалов (rMSSD, мс2), отношение SDNN/rMSSD и общую силу (Total power, мс2). Для анализа плазмы крови на концентрацию кортикостерона у крыс проводился забор крови после проведения записи ЭКГ из хвостовой вены до операции, в момент операции, через 1–6 сут после операции. Полученную незамедлительно кровь центрифугировали и образцы хранили при –20° C до момента анализа. Концентрацию кортикостерона в плазме (нг/мл) определяли количественно с помощью ELISA, используя набор для иммуноферментного анализа кортикостерона (Assay Designs Inc., Ann Arbor, Mich., США). Данные обрабатывались в программном обеспечении Microsoft Exel, MATLAB, STATISTICA 12.6, JASP 0.14.0.0. При сопоставлении данных группы до и после операции применялся критерий Вилкоксона. Для каждого сравнения определялся свой уровень значимости (р < от 0.001 до 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
По сравнению с контролем, SDNN достоверно увеличилось на 2-е и 3-и сутки после моделирования септопластики (p < 0.001), но снизилось на 4–5-й (p < 0.001) и 6-й дни (p < 0.01). На 2–3-й дни постоперационного периода произошло достоверное снижение SDNN, по сравнению с 1-м днем (p < 0.01). Однако на 4–6-й дни произошло его достоверное снижение (p < 0.001), по сравнению с предыдущим периодом наблюдения (рис. 2а). RMSSD, по сравнению с контрольными данными, через сутки после операции достоверно увеличился (p < 0.01), но на 2–5-е (p < 0.001) и 6-е (p < 0.01) сутки он был достоверно ниже нормы. Динамика изменений rMSSD имела волнообразный характер с двумя неравномерными пиками на 1-й и 6-й дни (рис. 2б) септопластики (p < 0.001). По сравнению с 1-м днем послеоперационного периода, на 2-й день отметился рост отношения STDNN/rMSSD (p < 0.001). На третий день оно также продолжило расти (p < 0.05), на 4-й день снизилось (p < 0.01), по сравнению с предыдущими сутками, и продолжило достоверно снижаться только на 6-й день после операции (p < 0.05) (рис. 2в). Оценка общей мощности ВСР показала, что моделирование септопластики привело к ее достоверному снижению на всем сроке постоперационного периода (p < 0.001), кроме 3-го дня, когда достоверной разницы, по сравнению с контролем, выявлено не было. Рост показателя общей мощности пришелся на 3-й день после операции (p < 0.01), после чего произошел вновь его спад (p < 0.01) (рис. 2г).
Рис. 2.
Изменения ВСР после моделирования септопластики во временном спектре: а –стандартное отклонение R-R- интервалов (SDNN) между нормальными комплексами QRS; б – rMSSD (квадратный корень из суммы квадратов разности величин последовательных пар нормальных R-R-интервалов); в – отношение SDNN/rMSSD; г – общая мощность. Примечание: * – достоверное различие между дооперационными данными (контроль) и данными после операции при p < 0.001; • – достоверное различие между дооперационными данными (контроль) и данными после операции при p < 0.01; † – достоверное различие между сроками наблюдения после операции при p < 0.001; ○ – достоверное различие между сроками наблюдения после операции при p < 0.01; ◊ – достоверное различие между сроками наблюдения после операции при p < 0.05.

При этом на 4-й день было зафиксировано его минимальное среднее значение за весь период наблюдения после моделирования септопластики. SDNN/rMSSD, по сравнению с дооперационными величинами, было достоверно выше на 2–5-й дни (p < 0.001), а значимо ниже – через день после моделирования.
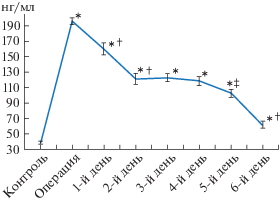
Согласно критерию Вилкоксона, в момент моделирования септопластики и на всем постоперационном периоде концентрация кортикостерона в плазме крови у крыс была достоверно выше, чем до нее (p < 0.001). Максимальный уровень гормона коркового вещества надпочечников был отмечен в момент проведения самой операции, через сутки его концентрация значимо снизилась (p < 0.001), а со 2-го по 4-й постоперационный день было определено его плато (рис. 3). Но с 5-го дня концентрация кортикостерона в плазме крови у крыс продолжила снижаться (p < 0.01).
Рис. 3.
Динамика изменений концентрации кортикостерона в плазме крови у крыс до и после проведения моделирования септопластики. Примечание: * – достоверные различия между дооперационными данными (контроль) и данными после операции при p < 0.001; † – достоверное различие между сроками наблюдения после операции при p < 0.001; $ \pm |$ – достоверное различие между сроками наблюдения после операции при p < 0.01
ОБСУЖДЕНИЕ
Считается, что SDNN является мерой общей мощности ВСР и чувствителен как к симпатической, так и к парасимпатической импульсации, однако, он в большей степени отражает парасимпатический тонус [8]. Низкая общая ВСР, определяемая низкими значениями SDNN, отражает снижение парасимпатической и/или повышение симпатической активности [13]. Так, ранее было показано, что повышение значений SDNN соответствовало высокой активности блуждающего нерва [14].
RMSSD характеризует активность парасимпатического отдела ВНС [9]. В нашем исследовании наибольшие значения rMSSD наблюдались через 1 сут после операции, что можно объяснить нарушением нормальных адаптивных процессов, так как в условиях стресса в нормальных превалирует тонус симпатической нервной системы наряду с активацией гипоталамо-гипофизарно-надпочечниковой оси [11]. Данные результаты согласуются с падением общей мощности ВСР в первые два дня после операции, что также может свидетельствовать о срыве адаптивных реакций в ответ на повреждение перегородки носа и последующей сенсорной депривации периферического отдела обонятельного анализатора [4].
Отношение SDNN к rMSSD может характеризовать вагосимпатическое равновесие [10]. Так, более высокий SDNN/rMSSD, к примеру при фибромиалгии, по сравнению со здоровыми людьми, характеризует сдвиг баланса ВНС в сторону симпатического компонента, что согласуется с другими исследованиями [15]. Снижение SDNN/rMSSD подтверждает мысль о том, что в первые сутки после моделирования септопластики у крыс развиваются реакции дизадаптации, которые проявляются повышением активности парасимпатической нервной системы на фоне роста кортикостерона, а также снижением активности крыс в открытом поле [5], а в последующий постоперационный период ответная реакция организма на хирургический стресс характеризуется повышением активности симпатической нервной системы с ростом общей мощности в период 2–4 сут, с пиком на третий день, что совпадает с максимальными изменениями цитоархитектоники пирамидного слоя гиппокампа практически во всех его субполях [6, 7], а также с формированием “плато” на графике концентрации кортикостерона (рис. 3).
В настоящем исследовании увеличение rMSSD и снижение SDNN/rMSSD не соответствовали изменениям SDNN как показателя тонуса парасимпатической нервной системы. Показанные изменения SDNN отражали влияние в том числе и симпатикотонии. Так, снижение уровня SDNN и снижение концентрации кортикостерона в крови у крыс в первый день после операции свидетельствовали о снижении тонуса симпатического отдела ВНС [16], первый пик которого, судя по данным кортикостерона, пришелся на день операции, повышение SDNN на 2–3-й дни и снижение уровня кортикостерона с формированием “плато” могли соответствовать второй волне активации симпатической нервной и симпато-адреналовой систем [17 ] , что подтверждается снижением мощности rMSSD и ростом SDNN/rMSSD в этот период.
ЗАКЛЮЧЕНИЕ
Концентрация кортикостерона в плазме крови, SDNN/rMSSD и общая мощность ВСР наиболее точно характеризуют развивающиеся ответные реакции организма в условиях травматизации перегородки носа у крыс и могут служить индикаторами хирургического стресса. В то время как SDNN не может являться надежным критерием ваготонии в тех же условиях. Таким образом, хирургическая травматизация в челюстно-лицевой области у крыс приводит к развитию дизадаптивных процессов в первые сутки с последующей нормализацией адаптивно-приспособительных процессов в период со второго по четвертый постоперационные дни.
Список литературы
Пустовит О.М., Наседкин А.Н., Егоров В.И., Исаев В.М., Исаев Э.В., Морозов И.И. Воздействие ультразвуковой кавитации и фотохромотерапии на процесс репарации слизистой оболочки носа после септопластики и подслизистой вазотомии нижних носовых раковин // Голова и шея/Head and neck. Russian Journal. 2018. V. 6. № 2. P. 20–26.
Van Egmond M.M.H.T., Rovers M.M., Hannink G., Hendriks C.T.M., van Heerbeek N. Septoplasty with or without concurrent turbinate surgery versus non-surgical management for nasal obstruction in adults with a deviated septum: a pragmatic, randomised controlled trial. // Lancet. 2019; V. 394. № 10195. P. 314–321.
Siegel N.S., Gliklich R.E., Taghizadeh F., Chang Y. Outcomes of septoplasty. // Otolaryngol Head Neck Surg. 2000. V. 122. № 2. P. 228–32.
Torshin V., Kastyro I., Kostyaeva M., Popadyuk V., Ermakova N., Surovtsev V., Gushchina Y., Kovalenko A. The effect of destruction of the mucous membrane of the olfactory zone of the nasal septum on the cytoarchitectonics of the pyramidal layer of the hippocampus. // Virchows Archiv. 2020. V. 477. P. 340.
Kastyro I.V., Reshetov I.V., Khamidulin G.V., Shmaev-sky P.E., Karpukhina O.V., Inozemtsev A.N., Torshin V.I., Ermakova N.V., Popadyuk V.I. The Effect of Surgical Trauma in the Nasal Cavity on the Behavior in the Open Field and the Autonomic Nervous System of Rats // Doklady Biochemistry and Biophysics. 2020. V. 492. P. 121–123.
Kastyro I.V., Reshetov I.V., Khamidulin G.V., Shilin S.S., Torshin V.I., Kostyaeva M.G., Popadyuk V.I., Yunusov T.Y., Shmaevsky P.E., Shalamov K.P., Kupryakova A.D., Doroginskaya E.S., Sedelnikova A.D. Influence of Surgical Trauma in the Nasal Cavity on the Expression of p53 Protein in the Hippocampus of Rats. // Doklady Biochemistry and Biophysics. 2021. V. 497. P. 99–103.
Koenig J., Thayer J.F. Sex differences in healthy human heart rate variability: a meta-analysis. // Neurosci Biobehav Rev. 2016. V. 64. P. 288–310.
Sztajzel J. Heart rate variability: a noninvasive electrocardiographic method to measure the autonomic nervous system. // Swiss Med. Wkly. 2004. V. 134. P. 514–522.
Kang J.H., Kim J.K., Hong S.H., Lee C.H., Choi B.Y. Heart Rate Variability for Quantification of Autonomic Dysfunction in Fibromyalgia. // Ann. Rehabil. Med. 2016. V. 40. № 2. P. 301–309.
Desborough J.P. The stress response to trauma and surgery. // Br J Anaesth. 2000. V. 85. № 1. P. 109–117.
Kastyro I.V., Torshin V.I., Drozdova G.A., Popadyuk V.I. Acute pain intensity in men and women after septoplasty // Russian Open Medical Journal. 2017. V. 6. № 3. P. 1–6.
Karri J., Zhang L., Li S., Chen Y.-T., Stampas A., Li S. Heart Rate Variability: A Novel Modality for Diagnosing Neuropathic Pain after Spinal Cord Injury. // Front. Physiol. 2017. V. 8. P. 495.
Patural H., Pichot V., Flori S., Giraud A., Franco P., Pladys P., Beuchée A., Roche F., Barthelemy J.-C. Autonomic maturation from birth to 2 years: normative values. // Heliyon. 2019. V. 5. P. e01300.
Pagani M., Lombardi F., Guzzetti S., Sandrone G., Rimoldi O., Malfatto G. Power spectral density of heart rate variability as an index of sympatho-vagal interaction in normal and hypertensive subjects. // J. Hypertens Suppl. 1984. V. 2. P. 383–385.
Valentino R.J., Foote S.L., Aston-Jones G. Corticotropin-releasing factor activates noradrenergic neurons of the locus coeruleus. // Brain research. 1983. V. 2. № 270. P. 363–367.
Гостюхина А.А., Самощина Т.А., Çайцев К.В., Гутор С.С., Жукова О.Б., Светлик М.В., Абдулкина Н.Г., Сайцев А.А. Адаптивные реакции крыс после световых десинхронозов и физического переутомления. // Бюллетень сибирской медицины. 2018. Т. 17. № 3. С. 22–34.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни



