Доклады Российской академии наук. Науки о жизни, 2021, T. 500, № 1, стр. 451-454
Sfmbt ВЗАИМОДЕЙСТВУЕТ С БЕЛКОМ Hangover И СУБЪЕДИНИЦАМИ SWI/SNF-КОМПЛЕКСА У Drosophila melanogaster
М. М. Ерохин 1, Ю. В. Шидловский 1, Д. В. Ломаев 1, академик РАН П. Г. Георгиев 1, Д. А. Четверина 1, *
1 Институт биологии гена Российской академии наук
Москва, Россия
* E-mail: daria.chetverina@gmail.com
Поступила в редакцию 23.04.2021
После доработки 06.05.2021
Принята к публикации 06.05.2021
Аннотация
Белки группы Polycomb (PcG) представлены регуляторными комплексами, осуществляющими репрессию транскрипции. В настоящем исследовании методом аффинной очистки из ядерного экстракта с последующим высокоспецифичным пептидным секвенированием (IP/LC-MS) мы изучили интерактом фактора Sfmbt на эмбриональной стадии развития дрозофилы. В результате был обнаружен ряд ранее не охарактеризованных взаимодействий Sfmbt. В частности, основными партнерами Sfmbt являются ДНК-связывающий белок Hangover, а также компоненты SWI/SNF-семейства ремоделеров хроматина.
Репрессия транскрипции – сложно регулируемый процесс, который осуществляется многими факторами, в частности белками из группы Polycomb (PcG) [1–5]. Нарушения активности данных факторов наблюдаются при многих патологических состояниях, что повышает интерес к исследованиям в этой области [6–9]. PcG формируют несколько белковых комплексов (PRC1, PRC2, PhoRC), которые рекрутируются на специфические области хроматина, называемые Polycomb response elements (PREs). Комплекс PhoRC (Pho repressive complex), охарактеризованный у дрозофилы, содержит белок Sfmbt, а также ДНК-связывающий фактор Pho или его гомолог Phol. Несмотря на данные, согласно которым Pho/Phol необходимы для привлечения Sfmbt на хроматин, около 50% геномных областей, с которыми взаимодействует Sfmbt, не демонстрируют связывания Pho/Phol [10]. Таким образом, предполагается, что на ряд PRE-элементов Sfmbt рекрутируется за счет других ДНК-связывающих белков.
Структура Sfmbt и получение специфичных поликлональных антител
Белок Sfmbt имеет две основные изоформы длиной 1220 a.о. (изоформа Sfmbt-PB) и 868 a.о. (изоформа Sfmbt-PA, рис. 1а). Обе изоформы содержат четыре MBT-повтора в середине белка (536–975 а.о. относительно изоформы B) и SAM-домен на C-конце (1140–1203 а.о. относительно изоформы B), однако изоформа Sfmbt-PA лишена N-концевого домена, имеющегося у Sfmbt-PB. Домен, содержащий четыре MBT-повтора, необходим для взаимодействия с ДНК-связывающими белками Pho и Phol, тогда как SAM-домен образует контакты с другим PcG-фактором – Scm [11].
Рис. 1.
(а) Структура белка Sfmbt у Drosophila melanogaster (показаны изоформы Sfmbt PB и PА). Cерые прямоугольники – MBT-повторы, темно-серый прямоугольник – SAM-домен. Обозначенная область 976-1139 а.о. была использована в качестве антигена. (б) Результаты Western-блот-гибридизации, полученные при анализе аликвот очищенного комплекса Sfmbt. Стрелками указаны полосы, соответствующие изоформам PB и PА. Output – ядерный экстракт после инкубации с антителами против Sfmbt, либо против неспецифических антител (IgG). IP – элюированные пробы, полученные после инкубации с антителами против Sfmbt, либо против неспецифических антител (IgG). М – маркер длин, полосы соответствуют размерам 100 и 130 кДа. (в) 20 наиболее представленных белковых партнеров Sfmbt, идентифицированных в протеомном анализе. Показано число пептидов (peptide count) в случае иммунопреципитации с антителами против Sfmbt (столбец Sfmbt IP) и в случае использования неспецифических иммуноглобулинов (столбец IgG IP).

Для получения поликлональных антител была создана конструкция для наработки антигена, соответствующего фрагменту С-конца белка Sfmbt (976–1139 а.о. изоформы B, рис. 1а). Данная область была выбрана в качестве антигена исходя из двух соображений. Во-первых, использованный участок присутствует в обеих изоформах Sfmbt. Таким образом, антитела, полученные к данной области, будут детектировать оба варианта белка Sfmbt. Во-вторых, участок между MBT-повторами и SAM-доменом уникален для Sfmbt и не содержит гомологий с другими белками. Полученная конструкция для наработки антигена была создана на основе вектора pET32a (Novagene) и содержала слитые в одну рамку считывания с фрагментом Sfmbt два шестикратных гистидиновых тага (6xHisTag, на N- и С-концах фрагмента Sfmbt), необходимые для последующей очистки антигена.
После наработки (в клетках E. coli BL21) и очистки (использована Ni Sepharose 6 Fast Flow, Sigma) антигена были проведены процедуры по иммунизации кроликов. Полученную сыворотку очищали с использованием исходного антигена, ковалентно пришитого к сефарозе CL-4B. Очищенные поликлональные антитела применяли для выделения белкового комплекса.
Очистка и анализ белкового комплекса Sfmbt
Для выявления белковых партнеров Sfmbt был применен метод иммунопреципитации из ядерного эмбрионального экстракта (возраст эмбрионов – 1–12 ч) с использованием полученных антител. Методы выделения ядерного экстракта и иммунопреципитации были подробно описаны ранее [12, 13].
На рис. 1б показаны результаты вестерн-блот анализа, проведенного с использованием аликвоты материала, который в дальнейшем был проанализирован методом пептидного секвенирования LC-MS. Для окрашивания были использованы те же антитела, что и для иммунопреципитации. В элюате, полученном с использованием специфичных антител, детектируются две полосы, соответствующие по молекулярным массам изоформам Sfmbt-PB и Sfmbt-PA (расчетные массы 134 и 96 кДa соответственно). При этом данные полосы отсутствуют в контрольном эксперименте, где в качестве неспецифичных антител были использованы IgG неиммунизированного животного. Вместе с тем анализ экстракта после инкубации с антителами (Output) показывает истощение Sfmbt в случае использования специфических антител в сравнении с контрольными IgG.
На следующем этапе выделенный материал анализировали методом масс-спектрометрии LC-MS, позволяющим идентифицировать все представленные в иммунопреципитате пептиды. Анализ проводился, как подробно описано ранее [13], для идентификации пептидов использованы базы данных UniProt Drosophila melanogaster и DTASelect. На рис. 1в показаны 20 идентифицированных белков, показавших наибольший уровень обогащения при проведении масс-спектрометрических исследований. Для белка Sfmbt было выявлено 59 пептидов против 0 пептидов в контрольном образце с неспецифическими антителами. Это подтверждает высокую специфичность проведенной очистки. Среди основных партнеров Sfmbt выделяются субъединицы комплексов ремоделеров хроматина семейства SWI/SNF. Детальный поиск субъединиц ремоделеров показал, что в иммунопреципитате присутствуют все компоненты комплексов BAP и PBAP (рис. 2а).
Рис. 2.
Sfmbt взаимодействует с ремоделерами хроматина и ДНК-связывающими факторами. Представлены результаты протеомного анализа для компонентов хроматин-ремоделирующего комплекса SWI/SNF (а), PcG-репрессоров (б) и белков с ДНК-связывающими мотивами типа “цинковые пальцы” С2Н2-типа (в). Остальные обозначения как на рис. 1.
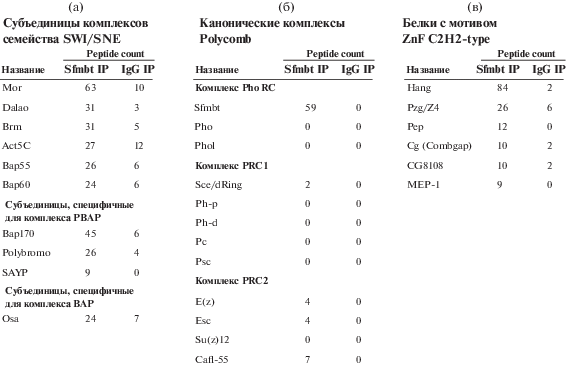
На следующем этапе мы проверили, какие еще белки из группы Polycomb детектируются в интерактоме Sfmbt (рис. 2б).
Были найдены два белка, входящих в состав комплекса PRC2 (E(z) и Caf55), и один белок из комплекса PRC1 (Sce/dRING). Интересно, что ни белок Pho, ни белок Phol, не детектировались в выделенном комплексе. Полученные данные предполагают, что использованные нами антитела преципитируют Sfmbt в составе отличного от описанного ранее PhoRC комплекса. В данном комплексе также могут находиться компоненты с ДНК-связывающей активностью, необходимые для рекрутирования Sfmbt на хроматин. Предполагается, что основную роль в привлечении PcG-комплексов у дрозофилы играют белки с мотивами “цинковые пальцы” C2H2-типа [14]. Поэтому на следующем этапе мы провели поиск таких факторов в списке идентифицированных белков (рис. 2в). Самое большое число пептидов (84) соответствовало белку Hang (Hangover). Данный фактор содержит в своем составе 19 мотивов типа “цинковые пальцы” C2H2-типа. Кроме того, среди обнаруженных белков присутствовал фактор Combgap (Cg), для которого ранее были показаны связывание с PRE-элементами и взаимодействие с PcG-репрессорами [15].
Идентифицированные ДНК-связывающие белки потенциально могут принимать участие в привлечении Sfmbt в определенные локусы генома, однако конкретную роль выявленных факторов в процессах рекрутирования Sfmbt (как и, возможно, других PcG-репрессоров) предстоит установить в будущем.
Список литературы
Chetverina D.A., Elizar’ev P.V., Lomaev D.V., et al. // Russian Journal of Genetics. 2017. V. 53. № 2. P. 157–177.
Schuettengruber B., Bourbon H.M., Di Croce L., et al. // Cell. 2017. V. 171. № 1. P. 34–57.
Kassis J.A., Kennison J.A., Tamkun J.W. // Genetics. 2017. V. 206. № 4. P. 1699–1725.
Cheutin T., Cavalli G. // Crit Rev Biochem Mol Biol. 2019 V. 54 № 5. P. 399–417.
Kuroda M.I., Kang H., De S., Kassis J.A. // Annu. Rev. Biochem. 2020. V. 89. P. 235–253.
Chetverina D.A., Lomaev D.V., Erokhin M.M. // Acta Naturae. 2020. V. 12. № 4. P. 66–85.
Chetverina D.A., Lomaev D.V., Georgiev P. G, et al. // Russian Journal of Genetics. 2021. V. 57. № 3. P. 258–272.
Varlet E., Ovejero S., Martinez A.M., et al. // Int. J. Mol. Sci. 2020. V. 21 № 21. P. 8047.
Piunti A., Shilatifard A. // Nat Rev Mol Cell Biol. 2021.
Oktaba K., Gutiérrez L., Gagneur J., et al., // Dev Cell. 2008 V. 15. № 6. P. 877–889.
Frey F., Sheahan T., Finkl K., et al., // Genes Dev. 2016. V. 30 № 9. P. 1116–1127.
Shaposhnikov A.V., Lebedeva L.A., Chernioglo E.S., et al. // Bioorg Khim. 2016. V. 42. P. 712–721.
Lomaev D., Mikhailova A., Erokhin M., et al. // PLoS ONE. 2017. V. 12. e0173602.
Erokhin M., Georgiev P., Chetverina D. // Epigenomes. 2018. V. 2. № 1. P. 1–24.
Ray P., De S., Mitra A., et al., // Proc. Natl. Acad. Sci. USA. 2016. V. 113. № 14. P. 3826–3831.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


