Доклады Российской академии наук. Науки о жизни, 2021, T. 500, № 1, стр. 488-494
ИСПОЛЬЗОВАНИЕ АНТИГЕННОГО БЕЛКА ВПЧ6 L1 ДЛЯ ИНДУКЦИИ СИНТЕЗА ИНТЕРФЕРОНА, CD4 И CD8 Т ЛИМФОЦИТОВ, А ТАКЖЕ ГРАНЗИМА В В КРОВИ И СПЛЕНОЦИТАХ МЫШЕЙ ДЛЯ РАЗРАБОТКИ ВАКЦИНЫ ПРОТИВ АНОГЕНИТАЛЬНЫХ ПАПИЛЛОМАТОЗОВ
Член-корреспондент РАН Р. К. Саляев 1, Н. И. Рекославская 1, *
1 ФГБУН Сибирский институт физиологии и биохимии растений Сибирского отделения РАН
Иркутск, Россия
* E-mail: rekoslavskaya@sifibr.irk.ru
Поступила в редакцию 22.04.2021
После доработки 23.06.2021
Принята к публикации 23.06.2021
Аннотация
Антигенный белок ВПЧ6 L1 синтезирован в растительной экспрессионной системе трансгенных плодов томата при разработке пероральной вакцины против аногенитальных папилломатозов. В экспериментах по иммунизации мышей получены новые данные об индукции Т клеточного иммунного ответа, регистрируемые по результатам активации синтеза интерферона, CD4 и СD8 Т лимфоцитов, секретируемого ими гранзима В в периферических мононуклеарных клетках крови и спленоцитах мышей, предварительно вакцинированных вакцинным материалом плодов томата с геном HPV6 L1.
Папилломавирусы ВПЧ6 и ВПЧ11 являются субтипами низкого риска канцерогенеза человека, но характеризуются тем, что вызывают аногенитальные бородавки, ларингеальные папилломатозы, кондиломы Сondyloma acuminata и др., давно известные как поражающие людей и причиняющие значительные неудобства в жизнедеятельности, снижая качество жизни и социальный статус человека. По данным ВОЗ аногенитальные папилломавирусы весьма широко распространены среди населения разных стран [1]. Кроме этого, папилломавирусы в ряду типов 11>6>16 ≠ 18 способны вызывать сложное мультигенное заболевание, именуемое возвратный (рецидивирующий) респираторный папилломатоз (RRP), впервые описанное у детей в возрасте 2–4 лет в XIX веке, протекающее внешне бессимптомно и с редкой смертностью, но неподдающееся излечению. RRP характеризуется генетической дисрегуляцией как минимум 100 генов иммунного ответа и апоптоза, что вызывает болезненную дисфункцию клеточного иммунитета (истощение макрофагов, иммунодефицит В и Т лимфоцитов и др.), и подавляющему эффективный клиринг и контроль за инфекцией ВПЧ6 и ВПЧ11 [2]. Действие аногенитальных папилломавирусов на клеточный иммунитет мало изучено и поэтому недостаточно понятно.
Поскольку эти заболевания специфически связаны с изменениями в клеточном иммунном ответе при инфекции ВПЧ, целью нашей работы было оценить изменения клеточного иммунитета в результате перорального вакцинирования мышей вакцинным материалом плодов трансгенного томата с геном HPV6 L1 в сыворотке крови и спленоцитах. Так как ранее была установлена перекрестная реакция между филогенетически неродственным антигеном ВПЧ6 L1 и антителами к ВПЧ16 L1, ВПЧ18 L1, ВПЧ31 L1 и ВПЧ45 L1 [3], было важно определить, будет ли происходить подобное перекрестное взаимодействие при активации клеточного иммуногенеза.
В результате проделанной работы впервые показано весьма значительное возрастание содержания интерферона, CD4 и CD8 Т лимфоцитов, секретируемого ими фермента апоптоза гранзима В, которое предполагает возможность эффективной пероральной вакцинации с целью активации клеточного ответа в результате иммунизации мышей вакцинным материалом с белком ВПЧ6 L1 аногенитального типа, синтезированным в растительной экспрессионной системе плодов трансгенного томата.
В работе была использована генетическая конструкция с HPV6 L1, дизайн которой и синтез были опубликованы ранее [3]. Трансформация растений томата и синтез антигенного белка ВПЧ6 L1 также представлены в нашей предыдущей работе [3], посвященной разработке высокоэффективной экспрессионной системы на основе РНК зависимой РНК полимеразы (RdRP) вируса мозаики огурца CMV. Условия содержания лабораторных мышей и методика проведения вакцинирования опубликованы ранее [4, 5].
Мыши для экспериментов были получены из вивария Восточно-Сибирского института медико-экологических исследований (г. Ангарск), работы с мышами были одобрены на заседании биоэтического совета СИФИБР СО РАН (протокол заседания № 9 от 30.10.2019 г.). При содержании мышей соблюдали стандартные условия, прописанные в ГОСТ 33215-2014, 33216-2014.
Мышей (беспородные самки возрасте 6 мес) перорально вакцинировали трижды с интервалом в один месяц вакцинным материалом плодов томата с геном HPV6 L1, при этом каждая мышь получала в среднем около 500 мкг ВПЧ6 L1. Через месяц после последней вакцинации у мышей брали кровь и выделяли селезенку. После сбора кровь до момента анализа содержали в специальных пробирках на 4 мл для хранения с напылением К2 + ЭДТА (Vacuum Blood Collection Tube, Сhina) при –62°С в низкотемпературном морозильнике. Селезенки помещали в среду DMEM в эппендорфы и на следующий день использовали для выделения спленоцитов.
Для анализа иммуногенности белка ВПЧ6 L1 использовали метод Элиспот, представляющий собой модификацию иммуноферментного анализа, позволяющий определять и количественно оценивать антиген-специфические Т лимфоциты, секретирующие определенный иммуноген, цитокин, например, IFNγ или фермент апоптоза гранзим В, локализованный в гранулах CD8 Т лимфоцитов. Для этого периферические мононуклеарные клетки крови (ПМКК) или спленоциты культивировали в присутствии антигена (индуктора) на нитроцеллюлозной мембране с адсорбированными первичными антителами, специфичными к исследуемому цитокину (или другому активатору). В результате стимуляции каждая антигенспецифическая клетка начинает продуцировать иммуноген, который связывается с иммобилизованными на мембране первичными антителами. После этого клетки отмывали фосфатно-солевым буфером и секретированные ими продукты определяли как окрашенные мелкие “пятна” (точки) на мембране с использованием конъюгированных с ферментом (щелочной фосфатазой) вторичных антител и хромогенного субстрата. Таким образом, методом Элиспот определяли количество восприимчивых к антигену иммуноген-секретирующих клеток в результате иммунной активации. Элиспот считается наиболее рекомендуемым методом для количественной оценки Т клеточного иммунного ответа при испытаниях вакцин.
В анализе использовали набор фирмы Abcam (UK) ab64029 – Murine IFNγ ELISPOT Kit (with precoated plates). Но ввиду большого количества Т лимфоцитов, выросших на мембранных дисках (диаметр 4 мм), которые трудно было просчитать, впоследствии был разработан модифицированный метод, использующий стерильные плоскодонные планшеты фирмы Corning Incorporated Costar 24 Well Cell Culture Plate Flat Bottom with Lid Tissue Culture Treated Non-Pyrogenic Polystyrene (USA) с диаметром дна лунок в 14 мм. В ламинар-боксе вырезали диски диаметром 12 мм нитроцеллюлозной мембраны Hybond™-C Extra (Membrane optimized for protein transfer) (Amersham Biosciences, UK) и помещали их на дно ячеек, в которые затем вносили по 300 мкл питательной среды DMEM (Биолот, Россия) и определенное количество микролитров суспензии периферических мононуклеарных клеток крови (ПМКК) или спленоцитов. В качестве индуктора ВПЧ6 L1 использовали 100 мкл супернатанта гомогената c ВПЧ6 L1, которые добавляли в среду DMEM перед внесением клеток крови или спленоцитов.
Спленоциты выделяли по ранее опубликованному методу [4, 5]. После измельчения селезенок полученные гомогенаты распределяли по эппендорфам и для обогащения фракции лимфоцитов центрифугировали 7 мин при 4°С и 700 об/мин. Жизнеспособность спленоцитов в супернатанте определяли с помощью 0.3% нитросинего тетразолия (Sigma, USA), а отсутствие мертвых клеток в препарате регистрировали с помощью 0.4% трипанового синего (Биолот, Россия). При подсчете (камера Горяева) с одной селезенки получали примерно 107–108 клеток на мл (в объеме одного эппендорфа). Дальнейшую процедуру Элиспот, включающую инкубации с антителами и промывание дисков буфером, осуществляли по протоколу набора фирмы Abcam.
В анализе Элиспот использовали следующие специфические антитела фирмы Abcam: первичные – Anti-Interferon gamma antibody recombinant rabbit monoclonal [EPR1108] ab133566; Anti-CD4 antibody [EPR19514] ab183685 recombinant rabbit monoclonal; Anti-CD8 alpha antibody [EPR21769] ab217344 recombinant rabbit monoclonal; Anti-Granzyme B antibody ab53097 rabbit polyclonal; вторичные – Goat Anti-mouse IgG H&L (Alkaline Phosphatase) ab97020. В качестве субстрата брали таблетки (0.3–0.5 таблетки на 1 анализ в 1 планшете) SIGMAFAST™ BCIP®NBT (Sigma, USA) в буфере 100 мМ NaCl, 5 мM MgCl2, 100 мМ Трис-НСl, рН 9.5. Окрашивание наблюдали в течение 20–30 мин, после чего диски фиксировали на листе белой бумаги и фотографировали с помощью цифрового фотоаппарата. Подсчет количества окрашенных “пятен” клеток осуществлялся по фотографиям на дисплее компьютера при необходимом увеличении. Окрашенное “пятно” клеток, т.е. “пятно” – образующая единица или Т клеточное “пятно”, как полагают [6], является клоном одной клетки, секретирующей индуцируемый специфический цитокин (иммуноген).
На первом этапе исследования изучали действие ВПЧ6 L1 на индукцию синтеза интерферона в клетках крови (ПМКК) и спленоцитах при разном количестве вносимой суспензии клеток в среду DMEM. Выяснилось, что нет различий в количестве прореагировавших “пятен”, т.е. выросших из Т клеток, вносимых в исходно в разной концентрации. Например, при разведении суспензий ПМКК в 5, 15, 30, 50, 70 и 100 мкл число “пятен” составило соответственно: 476 ± 60, 438 ± 18, 574 ± 70, 409 ± 11, 478 ± 14, 161 ± 0. При разведении суспензий спленоцитов в тех же количествах мкл количество “пятен” составило соответственно: 504 ± 34, 613 ± 65, 723 ± 17, 664 ± 12, 704 ± 8, 620 ± 116. В дальнейших экспериментах в лунки вносили по 30 мкл суспензий ПМКК или спленоцитов, опираясь на число “пятен” при подсчете.
На рис. 1 представлен анализ Элиспот, выполненный в точном соответствии с набором фирмы Abcam (UK) ab64029 – Murine IFNγ ELISPOT Kit. В лунки планшета (Медполимер, Санкт-Петербург) с помещенными на дно нитроцеллюлозными дисками (диаметр 4 мм) вносили суспензии ПМКК или спленоцитов в среде DMEM c антибиотиками в объеме 100 мкл, которые содержали примерно 105 клеток и индуктор антигенный белок ВПЧ6 L1 (100 мкг) в соответствии с прописью фирмы Abcam. За этот период в течение трех суток размножилось на дисках довольно большое количество Т лимфоцитов, продуцирующих интерферон, лиганды CD4 и CD8 Т лимфоцитов, секретирующих гранзим В и клеток, прореагировавших с соответствующими коммерческими антителами. Как видим, произошла значительная индукция синтеза интерферона, Т лимфоцитов с лигандами CD4 и CD8. По результатам предварительного просчета их количество приближалось к числу 300–700 клеток (“пятно”-образующих единиц) на диск. В ряде контрольных дисков обнаруживаются прореагировавшие с антителами “пятна” клеток, но их количество составляло примерно 10–20 на диск. Представленные на рис. 1 данные дают основание полагать, что антигенный белок ВПЧ6 L1 способен в высокой степени активировать Т клеточный иммуногенез и вызывать индукцию синтеза интерферона, CD4, CD8 Т лимфоцитов, секретирующих значительные количества фермента апоптоза гранзима В.
Рис. 1.
Элиспот анализ индукции синтеза интерферона (IFN), CD4 и CD8 Т лимфоцитов, гранзима В (Grm B) при действии антигенного белка оболочки L1 папилломавируса аногенитального типа ВПЧ6 L1 в клетках крови (ПМКК) вакцинированных ВПЧ6 L1 мышей. Описание использованных в анализе коммерческих антител к IFN, CD4, CD8 Т лимфоцитам и гранзиму В приведены в тексте. Вариант Контроль –контроль без внесения индуктора ВПЧ6 L1 в среду DMEM, вариант + ВПЧ6 L1 – опыт с внесением индуктора ВПЧ6 L1 в среду DMEM.

Для того чтобы изучить индукцию синтеза Т клеток (Т клеточных “пятен”), использовали нашу модификацию метода Элиспот с увеличенной площадью нитроцеллюлозной мембраны для пролиферации Т клеток (рис. 2). При этом вначале использовали в качестве релевантного (контрольного и неиндукционного) белка бычий сывороточный альбумин (БСА), 3% раствор которого вносили в количестве 300 мкл в лунки планшета с 24 ячейками. Как видно из рис. 2, БСА не индуцировал синтез Т лимфоцитов.
Рис. 2.
Изучение методом Элиспот действия БСА и ВПЧ6 L1 на индукцию синтеза интерферона (IFN) в спленоцитах мышей, вакцинированных ВПЧ6 L1. Для анализа в вариантах использовали спленоциты восьми индивидуальных мышей. БСА – бычий сывороточный альбумин. Вариант Контроль + БСА – контроль без внесения ВПЧ6 L1 в среду DMEM и с добавлением БСА, вариант + ВПЧ6 L1 + БСА – внесены ВПЧ6 L1 и БСА одновременно.

Можно видеть, что увеличение площади нитроцеллюлозной мембраны, по-видимому, было благотворным для роста Т лимфоцитов и их жизнедеятельности, так как клеткам было достаточно пространства для пролиферации в виде единичных колоний, хорошо различимых визуально. Общеизвестно, что во взрослом организме содержится примерно 1011 моноцитов и макрофагов, высокопластичных, не имеющих специфичности предшественников лимфоцитов. Около 4 млрд Т лимфоцитов, большей частью “наивных”, т.е. “незаряженных” антигенами, свободно циркулируют в лимфе, в крови или депонируются в селезенке. Но при инфекции и последующем воспалении в очаге (например, под нарывом) скапливаются до 1 трлн Т лимфоцитов, продуцирующих интерферон и другие цитокины, активированные для борьбы с инфекцией, причем эта противовоспалительная активация происходит в считанные часы.
Очевидно, иммунные клетки быстро растут на питательной среде DMEM, а 10–30 мкл суспензии достаточно для осуществления успешного размножения праймированных Т-лимфоцитов. Повышение дозы засеваемой суспензии приводит к снижению скорости роста из-за контактного торможения и недостатка места для пролиферации. Следует отметить, что по истечении суммарного срока всех инкубаций (примерно 7 сут) спленоциты и ПМКК все еще оставались живыми, помещенными в среду DMEM.
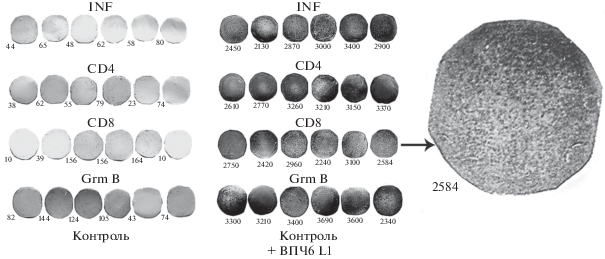
Из рис. 3 можно видеть, что наряду с активацией синтеза интерферона спленоциты мышей в присутствии ВПЧ6 L1 были способны формировать большие количества CD4 Т лимфоцитов и CD8 Т лимфоцитов, которые секретировали значительные количества фермента апоптоза гранзима В из внутриклеточных гранул (рис. 3). В рисунке в крайнем положении справа помещен нитроцеллюлозный диск варианта CD8, на котором выросло 2584 “пятен” клеток, хорошо различимых на фотографии и достаточно легко просчитываемых при большом увеличении на дисплее компьютера.
Рис. 3.
Изучение методом Элиспот индукции синтеза интерферона (IFN), CD4 и CD8 Т лимфоцитов в спленоцитах вакцинированных ВПЧ6 L1 мышей, а также индукции секреции фермента апоптоза гранзима В (Grm B) из гранул CD8 Т лимфоцитов. Обозначения: Контроль – контроль без индукции, + ВПЧ6 L1 – опыт, в котором внесен антигенный белок ВПЧ6 L1 для индукции активации Т лимфоцитов и секреции гранзима В. Стрелкой показан отдельный нитроцеллюлозный диск (вариант CD8) (крайний справа), на котором выявлены “пятна” клеток в просчитанном количестве 2584, прореагировавшие с антителами на CD8 Т лимфоцитов.
В наших предыдущих работах было показано, что антигенный белок ВПЧ6 L1 способен взаимодействовать с антителами филогенетически неродственных типов папилломавирусов типов 16, 18, 31 и 45 [3, 5]. Оказалось, что антигенный белок ВПЧ6 L1 также способен активировать Т клеточный иммуногенез у этих филогенетически неродственных типов 16, 18, 31 и 45 (табл. 1), так как в клетках крови (ПМКК), растущих на мембранных дисках, значительно проявилась окраска клеток с антителами на интерферон, СD4 и CD8 Т лимфоциты.
Таблица 1.
Индукция синтеза интерферона, CD4 и CD8 Т лимфоцитов антигенным белком ВПЧ6 L1 в крови (ПМКК) мышей, вакцинированных вакцинным материалом плодов томата с филогенетически неродственными типами папилломавирусов ВПЧ L1 16, 18, 31 и 45
| Тип ВПЧ L1 | Контроль | Опыт | ||||
|---|---|---|---|---|---|---|
| IFN* | CD4* | CD8* | IFN* | CD4* | CD8* | |
| 16 | 128 | 108 | 72 | 1980, 1800, 1220 | 1120, 1182, 1230 | 1980, 2016, 1186 |
| 18 | 98 | 78 | 76 | 1240, 1450, 1560 | 1840, 1684, 1208 | 1360, 2000, 1820 |
| 31 | 240 | 132 | 208 | 1160, 1950, 1420 | 1760, 1620, 1800 | 1185, 1560, 1670 |
| 45 | 204 | 15 | 36 | 1680, 1720, 1850 | 1860, 1840, 1380 | 1960, 1820, 1920 |
Инфицирование субтипами папилломавирусов низкого риска канцерогенеза ВПЧ6 и ВПЧ11, как полагают [2, 7], приводит к наиболее известным аногенитальным дисплазиям и к рецидивирующему (возвратному) респираторному папилломатозу. В дополнение к этому ВПЧ6 и ВПЧ11 ассоциируются с широким кругом достаточно агрессивных карцином: гортани, легких, языка, отоларингических новообразований, а также с дисплазией цервикса низкой и средней степени. Эти инфекционные заболевания трудно поддаются излечению (возврат к росту опухолей на 80% после комбинаторных способов лечения, включая хирургию, радиотерапию и хемотерапию), поэтому для их искоренения предполагают использовать многофазовые, мультикомпонентные схемы.
Одной из причин утраты устойчивости к инфекциям является “истощение” Т лимфоцитов, приводящее к разнообразным дисфункциям иммунной системы, иммунным заболеваниям, иммунодефицитам, опухолеобразованию и др. Поэтому необходимо искать инновационные пути усиления клеточного ответа для борьбы с инфекциями и иммунодефицитами.
В настоящей работе впервые показано, что антигенный белок аногенитального типа папилломавируса ВПЧ6 L1 способен активировать Т клеточный ответ в периферических клетках крови и спленоцитах, при этом значительно увеличивается количество клеток, синтезирующих интерферон, весьма возрастает число Т лимфоцитов с лигандами CD4 и CD8, активизируется секреция из гранул CD8 лимфоцитов фермента апоптоза гранзима В. Для получения этих результатов в нашей работе был применен метод Элиспот, модифицированный и значительно удешевляющий анализ по сравнению с зарубежными наборами. В зависимости от фирмы цена стандартного набора Элиспот составляет 90 000–100 000 рублей. Предложенная нами модификация анализа Элиспот требует затрат примерно в 10 раз меньше по сравнению с зарубежными аналогами, что позволяет осуществлять серийные анализы активации вакцинами иммунных ответов.
Известно, что Т клетки исключительно чувствительны к антигенной стимуляции, так как они могут уничтожать чужеродные структуры, пролиферировать и продуцировать цитокины в ответ на антигенпредставляющие клетки, приводя к образованию многочисленных комплексов гистосовместимости (MHCI и MHCII). Несмотря на то что антигенный белок ВПЧ16 L1, используемый в вакцинах Гардасил, Церварикс и Гардасил-9, охарактеризован как профилактический компонент, дальнейшие более детальные исследования показали, что ВПЧ16 L1 может вызывать также индукцию образования и накопление CD4 и СD8 Т лимфоцитов и активировать автолиз аутологичных клеток первичных опухолей цервикса, появившихся после инфекции онкогенным папилломавирусом ВПЧ16 [8]. По-видимому, судя по нашим данным [3] и данным других исследователей, если происходит индукция синтеза антител в присутствии индуктора высокоиммуногенного белка ВПЧ6 L1, то вполне вероятно, что при этом активируется и более полный Т клеточный иммуногенез, т.е. активация В лимфоцитов происходит одновременно с активацией и Т лимфоцитов.
Остановка активируемой регрессии опухолей индукторным антигеном, возможно, вызвана торможением белковыми ингибиторами контрольных точек (ИКТИ), которые уже обнаружены в большом количестве в организмах млекопитающих. Это предполагает, что клеточный иммунный ответ, формируемый данным вирусным антигеном, может иметь также и терапевтическое действие на опухоли и вызывать их регрессию впоследствии [6, 7]. Показано, что наличие или экспрессия даже ограниченного количества вирусного антигена L1 может послужить как триггер терапевтического действия и индуцировать гуморальный и цитотоксичный клеточные ответы, как на опухолях у пациентов [8], так и на моделях мышей [9].
Например, показано [10], что комбинация назального вакцинирования вакциной на основе комплекса малоразмерных пептидов ВПЧ Е6 и Е7 и белковых ингибиторов контрольных точек иммунитета (ИКТИ) приводила к значительной регрессии быстрорастущих агрессивных ротовых опухолей (орофаринкса, ротоглотки), имплантированных модельным мышам [10]. Как полагают авторы, успешность регрессии была обусловлена сочетанным и кумулятивным действием (комбинацией), вызывающим высокородственную и высокоэффективную индукцию специфического Т клеточного иммунного ответа пептидной вакциной и модальностью (модуляцией чувствительности, восприимчивости опухолевых клеток) белковых ингибиторов контрольных точек иммунного ответа. По отдельности вакцинный пептидный материал ВПЧ Е6/Е7 или белковые ингибиторы иммунных контрольных точек (ИКТИ) такой успешной регрессии не оказывали. По всей вероятности, вакцины на основе папилломавирусных высокоиммуногенных белков могли бы быть препаратами-партнерами для ИКТИ, которые при совместном действии усиливали бы противоопухолевую эффективность. Как известно, препараты из группы ИКТИ не запускают индукцию иммунного ответа “с нуля”: они лишь “растормаживают” уже инициированную иммунную реакцию, но “остановленную” белками контрольных точек [11]. Поэтому сейчас ведется направленный интенсивный поиск иммуногенных веществ, лизатов, вакцин, костимуляторных молекул, цитокинов и других компонентов иммунотерапии, которые в сочетании с ИКТИ преодолели бы контрольные точки иммунитета и оказали высокоэффективное противоопухолевое действие, вызывая регрессию. Наибольшего успеха достигли персонифицированные противораковые вакцины, т.е. разработанные с учетом индивидуальной восприимчивости опухолевых клеток определенного пациента, например, для усиления миграции Т лимфоцитов (киллеров) внутри опухоли и т.д. Полагают, что и для папилломавирусных инфекций типа кондилом, рецидивирующих дыхательных папилломатозов следует также применять “персонифицированный”, т.е. высокоспецифичный индивидуальный подход.
В случае аногенитальных папилломатозов мог бы быть прогрессивным подход для разработки вакцины с иммуногенным белком ВПЧ6 L1 и специфическим ингибитором контрольных точек иммунного ответа, тем более, что наблюдается перекрестная реакция между филогенетически неродственными типами папилломавирусов. Исследования, развиваемые в этом направлении, могли бы привести к разработке унифицированной терапевтической вакцины против папилломавирусной инфекции и против опухолеобразования, опосредованного ВПЧ.
Список литературы
Bruni L., Albero G., Serrano B. et al. // ICO/IARC Information Centre on HPV and Cancer (HPV Information Centre). Human Papillomavirus and related Diseases in the World. Summary Report WHO 17 June 2019. WORLD. 306 pp.
Bonagura V.R., Hatam L.J., Rosenthal D.W. et al. // APMIS. 2010. V.118. P. 455–470.
Рекославская Н.И., Саляев Р.К., Столбиков А.С. // Доклады Российской Академии Наук. Науки о Жизни. 2021. Т. 498. С. 57–63.
Саляев Р.К., Рекославская Н.И., Столбиков А.С. // Российские нанотехнологии. 2020. Т. 15. С. 132–138.
Salyaev R.K., Rekoslavskaya N.I., Stolbikov A.S. // Doklady Biochemistry Biophysics. 2019. V. 488. P. 316–319.
Потеряев Д.А., Хамитов Р.А., Ефимов Г.А., Шус-тер А.М. // Биопрепараты. Профилактика. Диагностика. Лечение. 2020. Т. 20. С. 144–158.
Shin T.H., Pankhong P., Yan J., Khan A.S. et al. // Human Vaccines and Immunotherapeutics. 2021. V. 8. P. 470–478.
Belone S., El-Sahwi K., Cocco E., Casagrande F. et al. // J. of Virol. 2009. V. 83. P. 6779–6789.
Paz De la Rosa G., Monroy-Garcia A., de Lourdes Mora-Garcia M. et al. // Virol. Journal. 2009. V. 6. P. 1–11.
Dorta-Estremera S., Chin R.L., Sierra G. et al. // Cancer Res. 2018. V. 78. P. 5327–5339.
Шубникова Е.В., Букатина Т.М., Вельц Н.Ю. и др. // Безопасность и риск фармакотерапии. 2020. Т. 8. С. 9–22.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


