Доклады Российской академии наук. Науки о жизни, 2021, T. 500, № 1, стр. 443-445
ОПРЕДЕЛЕНИЕ СРОДСТВА ЭУКАРИОТИЧЕСКОЙ РНК-хеликазы DDX3 К ХАРАКТЕРНЫМ ЭЛЕМЕНТАМ ВТОРИЧНОЙ СТРУКТУРЫ мРНК
А. Б. Шикалов 1, О. В. Сергеева 1, *, Т. С. Зацепин 1, 2
1 Центр наук о жизни, Сколковский институт науки
и технологий
Москва, Россия
2 Химический факультет Московского государственного университета имени М.В. Ломоносова
Москва, Россия
* E-mail: O.Sergeeva@skoltech.ru
Поступила в редакцию 15.04.2021
После доработки 02.05.2021
Принята к публикации 03.05.2021
Аннотация
РНК-хеликаза DDX3 участвует во многих процессах, обеспечивающих метаболизм РНК в клетках эукариот. Было показано, что DDX3 также участвует в процессе инициации трансляции, как кэп-зависимой, так и IRES-зависимой. Однако до сих пор не были определены параметры вторичной структуры 5'-нетранслируемых областей (НТО) мРНК, для эффективной трансляции которых необходима РНК-хеликаза DDX3. Мы произвели биоинформатический анализ данных вторичных структур 5'-НТО в DDX3-зависимых мРНК in silico и предсказали, что длина 5'-НТО для таких мРНК меньше среднестатистической, а также необходимость наличия шпилечных структур в области первых 50 нуклеотидов от 5'-конца мРНК.
РНК-хеликазы используют энергию гидролиза нуклеозид-5'-трифосфатов для расплетания вторичной структуры РНК, что необходимо для функционирования РНК и РНК-белковых комплексов в клетке. РНК-хеликаза DDX3 играет важную роль в различных клеточных процессах, включая транскрипцию, сплайсинг, синтез белка, клеточный цикл, апоптоз, врожденный иммунный ответ, а также репликацию вирусов [1, 2]. Количество DDX3 меняется при трансформации клеток, поэтому хеликаза является потенциальной мишенью для лечения онкологических заболеваний [3]. Одним из открытых вопросов для этой хеликазы является вклад в процесс инициации трансляции в клетках эукариот [4, 5]. Предполагается, что РНК-хеликаза DDX3 участвует в расплетании стабильных вторичных структур в непосредственной близости от 5'-конца мРНК [4]. Однако для гомолога DDX3 в дрожжах – хеликазы Ded1p – показано участие в расплетании шпилечных структур на расстоянии больше 50 нуклеотидов от 5'-конца мРНК [6]. Таким образом, необходимы дополнительные исследования, посвященные особенностям вторичной структуры мРНК, для трансляции которых привлекается РНК-хеликаза DDX3. Чтобы определить типы вторичных структур в мРНК, в расплетании которых участвует РНК-хеликаза DDX3, мы проанализировали данные транскриптома для линии клеток MCF7 после ингибирования хеликазы DDX3 [7]. Отсортировав данные по степени изменения уровня экспрессии генов и доверительному интервалу (p < 0.05), мы определили 932 гена, на экспрессию мРНК которых влияет снижение уровня DDX3. Для полученного списка был выполнен анализ обогащения по функциональной принадлежности с использованием онлайн сервера Enrichr (https://maayanlab.cloud/Enrichr/), чтобы определить биологические процессы, на которые в первую очередь влияет снижение DDX3 [8] (рис. 1а). Полученные данные были первично отсортированы по доверительному интервалу (p < 0.05), а затем по относительным единицам Enrichr, которые представляют собой значения после дополнительной поправки на тест Фишера.
Рис. 1.
(а) Список биологических процессов с наиболее значимыми изменениями после подавления экспрессии DDX3, отсортированные по доверительному интервалу (<0.05) и относительным единицам Enrichr. (б) Распределение длин 5'-НТО для 550 мРНК, экспрессия которых была снижена при подавлении DDX3 в клетках MCF7.
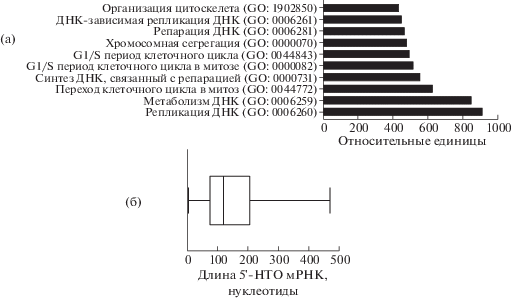
Далее мы проанализировали последовательности 5'-нетранслируемых областей (НТО) из 550 мРНК (включая изоформы), соответствующие списку генов, полученных нами на предыдущем этапе, с помощью ENSEMBL biomaRt (база данных ENSEMBL Genes 100, сборка генома человека GRCh38.p13), определили их длины и оценили распределение длин 5'-НТО для мРНК, экспресия которых менялась при снижении количества DDX3 (рис. 1б). Мы определили, что большинство значений длин 5'-НТО мРНК составляют от 72 до 208 нуклеотидов. Также мы проанализировали области мРНК, содержащие 5'-НТО и первые 200 нуклеотидов из кодирующей последовательности белка (извлеченной с помощью инструмента ENSEMBL biomaRt, база данных ENSEMBL Genes 100, сборка генома человека GRCh38.p13).
Мы использовали программу Vienna RNAfold [9], которая позволяет строить модели вторичной структуры РНК на основе минимизации свободной энергии и предсказывает относительную стабильность вторичных структур. Результаты анализа для нескольких мРНК приведены на рис. 2 в качестве примера.
Рис. 2.
(а) Примеры предсказания вторичных структур участков 5'-НТО для DDX3-зависимых мРНК из клеток MCF7. Цветовой код показывает вероятность образования комплементарной пары от 0 (фиолетовый) до 1 (красный). (б) Примеры предсказания вторичных структур 5'-НТО для DDX3-зависимых мРНК, для которых наблюдалось снижение эффективности трансляции. Красными прямоугольниками выделены 5'-концевые участки мРНК, а * отмечен 5'-конец.
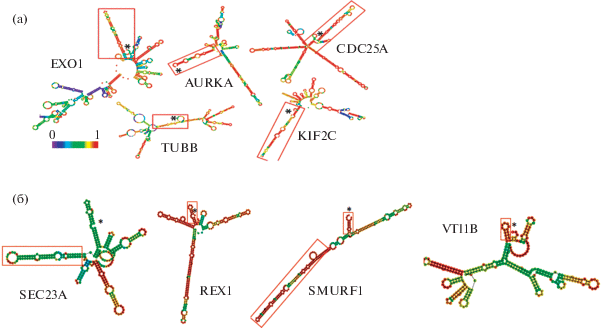
На основании этих данных нами был сделан вывод о том, что мРНК, уровень которых зависит от количества хеликазы DDX3 в клетке, чаще всего имеют стабильную шпилечную структуру в области первых 50 нуклеотидов от 5'-конца мРНК (рис. 2а). Для проверки полученных результатов мы провели аналогичный анализ данных рибосомного профайлинга в условиях ингибирования хеликазы DDX3, которые также подтвердили наличие стабильных вторичных структур в начале 5'-концевого НТО мРНК (рис. 2б) [10].
Таким образом, в ходе данной работы мы выявили особенности вторичной структуры 5'-НТО мРНК, уровень экспрессии и эффективность трансляции которых зависят от количества РНК-хеликазы DDX3. мРНК, уровень экспрессии которых в клетке зависит от РНК-хеликазы DDX3, имеют укороченные 5'-НТО (не более 208 нуклеотидов, с медианой 129 нуклеотидов), по сравнению со средней длиной 5'-НТО мРНК человека [10]. Также мы предсказали наличие стабильных элементов вторичной структуры РНК (шпилек) на участке первых 50 нуклеотидов от 5'-конца мРНК, эффективность трансляции которых зависит от уровня РНК-хеликазы DDX3. Можно предположить, аппарат трансляции в эукариотической клетке привлекает дополнительные РНК-хеликазы, например DDX3, для расплетания вторичных структур мРНК, расположенных близко к 5'-концу из-за стерических затруднений для работы канонической хеликазы в составе трансляционной машины [4].
Список литературы
Kukhanova M.K., Karpenko I.L., Ivanov A.V. // Molecules. 2020. V. 25. P. 1015–1031.
Bol G.M., Xie M., Raman V. // Mol Cancer. 2015. V. 14. P. 188–204.
Fuller-Pace F.V. // RNA Biol. 2013. V. 10. P. 121–132.
Soto-Rifo R., Rubilar P., Limousin T., et al. // EMBO J. 2012. V. 31. P. 3745–3756.
Hilliker A., Gao Z., Jankowsky E., Parker R. // Mol Cell. 2011. V. 43. P. 962–972.
Sen N.D., Zhou F., Ingolia N.T., et al. // Genome Res. 2015. V. 25. P. 1196–1205.
Cannizzaro E., Bannister A., Han N., et al. // FEBS Lett. 2018. V. 592. P. 1873–3468.
Kuleshov M., Jones M., Rouillard A., et al. // Nucleic Acids Res. 2016. V. 44. P. W90–W97.
Lorenz R., Bernhart S.H., Höner Zu Siederdissen C., et al. // Algorithms Mol Biol. 2011. V. 6. P. 26–40.
Calviello L., Venkataramanan S., Rogowski K., et al. // BioRxiv. 2019. P. 1–22.
Pesole G., Mignone F., Gissi C., et al. // Gene. 2001. V. 276. P. 73–81.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


