Доклады Российской академии наук. Науки о жизни, 2021, T. 501, № 1, стр. 557-562
ФЕМТОСЕКУНДНОЕ ИЗЛУЧЕНИЕ НИЗКОЙ ИНТЕНСИВНОСТИ АКТИВИРУЕТ ЕСТЕСТВЕННУЮ ЗАЩИТУ ОРГАНИЗМА МЫШЕЙ in vivo
Член-корреспондент РАН Г. Р. Иваницкий 1, С. И. Заичкина 1, А. Р. Дюкина 1, *, В. И. Юсупов 2, С. С. Сорокина 2, О. М. Розанова 1, Е. Н. Смирнова 1, Д. П. Ларюшкин 1, Н. В. Минаев 2, М. М. Поцелуева 1
1 Федеральное государственное бюджетное учреждение науки Институт теоретической и экспериментальной биофизики Российской академии наук
Пущино, Россия
2 Институт фотонных технологий Федеральный научный исследовательский центр “Кристаллография
и фотоника” Российской академии наук
Москва, Троицк, Россия
* E-mail: dyukina@rambler.ru
Поступила в редакцию 19.06.2021
После доработки 29.07.2021
Принята к публикации 29.07.2021
Аннотация
Показана возможность индукции цитогенетических повреждений в костном мозге, изменения клеточности лимфоидных органов и состава крови у мышей, облученных низкоинтенсивным фемтосекундным лазерным излучением при плотности потока энергии 5.1, 10.4 и 52 мДж/см2 (0.5 мВт в течение 5, 10 и 50 с) in vivo. С помощью теста “радиационный адаптивный ответ” ( 0.1 Гр + 1.5 Гр) было обнаружено, что при воздействии на мышей фемтосекундным лазерным излучением в низких дозах наблюдается защитный эффект, т.е. активация естественной защиты организма в том же узком диапазоне плотности потока энергии (2–16 мДж/см2), как и при облучении рентгеновским излучением в дозе 0.1 Гр (4 мДж/см2). Полученные данные позволяют предположить схожий механизм активации естественной защиты организма при облучении малыми дозами как ионизирующего, так и неионизирующего излучений.
Известно, что биологические эффекты лазерных излучений зависят от длины волны, длительности воздействия, частоты импульсов, механизмов взаимодействия с облученной тканью и размера ее участка. Изучение механизмов воздействия этих излучений позволило создать различные приборы, применяемые в медицинской практике [1–3]. Созданные в середине восьмидесятых годов фемтосекундные лазеры (ФС), обладающие уникальными свойствами, совершили революцию не только в лазерной физике, но и в физике в целом. Длительность лазерных импульсов составляет от нескольких фс (10–15 с) до нескольких сотен фс. Основными преимуществами фемтосекундного излучения по сравнению с другими импульсными лазерами, помимо малой длительности импульсов, являются высокая пиковая (МВт) и малая средняя (мВт) мощности, что при низкой фокусировке предполагает отсутствие термических эффектов. Следует также учитывать, что большая плотность квантов света в ультракоротких импульсах позволяет запустить так называемые многофотонные процессы. Широкое применение ФС лазеры получили в медицине, в частности в офтальмологии, хирургии и других сферах.
Положительные терапевтические эффекты такие, как ускорение ранозаживления, усиление иммунной, нейроэндокринной и антиоксидантной систем, нормализующих уровень холестерина и фосфолипидов, а также эффективность в офтальмологоии, хирургии и других областях медицинской практики в основном наблюдаются при больших и средних мощностях низкоинтенсивных лазерных излучений [4]. Что касается биологических эффектов низких доз ФС лазерных излучений на организм млекопитающих in vivo, то в настоящий момент они недостаточно изучены, а отдельные имеющиеся результаты трудно сопоставимы в связи с использованием разных объектов, доз, энергий и особенностей оборудования. Количество работ по созданию новых лазеров и использованию их в медицине опережает количество работ по комплексному исследованию биологических реакций и их последствий у облученных животных.
Ранее, нами при изучении цитогенотоксических эффектов на мышах, предоблученных малыми дозами ионизирующего излучения (гамма и рентген) и затем дополнительно облученных большой дозой, был обнаружен защитный эффект, так называемый феномен “адаптивный ответа” (АО) [5]. Положительный эффект низких доз известен также как радиационный гормезис, который проявляется в качестве защитного эффекта различных форм жизнедеятельности организма [6]. Нами был получен эффект гормезиса на мышах, облученных рентгеновским излучением в дозе 0.1 Гр по продолжительности жизни [7]. Для сравнения этого феномена при действии малых доз ионизирующего излучения было проведено большое комплексное исследование влияния непрерывного низкоинтенсивного He–Ne лазерного (632.8 нм) и светодиодного инфракрасного (850 нм) излучений на клеточные реакции мышей, облученных нетерапевтическими низкими дозами, плотность потока энергии которых соответствовала энергиям адаптирующих доз ионизирующего излучения [8, 9]. Анализ результатов показал, что эти дозы не повышали уровня спонтанных цитогенетических повреждений, а при последующем облучении животных выявляющей дозой 1.5 Гр рентгеновского излучения (РИ) были также обнаружены значимые, одинаковые по величине защитные эффекты в той же области доз, как и у положительного контроля при предварительном облучении РИ. Полученные результаты позволили предположить связь индукции радиационного АО с известным феноменом активации естественной защиты организма (гормезис), что позволило в дальнейших модельных экспериментах на мышах использовать для ее выявления схему радиационного АО (0.1 Гр + 1.5 Гр через 1 сут).
В связи с вышеизложенным целью настоящей работы было проверить эффективность использования низких доз неионизирующего низкоинтенсивного импульсного ФС лазерного излучения (длина волны 525 нм, длительность импульса 200 фс) в качестве фактора активации естественной защиты с помощью теста радиационный “адаптивный ответ” в цельной крови и кроветворных органах мышей.
В работе использовали 2-месячных самцов белых нелинейных мышей закрытой популяции SHK (24–28 г), которые содержались в стандартных условиях вивария ИТЭБ РАН. Все манипуляции проводили согласно нормативно-правовым актам Федерации европейских научных ассоциаций о порядке экспериментальной работы с использованием животных (FELASA). План экспериментов был одобрен Комиссией ИТЭБ РАН по биологической безопасности и биоэтике (протокол № 8 от 17.02.2020). Животных облучали в область носа ФС лазерным излучением (525 нм, 200 фc, частота импульсов 70 МГц), при мощности 0.5 мВт в течение 5, 10 и 50 с, что соответствует рассчитанным величинам плотности потока энергии (флюенса) 5.1, 10.4 и 52 мДж/см2. Эти дозы облучения брали исходя из результатов, полученных при действии He–Ne лазерного излучения и РИ на мышей, для которых ранее была определена область доз, активирующих естественную защиту (2–16 мДж/см2) [10].
В качестве положительного контроля животных облучали по той же схеме АО рентгеновским излучением в дозах 0.1 и 0.5 Гр на установке РУТ (4 и 20 мДж/см2, 0.1 Гр/мин, 200 кВ, 2 кэВ/мкм, 8 мА, 1.0 мм Cu и 1.0 мм Al), (ЦКП “Источники излучения” ИБК РАН, Пущино). Через сутки все группы животных дополнительно облучали РИ в дозе 1.5 Гр (60 мДж/см2), а через 28 ч после этого животных выводили из эксперимента методом декапитации и производили забор органов и тканей. На каждую экспериментальную точку использовали не менее 5 мышей.
С помощью стандартных методик были определены уровень цитогенетических повреждений в костном мозге подсчетом полихроматофильных (ПХЭ) эритроцитов с микроядрами (МЯ) [11], клеточность тимуса и селезенки по отношению среднего абсолютного веса органа к среднему весу животного в группе, а также показатели клеточного состава цельной крови с помощью прибора Beckman Coulter. Достоверность различий между группами оценивали с помощью непараметрического критерия U Манна–Уитни. Вероятность ошибки p < 0.05 считали достаточной для вывода о статистической значимости различий полученных данных.
В табл. 1 представлены данные по измерению количества цитогенетических повреждений после облучения мышей адаптирующими дозами исследованных источников излучений и через 28 ч выявляющей дозой 1.5 Гр РИ. Видно, что в данном диапазоне плотности потока энергии не увеличивался уровень спонтанных цитогенетических повреждений (необлученный контроль). Предварительная обработка животных ФС лазерным излучением при плотности потока 10.4 мДж/см2 и последующим воздействием рентгеновского излучения в дозе 1.5 Гр по схеме радиационного АО вызывала уменьшение цитогенетических повреждений в клетках костного мозга, т.е. активировала естественную защиту. Другие плотности потока ФС лазерного излучения не вызывали защитного эффекта, что совпало с положительным контролем в той же области доз.
Таблица 1.
Количество полихроматофильных эритроцитов с микроядрами в клетках костного мозга мышей, предоблученных малыми дозами ФС лазера и РИ, и затем облученных в дозе 1.5 Гр
| Условие опыта | Число мышей | Поглощенная энергия, мДж | Плотность потока энергии, мДж/см2 доза излучения | Число ПХЭ | Число ПХЭ с МЯ | Доля ПХЭ с МЯ, % |
|---|---|---|---|---|---|---|
| Фемтосекундный лазер | ||||||
| 0 чистый | 10 | 20 000 | 99 | 0.49 ± 0.09 | ||
| 5 с | 5 | 0.3 ± 0.1 | 5.1 ± 0.5 | 20 000 | 81 | 0.41 ± 0.13 |
| 10 с | 5 | 1.5 ± 0.5 | 10.4 ± 3.5 | 20 000 | 76 | 0.38 ± 0.11 |
| 50 с | 5 | 7.5 ± 2.5 | 52 ± 16 | 20 000 | 95 | 0.48 ± 0.15 |
| 5 с + 1.5 Гр | 5 | 15 000 | 883 | 5.90 ± 0.20 | ||
| 10 с + 1.5 Гр | 5 | 17 000 | 819 | 4.82 ± 0.27* | ||
| 50 с + 1.5 Гр | 5 | 15 000 | 1010 | 6.70 ± 0.10 | ||
| Рентгеновское излучение | ||||||
| 0.1 Гр | 5 | 1.6 | 4 | 20 000 | 86 | 0.43 ± 0.03 |
| 0.5 Гр | 5 | 8 | 20 | 20 000 | 697 | 3.50 ± 0.11 |
| 0.1 Гр + 1.5 Гр | 5 | 20 000 | 692 | 3.46 ± 0.17* | ||
| 0.5 Гр + 1.5 Гр | 5 | 20 000 | 1206 | 6.03 ± 0.17 | ||
| 1.5 Гр | 10 | 24 | 60 | 20 000 | 1347 | 6.70 ± 0.03 |
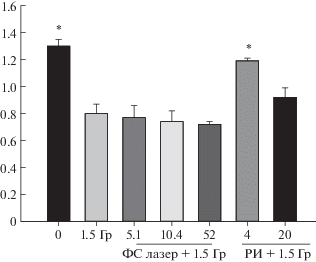
Одновременно с измерением цитогенетических повреждений в костном мозге мышей измеряли индексы массы тимуса и селезенки, которые практически не отличались от таковых значений у необлученных, контрольных животных. В то время как при облучении мышей только в дозе 1.5 Гр индекс массы тимуса снижался на 40% (рис. 1). Предобработка мышей ФС лазерным излучением и последующим облучением в дозе 1.5 Гр не восстанавливала индекс массы тимуса до контрольного значения, в отличие от рентгеновского излучения в дозе 4 мДж/см2. Аналогичные данные были получены на селезенке.
Рис. 1.
Зависимости индекса массы тимусов у мышей, облученных адаптирующими дозами ФС лазерного излучения и РИ, и затем облученных в дозе 1.5 Гр от величины адаптирующей дозы.
*– p < 0.05 по сравнению c группой животных, облученных в дозе 1.5 Гр.
На рис. 2 показано влияние различных доз ФС лазерного излучения на такие показатели формулы крови как концентрация лейкоцитов, эритроцитов, тромбоцитов и уровень гемоглобина и гематокрита при последующем облучении выявляющей дозой в 1.5 Гр. На рис. 2а, 2б, 2в отмечено значительное снижение концентрации лейкоцитов и тромбоцитов (на 40–45%), в то время как уровень гемоглобина, гематокрита и концентрация эритроцитов (рис. 2б, 2г, 2д) снизились на меньшую величину – ≈15–20%. При этом действие фактора активации естественной защиты (4 мДж/см2 +1.5 Гр), т.е. облучение дозой 0.1 Гр и затем выявляющей дозой 1.5 Гр не оказало ожидаемого эффекта на исследуемые показатели крови, т.е. не индуцировало адаптивного ответа организма по данному критерию.
Рис. 2.
Зависимость изменений показателей крови мышей, облученных адаптирующими дозами ФС лазерного излучения и РИ, и затем облученных в дозе 1.5 Гр от величины адаптирующей дозы. Данные представлены как M ± SD, уровень значимости: * – p ≤ 0.05 относительно 0, ** – p ≤ 0.05 относительно 1.5 Гр; *** – p ≤ 0.05 относительно 4 мДж/см2 + + 1.5 Гр; # – p ≤ 0.05 относительно ФС лазерного излучения 5.1 мДж/см2 + 1.5 Гр (ANOVA с тестом Бонферрони n = 16 (контроль, 0), n = 10 (1.5 Гр); n = 5 (все остальные группы).
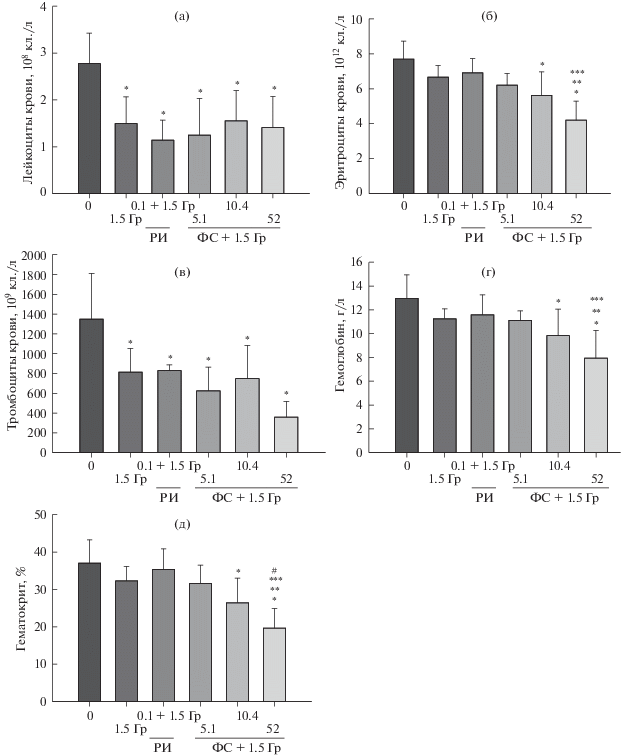
Воздействие адаптирующими дозами низкоинтенсивного ФС лазерного излучения и РИ в дозе 0.1 Гр и затем выявляющей дозой 1.5 Гр достоверно показало, что увеличение дозы облучения от 5.1 до 52 мДж/см2 (5–50 с) ведет к увеличению повреждающего действия на показатели крови, что максимально наглядно сказалось на снижении концентрации тромбоцитов, эритроцитов, уровня гематокрита и гемоглобина.
В связи с вышеизложенным можно заключить, что исследование показателей крови через 28 ч после выявляющего облучения в дозе 1.5 Гр не способствовало нормализации показателей крови, т.е. развитию АО, что может быть связано с необходимостью более длительного времени для его проявления.
В результате проведенных экспериментов было обнаружено, что при воздействии на мышей неионизирующим низкоинтенсивным импульсным ФС лазерным излучением в низких дозах наблюдается защитный эффект по тесту радиационный “адаптивный ответ” в том же узком диапазоне плотности потока энергии, как и при облучении рентгеновским излучением в дозе 0.1 Гр (4 мДж/см2).
В настоящий момент существует большое количество предположений и различных гипотез механизмов активации естественной защиты организма при легких стрессах, вызванных низкими дозами различных физических (ионизирующие и неионизирующие излучения) и химических агентов, главным образом в связи с такими феноменами малых воздействий, как гормезис и АО. Известно, что все они активируются в одной или очень близкой области доз (плотность потока энергии) в зависимости от условий. Что является триггером этих процессов, до сих пор не известно.
Установлено, что действие лазерного и светодиодного излучения низкой интенсивности на биологические объекты приводит к резкому повышению иммунитета, запуску механизма гипериндукции эндогенного интерферона, вызывает дозозависимые изменения продукции цитокинов (ИЛ-2, ИЛ-3, ИЛ-6), оксида азота и активности естественных киллерных клеток мышей [12–14].
Показаны роль контроля транскрипции и активации процессов репарации ДНК и антиоксидантных систем [15–19], фотоакцепторных молекул цитохром с-оксидазы – терминального фермента электрон-транспортной цепи митохондрий [20], железо- и медь-содержащих ферментов, таких как супероксиддисмутаза, каталаза и церулоплазмин, участвующих в антиокислительных процессах [21], пути выживания и смерти клеток (апоптоза), UPR ответа (эндоплазматический ответ на стресс) и других цитопротективных процессов, включая аутофагию и регуляцию клеточного цикла [22] в отношении феноменов гормезиса и АО при воздействии низкоинтенсивных ионизирующих, лазерных, светодиодных излучений и химических агентов на организм как in vitro, так и in vivo.
По количеству факторов, запускающих процессы гормезиса и АО, свидетельствующих об активации естественной защиты организма и количеству реакций организма в одной и той же области потоков энергии, нам кажется, что триггерный механизм естественной защиты организма неспецифичен.
Полученные данные позволяют предположить схожий механизм активации естественной защиты организма при облучении малыми дозами как ионизирующего, так и неионизирующего излучений.
Список литературы
Мусаев М.М. // Лазерная медицина. 2016. Т. 20. № 2. С. 16–20.
Khadartsev A.A., Moskvin S.V. Laser blood illumination. The main therapeutic techniques. Moscow–Tver, 2018.
Ma L.Y., Rong A., Jiang Y., Deng S.Y. // Ophthalmology and therapy. 2021. V. 10. P. 137–150.
Москвин С.В. Основы лазерной терапии. Серия “Эффективная лазерная терапия”. Т. 1. М.-Тверь: ООО “Издательство “Триада”, 2016. 896 с.
Zaichkina S.I., Klokov D.I., Rozanova O.M., et al. // Genetika. 1998. T. 34. № 7. C. 1013–1016.
Кузин А.М. // Радиобиология. 1985. Т. 31. № 1. С. 16–21.
Балакин В.Е., Заичкина С.И., Клоков Д.Ю., и др. // Доклад РАН. 1998. Т. 363. № 6. С. 843–845.
Дюкина А.Р., Заичкина С.И., Розанова О.М. // Радиац. биол. Радиоэкология. 2011, Т. 51. № 5. С. 536–541.
Дюкина А.Р., Заичкина С.И., Розанова О.М. и др. // Мед. физика. 2014. № 4. Т. 64. С. 37–45.
Заичкина С.И., Дюкина А.Р., Розанова О.М. и др. // Бюл. эксп. биол. и мед. 2016. № 1. Т. 161. С. 32–35.
Schmid W. // Mutat. Res. 1975. V. 31. № 1. P. 9–15.
Чудновский В.М., Леонова Г.Н., Скопинов С.А., Дроздов А.Л. Биологические модели и физические механизмы лазерной терапии. Вл-ток: Дальнаука, 2002. 157 с.
Черенков Д.А., Глушкова О.В., Новосёлова Е.Г. и др. // Медицинская иммунология. 2005. Т. 7. № 2–3. С. 330.
Новоселова Т.В., Хренов М.О., Лунин С.М. и др. // Биофизика. 2006. Т. 1. № 51. С. 123–135.
Guo G., Yan-Sanders Y., Lyn-Cook B.D. et al. // Mol. Cell. Biol. 2003. V. 23. P. 2362–2378.
Murley J.S., Baker K.L., Miller R.C. et al. // Free Radic. Biol. Med. 2011. V. 51. P. 1918–1925.
Hou J., Wang F., Kong, P. et al. // PLoS ONE. 2015. V.10. № 4. e0123316.
Gal P., Stausholm M.B., Kovac I. at al. // Lasers in Medical Science. 2018. V. 33. № 6. P. 1351–1362.
Kabilan U., Graber T.E., Alain T., Klokov D. // Int. J. Mol. Sci. 2020. V. 21. № 18. P. 6650.
Elles J.T., Wong-Riley M.T., VerHoeve J. et al. // Mitochondrion. 2004. V. 4. № 5–6. P. 559–567.
Владимиров Ю.А., Клебанов Г.И., Борисенко Г.Г., Осипов А.Н. // Биофизика. 2004. Т. 49. № 2. С. 339–350.
Gueguen Y., Bontemps A., Ebrahimian T.G. // Cell. Mol. Life Sci. 2019. V. 76. P. 1255–1273.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


