Доклады Российской академии наук. Науки о жизни, 2021, T. 501, № 1, стр. 551-556
ПЕРОКСИД-ИНДУЦИРОВАННАЯ ОКИСЛИТЕЛЬНАЯ МОДИФИКАЦИЯ ПЛАЗМИНОГЕНА
А. Д. Васильева 1, *, В. С. Иванов 1, Л. В. Юрина 1, М. И. Индейкина 1, 3, А. Е. Бугрова 1, А. С. Кононихин 2, член-корреспондент РАН Е. Н. Николаев 4, М. А. Розенфельд 1
1 Федеральное государственное бюджетное учреждение науки Институт биохимической физики
им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Учреждение Российской академии наук Институт энергетических проблем химической физики
имени В.Л. Тальрозе РАН
Москва, Россия
3 Федеральное государственное автономное образовательное учреждение высшего образования “Московский физико-технический институт (государственный университет)”
Долгопрудный, Россия
4 Автономная некоммерческая образовательная организация высшего профессионального образования “Сколковский институт науки и технологий”
Московская обл, деревня Сколково, Россия
* E-mail: alexandra.d.vasilyeva@gmail.com
Поступила в редакцию 19.05.2021
После доработки 16.07.2021
Принята к публикации 17.07.2021
Аннотация
Плазминоген является зимогеном плазмина, фермента, который играет фундаментальную роль в растворении фибриновых сгустков и во многих других физиологических процессах. Впервые методом хромато-масс-спектрометрии были выявлены посттрансляционые модификации в первичной структуре плазминогена, обработанного физиологически релевантными количествами перекиси водорода. Установлено, что мишенями окислителя являлись остатки метионина и триптофана, локализованные в различных структурных областях плазминогена. Показано, что окисление плазминогена вызывало доз-зависимый эффект снижения фибриногенолитической активности плазмина, оцениваемой по образованию продуктов деградации фибриногена. Обсуждается возможная антиоксидантная роль метионинов в окислительной модификации плазминогена.
Плазминоген/плазмин функционирует как наиболее важная внеклеточная протеазная система in vivo, вовлекаясь в целый ряд патофизиологических процессов, включая тромбоз и кровотечение, заживление ран, воспаления, инсульты, инфаркты и многие другие [1, 2].
Нативная форма плазминогена (Glu-плазминоген) человека представляет собой полипептидную цепь, содержащую 791 аминокислотный остаток (Glu1-Asn791). Пространственная укладка цепи образует ряд глобулярных модулей: N-терминальный, так называемый PAN-apple домен (PAp), пять гомологичных крингл-доменов (КР1–КР5), структура каждого из которых стабилизирована тремя дисульфидными связями, сериновый протеазный домен (SP), содержащий каноническую для всех сериновых протеаз каталитическую триаду остатков His603, Asp646 и Ser741, а также гибкий линкер, соединяющий домены KР4 и KР5 между собой [3]. Крингл-домены содержат сайты связывания лизина, которые позволяют плазминогену связывать фибрин и другие субстраты, содержащие N-концевые лизины [4]. Glu-плазминоген находится в закрытой, устойчивой к активации конформации, в которой остатки лизина и аргинина (в частности, Lys50, Arg68 и Arg70), присутствующие на N-концевом домене PAp, связываются с лиганд-связывающими сайтами КР-4 и КР-5. Таким образом, закрытая конформация Glu- плазминогена частично опосредуется междоменными взаимодействиями через сайты связывания лизина [5].
Плазминоген может быть активирован в плазмин путем расщепления связи Arg561-Val562. N-концевая часть цепи (Glu1-Arg561) образует цепь А, которая ковалентно связана с цепью B (Ala562-Asn791) посредством дисульфидных связей Cys548-Cys666 и Cys558-Cys566.
В настоящее время общепризнано, что белки выступают в качестве основной мишени для активных форм кислорода (АФК) [6]. Эти производные кислорода способны повреждать белки, что оказывает влияние на их структуру, проявляющееся в более или менее выраженной потере ими свойственных им биохимических функций.
Ранее методом тандемной масс-спектрометрии [7] были идентифицированы сайты, модифицированные гипохлорит-индуцированным окислением молекулы плазминогена.
Перекись водорода (H2O2) является существенно менее агрессивным окислителем по сравнению с гипохлоритом. Она вырабатывается большинством клеток человеческого тела. Поступление в плазму H2O2, генерируемой во внутриклеточном пространстве клеток крови, незначительно по сравнению с генерацией H2O2 из источников в плазме крови или на внешней поверхности клеток [8]. Помимо НАДФН-оксидаз, плазматические мембраны фагоцитов, эндотелиальные клетки и тромбоциты вносят значительный вклад в генерацию плазменного H2O2 [9, 10]. Как полагают [8], значения концентрации H2O2 в плазме могут находиться в диапазоне от нескольких мкМ до сотен мкМ, в то время как некоторые авторы [11] сообщают, что концентрация H2O2 в плазме человека может быть существенно выше и достигать 100 мМ.
В данной работе впервые была предпринята попытка исследовать действие H2O2-индуцированного окисления плазминогена на модификацию отдельных сайтов в его первичной структуре, а также нарушение фибриногенолитической (гидролиз фибриногена) активности плазмина, образованного при активации окисленного плазминогена.
Glu-плазминоген был выделен из плазмы крови доноров методом аффинной хроматографии на лизин-активированной CNBr Sepharose 4B (Sigma-Aldrich), как описано ранее [12]. Фибриноген был получен из цитратной плазмы крови человека методом глицинового осаждения [7].
Превращение плазминогена в плазмин осуществляли стрептокиназой (Bechringwerke, Германия) в молярном соотношении 100/1 (плазминоген/стрептокиназа) [7]. Время инкубации смеси плазминогена и стрептокиназы составляло 40 мин при 37°С.
Фибриногенолитическая активность плазмина оценивалась по накоплению продуктов гидролиза фибриногена с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS) по методике Laemmli.
Окисление плазминогена было индуцировано H2O2 (Sigma-Aldrich) в широком диапазоне концентраций окислителя, равным 50–400 мкМ при концентрации субстрата реакции 1 мкМ. После инкубации белка с окислителем (60 мин при 37°С) реакция была остановлена добавлением в каждый образец десятикратного молярного избытка L-метионина по отношению к окислителю. Для последующих работ (и избавления от метионина) образцы переводились в исходный буфер с использованием ультрацентрифужных фильтров Amicon Ultra, 10 КДа (Millipore, Ирландия).
Анализ, проведенный методом высокоэффективной жидкостной хроматографии, совмещенный с тандемной масс-спектрометрией (ВЭЖХ-МС/МС), проводился на системе, включающей хроматограф Agilent 1100 c системой автоматического отбора проб (Agilent Technologies Inc., Santa Clara, USA) и тандемного масс-спектрометра 7T LTQ-FT Ultra (Thermo, Bremen, Germany) [13, 14]. При подготовке проб образцы обрабатывались дитиотреитолом (DTT) для восстановления дисульфидных связей c последующим алкилированием йодоацетоамидом и гидролизом трипсином (Promega, USA). Триптические пептиды были идентифицированы с помощью программного обеспечения PEAKS Studio (V. 8.5, Bioinformatics Solutions Inc., Waterloo, On, Canada). Для получения результатов было выполнено три независимых эксперимента, каждый из которых выполнялся в трех повторностях. При сравнении результатов учитывались аминокислоты, не окисленные в контроле, а также те, уровень окисления которых по сравнению с контролем, возрастал более чем на 1%.
Результаты электрофореза свидетельствуют о том, что при обработке белка окислителем во всем диапазоне концентраций плазминоген сохранял исходную гомогенность, т.е. не наблюдалось ни фрагментации белка, ни межцепочечного сшивания (рис. 1). Этот результат хорошо согласуется с полученными ранее электрофоретическими данными, которые также демонстрировали сохранение целостности полипептидной цепи плазминогена, обработанного гипохлоритом [7].
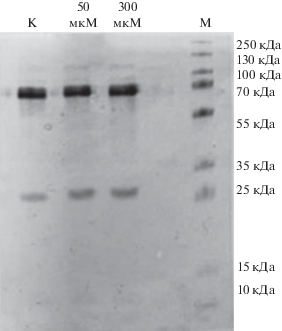
Рис. 1.
Эффект Н2О2 на молекулу плазминогена. Электрофореграмма свидетельствует об отсутствии каких-либо видимых нарушений в гомогенности полипептидной цепи белка. Полоса М соответствует молекулярным массам белковых маркеров.

Индуцированная стрептокиназой активация плазминогена, как видно из рис. 2, вызывала образование плазмина, о чем свидетельствуют два продукта активации, тяжелая (А) и легкая (В) полипептидные цепи, соответствующие молекулярным массам цепей плазмина, 70 и 25 кДа соответственно. Действие 50 и 300 мкМ Н2О2 на плазминоген не оказывало влияния на его расщепление стрептокиназой.
Рис. 2.
Влияние H2О2 на активацию стрептокиназой плазминогена. Как следует из результата электрофореза, активация стрептокиназой нативного плазминогена продуцировала два основных пептида (полоса К), соответствующих тяжелой А, (~70 кДа) и легкой В (~25 кДа) цепям плазмина. Активация стрептокиназой плазминогена, окисленного 50 (1) и 300 мкМ (2) Н2О2, не сопровождалась изменениями в электрофоретической подвижности А и В полипептидных цепей плазмина. Полоса М – молекулярные массы белковых маркеров.
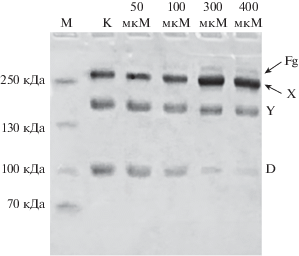
Согласно данным ПААГ-электрофореза, обработка плазминогена 50 и 100 мкМ Н2О2 практически не влияла на гидролиз фибриногена, так как спектр продуктов деградации и их количество не отличались от свойственных контрольному образцу (рис. 3). Однако обработка исходного плазминогена 300 и 400 мкМ окислителя приводила к уменьшению накопленного фрагмента D и сохранению остаточного фибриногена в смеси (рис. 3).
Рис. 3.
Фибриногенолитическая активность плазмина, образованного из окисленного плазминогена, обработанного разными количествами Н2О2. Как видно из электрофореграммы, активность плазмина снижается, что проявляется в уменьшении содержания конечного продукта деградации фибриногена, фрагмента D, и сохранении остаточного фибриногена. Полоса М – молекулярные массы белковых маркеров.
Методом масс-спектрометрии высокого разрешения были проанализированы образцы плазминогена, подвергавшиеся воздействию 50 и 300 мкМ Н2О2. Модифицированные аминокислотные остатки и типы их модификации, обусловленные Н2О2-индуцированным повреждением белка, показаны в табл. 1.
Таблица 1.
Степени окисления идентифицированных аминокислотных остатков в плазминогене, обработанных 50 и 300 мкМ Н2О2, и типы окислительных модификаций
| Модификация | Аминокислот- ный остаток | 50 мкМ H2O2/1 мкМ плазминогена, % (± ст. отклон.) | 300 мкМ H2O2/1 мкМ плазминогена, % (± ст. отклон.) |
|---|---|---|---|
| Окисление | Met 57 | 47.5 ± 7.9 | 60.0 ± 5.4 |
| Окисление | Trp 108 | 20.9 ± 3.9 | 20.1 ± 5.1 |
| Окисление | Met 182 | 0.0 | 42.2 ± 10.3 |
| Окисление | Trp 235 | 3.9 ± 0.7 | 3.4 ± 1.3 |
| Диокисление | Trp 235 | 16.5 ± 1.4 | 19.1 ± 0.9 |
| Диокисление | Tyr 304 | 2.5 ± 0.3 | 2.1 ± 0.8 |
| Окисление | Met 385 | 29.7 ± 13.3 | 73.9 ± 8.6 |
| Диокисление | Trp 382 | 0.5 ± 0.04 | 5.6 ± 1.84 |
| Окисление | Trp 382 | 0.0 | 1.7 ± 0.5 |
| Окисление | Met 404 | 69.1 ± 7.6 | 84.6 ± 3.7 |
| Окисление | Trp 417 | 18.2 ± 1.3 | 22.8 ± 2.5 |
| Окисление | Trp 427 | 38.6 ± 7.5 | 70.3 ± 9.2 |
| Окисление | Met 463 | 33.3 ± 12.9 | 100.0 ± 0.0 |
| Окисление | Met 585 | 95.5 ± 2.4 | 100.0 ± 0.0 |
| Окисление | Met 788 | 12.8 ± 7.4 | 85.7 ± 2.9 |
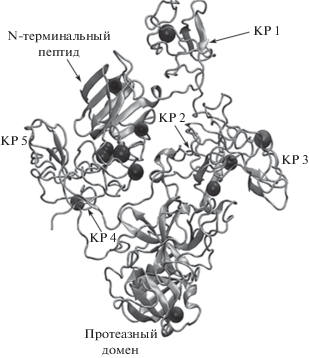
Повышение дозы окислителя с 50 до 300 мкМ Н2О2 способствовало увеличению степени окисления большинства идентифицированных остатков таких, как Met57, локализованный в PAp домене; в домене КР4 – Met385, Met404, Trp417 и Trp427; в КР5 – Met463 и в каталитическом домене – Met585, Met788. В то же время степень окисления Trp108, Trp235 и Trp417, расположенных в доменах КР1, КР2 и КР4, соответственно, практически не изменялась и, кроме того, наблюдалось вовлечение в окислительную модификацию дополнительных двух остатков, Met182 и Trp382, локализованных в структуре КР2 и КР4, соответственно, степень окисления которых при действии 50 мкМ Н2О2 (рис. 4) не отличалась от таковой в контрольном образце. Этот эффект, вероятно, связан с конформационными превращениями в молекуле плазминогена при действии 300 мкМ Н2О2, делающих эти два остатка более пространственно доступными для окислителя.
Рис. 4.
3D-структура (PDB ID: 4DUU) плазминогена с обозначенными модификациями аминокислотных остатков (черные шары) при окислении белка 300 мкМ перекиси водорода.
Сравнение окислительных сайтов, возникающих в плазминогене при его обработке Н2О2 или гипохлоритом [7], обнаруживает ряд общих модифицированных остатков метионина, Met57, Met182, Met385, Met404, Met585 и Met 788 и один остаток триптофана, Trp235, в то время как некоторые остатки, Met463, Trp108, Trp382, Trp417 и Trp427, подвергаются модификации только под влиянием Н2О2. Что касается метионинов, по всей видимости, Met57, Met404 и Met585 можно рассматривать в качестве антиоксидантных остатков, поскольку они являются общими и наиболее легко окисляемыми для обоих окислителей. Известно, что антиоксидантные метионины локализованы на поверхности белковой глобулы и являются высоко уязвимой мишенью для различных активных форм кислорода (АФК) [15]. Интересно также отметить, что, как указывалось выше, степень окисления некоторых остатков, как, например, Trp108, Trp235 и Trp417 не меняется или меняется крайне незначительно при увеличении концентрации окислителя в 6 раз. Этот феномен может быть обусловлен также антиоксидантной ролью метионинов, которые перехватывают значительную часть окислителя при его увеличивающемся количестве, сохраняя таким образом умеренным окисление других остатков, некоторые из которых могут быть функционально значимыми. Кроме того, нельзя исключить возможность сохранения антиоксидантными метионинами целостности и других, важных в функциональном отношении остатков плазминогена. Идентификация этих остатков представляет огромную важность для понимания функционирования плазминогена в среде, генерирующей АФК, и является предметом будущих исследований.
Список литературы
Murray V., Norrving B., Sandercock P., et al. The molecular basis of thrombolysis and its clinical application in stroke // J. Intern. Med. 2010. V. 267. P. 191–208.
Weisel J.W. Fibrinogen and fibrin // Adv. Protein Chem. 2005. V. 70. P. 247–299.
Castellino F., Ploplis V. Structure and function of the plasminogen/plasmin system // Thromb. Haemost. 2005. V. 93. P. 647–654.
Miles L.A., Dahlberg C.M., Plow E.F. The cell-binding domains of plasminogen and their function in plasma // J. Biol. Chem. 1988. V. 263. P.11928–11934.
Law R.H., Caradoc-Davies T., Cowieson N., et al. The X-ray crystal structure of full-length human plasminogen // Cell Rep. 2012. V. 1. P. 185–190.
Davies M.J. Protein oxidation and peroxidation // Biochem. J. 2016. V. 473. P. 805–825.
Васильева А.Д., Юрина Л.В., Щеголихин А.Н. и др. Гипохлорит-индуцированная окислительная модификация плазминогена: структурно-функциональные нарушения // Доклады Российской академии наук. Науки о жизни. 2019. Т. 488. № 5. С. 560–566.
Forman H.J., Bernardo A., Davies K.J. What is the concentration of hydrogen peroxide in blood and plasma? // Arch. Biochem. Biophys. 2016. V. 603. P. 48–53.
Root R.K., Metcalf J., Oshino N., Chance B. H2O2 release from human granulocytes during phagocytosis. I. Documentation, quantitation, and some regulating factors // J. Clin. Invest. 1975. V. 55. P. 945–955.
Pastori D., Pignatelli P., Carnevale R., Violi F. Nox-2 up-regulation and platelet activation: Novel insights // Prostaglandins Other Lipid Mediators. 2015. V. 120. P. 50–55.
Cavarocchi N.C., England M.D., Schaff H.V., et al. Oxygen free radical generation during cardiopulmonary bypass: correlation with complement activation // Circulation. 1986. V. 74. P. 130–133.
Deutsch D.G., Mertz E.T. Plasminogen: purification from human plasma by affinity chromatography // Science. 1970. V. 170. P. 1095–1096.
Galetskiy D., Lohscheider J.N., Kononikhin A.S., et al. Mass spectrometric characterization of photooxidative protein modifications in Arabidopsis thaliana thylakoid membranes // Rapid Commun. Mass Spectrom. 2011. V. 25. P. 184–190.
Vasilyeva A.D., Yurina L.V., Indeykina M.I., et al. Oxidation-induced modifications of the catalytic subunits of plasma fibrin-stabilizing factor at the different stages of its activation identified by mass spectrometry // BBA—Proteins and Proteomics. 2018. V. 1866. P. 875–884.
Lim J., Kim G., Levine R. Methionine in Proteins: It’s not just for protein initiation anymore // Neurochem. Res. 2019. V. 44. P. 1–11.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


