Доклады Российской академии наук. Науки о жизни, 2021, T. 501, № 1, стр. 569-572
Влияние альфа-фетопротеина на дифференцировку миелоидных супрессорных клеток
С. А. Заморина 1, 2, *, К. Ю. Шардина 1, В. П. Тимганова 1, М. С. Бочкова 1, 2, С. В. Ужвиюк 1, М. Б. Раев 1, 2, академик РАН В. А. Черешнев 1, 2
1 Институт экологии и генетики микроорганизмов Уральского отделения Российской академии наук, филиал ПФИЦ УрО РАН
Пермь, Россия
2 Пермский государственный национальный исследовательский университет
Пермь, Россия
* E-mail: mantissa7@mail.ru
Поступила в редакцию 30.04.2021
После доработки 06.09.2021
Принята к публикации 07.09.2021
Аннотация
Изучали влияние рекомбинантного альфа-фетопротеина (АФП) на дифференцировку миелоидных супрессорных клеток человека (MDSC) в условиях культивирования in vitro в присутствии цитокинов IL-6 (10 нг/мл) и GM-CSF (10 нг/мл). Установлено, что АФП в концентрациях 50 и 100 МЕ/мл повышал количество MDSC (CD33+HLA-DR-/lowCD11b+) в культуре, при анализе субпопуляций MDSC было показано, что повышение происходило за счет моноцитарных М-MDSC (HLA-DR–/lowCD33+CD11b+CD14+CD66b–). Не выявлено модулирующего эффекта АФП на гранулоцитарные PMN-MDSC (HLA-DR–/lowCD33+CD11b+CD14–CD66b+). Таким образом, впервые продемонстрированы эффекты рекомбинантного АФП в отношении дифференцировки MDSC.
Во время беременности иммунная система матери подвергается аллоиммунизации фетоплацентарными антигенами. В результате формируется динамическое состояние иммунной толерантности, в поддержании которого важную роль играют белки, ассоциированные с беременностью. Альфа-фетопротеин (АФП) – одноцепочечный гликопротеин (Mr 68–75 кДа, 3–5% углеводов), который синтезируется в период раннего развития эмбриона в желточном мешке, а затем в печени и желудочно-кишечном тракте плода. Во время беременности концентрация АФП в крови растет, достигая значений 150–250 МЕ/мл, после родов его уровень резко снижается [1].
На данный момент времени роль АФП в регуляции факторов иммунной толерантности в период беременности находится в стадии изучения [2]. Так, известно, что АФП способен регулировать дифференцировку и функциональную активность таких значимых субпопуляций клеток иммунной системы, как Т-регуляторные лимфоциты (Treg), ИЛ-17-продуцирующие Т-клетки (Th17), Т-клетки иммунной памяти, NK-клетки [цит. по 3]. Однако до сих пор не исследована роль АФП в регуляции ключевой популяции клеток, отвечающей за иммуносупрессию – миелоидных супрессорных клеток (myeloid-derived suppressor cells, MDSC). MDSC – гетерогенная популяция незрелых клеток миелоидного происхождения, которые при патологических состояниях приобретают супрессорный фенотип, подавляющий иммунный ответ [4]. Миелоидные супрессорные клетки в первую очередь ассоциированы с онкологическими процессами: так, известно, что ликвидация MDSC из опухолевого микроокружения повышает выживаемость онкологических больных [5]. С момента открытия MDSC накопилось большое количество данных о фенотипе, функциях и механизмах действия MDSC, в том числе стало известно, что уровень MDSC увеличивается при многих патологических состояниях, таких как травматический шок, сепсис, аутоиммунные заболевания, воспаление и даже старение [6]. С 2014 г. известно, что уровень MDSC повышается также и во время беременности [7], а затем был идентифицирован рецептор для АФП (AFPR) на этих клетках [8].
Таким образом, целью работы являлась оценка влияния АФП на дифференцировку MDSC человека в условиях in vitro.
В результате проведенных исследований впервые показано, что АФП в физиологических концентрациях участвует в регуляции дифференцировки MDSC, повышая количество этих клеток. Обнаруженные нами эффекты свидетельствуют о том, что АФП может участвовать в формировании периферической иммунной толерантности матери к полуаллогенному эмбриону.
Исследование проводили в соответствии с Хельсинкской Декларацией ВМА 2000 г. и протоколом Конвенции Совета Европы о правах человека и биомедицине 1999 г., на используемую экспериментальную схему получено разрешение Этического комитета “ИЭГМ УрО РАН” (IRB00010009) от 30.08.2019. В работе использовали мононуклеарные клетки периферической крови (МПК) доноров, которыми являлись здоровые небеременные женщины репродуктивного возраста (n = 6). МПК получали центрифугированием в градиенте плотности фиколла–верографина (d = 1.077 г/см3). Монокультуры СD33+-клеток получали методом иммуномагнитной сепарации с использованием технологии MACS® (“Miltenyi Biotec”, Германия) из суспензии МПК. Для оценки влияния АФП на дифференцировку MDSC использовали экспериментальную модель, основанную на индукции миелоидных клеток периферической крови (CD33+) в фенотип MDSC при помощи цитокинов ИЛ-6 и ГМ-КСФ, где ИЛ-6 создает провоспалительный цитокиновый фон, а ГМ-КСФ является ростовым сигналом для миелоидных клеток [9]. Таким образом, СD33+-клетки культивировали в 96-луночном планшете в концентрации 1 × 106 клеток/мл в течение 7 сут (37°С, 5%СО2) в полной питательной среде (RPMI-1640, 10% FBS, 10 мМ Hepes, 2 мМ L-глутамина (“ICN Рh.”, США) с добавлением пенициллина-стрептомицина-амфотерицина (100 мкл на 10 мл среды, “BI”, Израиль)) и рекомбинантных цитокинов ИЛ-6 (10 нг/мл) и ГМ-КСФ (10 нг/мл) (“Milteniy Biotech”, Германия). Замена среды в культуре производилась на 4-е сутки, тогда же вносили АФП. В работе использовали рекомбинантный препарат АФП (“Prospec”, Израиль) в физиологических концентрациях (10, 50 и 100 МЕ/мл [10]). После этого клетки культивировались 3 сут, после чего их собирали при помощи аккутазы согласно рекомендациям производителя (“Capricorn Scientific”, Германия). По окончании инкубирования производили окрашивание клеток на жизнеспособность суправитальным красителем Zombie Aqua (ZA) (“Biolegend”, США) согласно протоколу производителя. Процент живых (ZA–) клеток в культурах колебался в пределах 85.5–92.1%, достоверных различий между культурами выявлено не было.
После стандартных процедур отмывок клетки окрашивали антителами для цитофлуориметрического определения процента MDSC (HLA-DR–/lowCD33+CD11b+) (рис. 1а), а также моноцитарных M-MDSC (HLA-DR–/lowCD33+CD11b+CD14+CD66b–) и гранулоцитарных PMN-MDSC (HLA–/lowDR–CD33+CD11b+CD14–CD66b+). Окрашивание производили антителами к HLA-DR-Alexa Fluor 750, CD33-APC, CD11b-Alexa Fluor 405, CD66b-PE и CD14-PerCP (все “R&D Systems”, США) по стандартной методике поверхностного окрашивания. Определение процента субпопуляций клеток (MDSC, M-MDSC, PMN-MDSC) проводили на цитометре СytoFLEX S (“Beckman Coulter”, США). Файлы данных проточной цитометрии были проанализированы с помощью программы “KALUZA Analysis Software”. Статистическую обработку данных осуществляли в GraphPad Prism 8, с использованием непараметрического критерия Манна–Уитни.
Рис. 1.
Влияние АФП на уровень MDSC в культурах изолированных миелоидных клеток (CD33+), индуцированных цитокинами IL-6 и GM-CSF (n = 6; M(Q1–Q3)).
(а) Уровень MDSC (CD33+CD11b+) от HLA-DR–/low клеток в культуре на примере одного эксперимента, представлены контроль и проба АФП 50 МЕ/мл, (б) влияние АФП на общий уровень MDSC (CD33+CD11b+) в культуре, (в) влияние АФП на уровень М-MDSC и PMN-MDSC в культуре.
Примечание: * – достоверные (p < 0.05) по U-критерию Манна–Уитни различия с контролем.
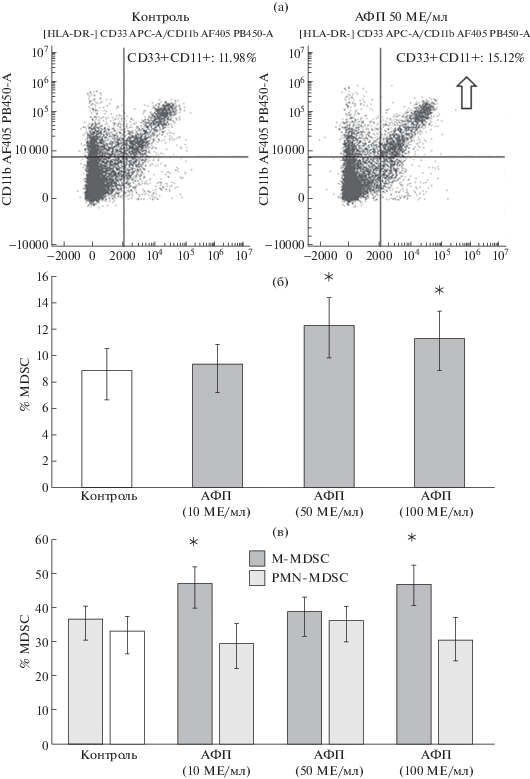
Для оценки эффектов АФП на дифференцировку MDSC использовали индукционную модель, в которой присутствие провоспалительного цитокина ИЛ-6 создает провоспалительный цитокиновый фон, а ГМ-КСФ является ростовым сигналом для миелоидных клеток. Показано, что самостоятельный эффект индукции клеток цитокинами заключался в достоверном повышении уровня MDSC (c 1.54 ± 0.97 до 8.88 ± 2.63; n = 6), что свидетельствует об адекватности выбранной экспериментальной модели.
Установлено, что рекомбинантный АФП в концентрациях 50 и 100 МЕ/мл повышал уровень MDSC человека в культуре миелоидных клеток человека (рис. 1а, 1б). При анализе субпопуляционного состава MDSC было показано, что АФП повышал уровень M-MDSC (10 и 100 МЕ/мл), не влияя на количество PMN-MDSC (рис. 1в). Данный результат можно интерпретировать как фетопротективный эффект АФП, поскольку повышение уровня MDSC в период беременности ассоциируется с подавлением иммунного ответа на отцовские антигены.
Известно, что уровень PMN-MDSC увеличивается в периферической крови здоровых беременных женщин на всех стадиях беременности по сравнению с небеременными, тогда как число M-MDSC остается без изменений [7]. Плацентарные PMN-MDSC эффективно подавляют Т-клеточный ответ, одновременно поляризуя CD4+-лимфоциты в фенотип Th2 [11]. Вероятно, PMN-MDSC играют важную роль в индуцировании и поддержании толерантности к антигенам плода, что позволяет рассматривать их как перспективную мишень терапевтического манипулирования при осложнениях беременности. Довольно интересно, что в нашем исследовании рекомбинантный АФП не влиял на дифференцировку PMN-MDSC, но повышал уровень M-MDSC. По-видимому, это связано со структурными отличиями нативного и рекомбинантного АФП. В ситуации in vivo фетальный АФП в материнском кровотоке становится трансформированным АФП (tAFP). Особенность этой формы заключается в том, что вследствие частичного разворачивания нативной полноразмерной молекулы появляется скрытый петидный эпитоп, состоящий из третьего домена АФП (34 а/к) [12]. По-видимому, нативный АФП регулирует прежде всего полиморфноядерные MDSC, в то время как рекомбинантная форма АФП больше взаимодействует с моноцитарными MDSC.
Известно, что рекомбинантный АФП, конъюгированный с токсинами, способен вызывать гибель MDSC [13], что является платформой для создания новых противоопухолевых препаратов. Однако до сих пор не был исследован самостоятельный эффект АФП на дифференцировку MDSC. Возможно, повышение уровня MDSC в культурах с рекомбинантным АФП можно рассматривать как позитивный иммунофармакологический эффект для его применения в терапии аутоиммунных заболеваний. В целом мы впервые продемонстрировали стимулирующее влияние рекомбинантного АФП на процесс дифференцировки MDSC человека в условиях in vitro.
Список литературы
Terentiev A.A., Moldogazieva N.T. Alpha-fetoprotein: A renaissance // Tumor Biol. 2013. V. 34. P. 2075–2091.
Schumacher A., Costa S.D., Zenclussen A.C. Endocrine factors modulating immune responses in pregnancy // Front. Immunol. 2014.
Pak V. N. Alpha-fetoprotein and Its Receptor in Fixing the Cancer Brakes / Cambridge Scholars Publishing, 2021.
Gabrilovich D.I., Nagaraj S. Myeloid- derived suppressor cells as regulators of the immune system // Nat. Rev. Immunol. 2009. № 9. P. 162–174.
Ostrand-Rosenberg S., Sinha P. Myeloid derived suppressor cells: linking inflammation and cancer // J. Immunol. 2009. V. 182 (8). P. 4499–4506.
Veglia F., Sanseviero E., Gabrilovich D.I. Myeloid-derived suppressor cells in the era of increasing myeloid cell diversity // Nat. Rev. Immunol. 2021 Epub ahead of print.
Kostlin N., Kugel H., Spring B., Leiber A., Marme A., Henes M., Rieber N., Hartl D., Poets C. F., Gille C. Granulocytic myeloid derived suppressor cells expand in human pregnancy and modulate T-cell responses // Eur. J. Immunol. 2014. № 44 (9). P. 2582–2591.
Belyaev N.N., Abdolla N., Perfilyeva Y.V., Ostapchuk Y.O., Krasnoshtanov V.K., Kali A., Tleulieva R. Daunorubicin conjugated with alpha-fetoprotein selectively eliminates myeloid-derivedsuppressor cells (MDSCs) and inhibits experimental tumor growth. // Cancer Immunol Immunother. 2018 Jan; V. 67. № 1. P. 101–111.
Lechner M.G., Liebertz D.J., Epstein A.L. Characterization of cytokineinduced myeloid derived suppressor cells from normal human peripheral blood mononuclear cells // J. Immunol. 2010. V. 185. № 4. P. 2273–84.
Gagnon A., Wilson R.D., Audibert F., Allen V.M., Blight C., Brock J.A., Desilets V.A., Johnson J.A., Langlois S., Summers A., Wyatt P. Obstetrical complications associated with abnormal maternal serum markers analytes // J. of Obstetrics and Gynaecology Canada. 2008. V. 30. P. 918–932.
Köstlin N., Hofstädter K., Ostermeir A.L., Spring B., Leiber A., Haen S., Abele H., Bauer P., Pollheimer J., Hartl D., Poets C.F., Gille C. Granulocytic myeloid-derived suppressor cells accumulate in human placenta and polarize toward a Th2 phenotype // Journal of Immunology. 2016. № 196 (3). P. 1132–1145.
González-Bugatto F., Foncubierta E., Bailén Mde L., Illanes S., Hervías-Vivancos B., Bartha J.L. Maternal and fetal serum transformed alpha-fetoprotein levels in normal pregnancy // J. Obstet. Gynaecol. Res. 2009. V. 35. № 2. P. 271–276.
Pak V.N. Selective targeting of myeloid-derived suppressor cells in cancer patients through AFP-binding receptors // Future Sci OA. 2018. V. 5. (1) FSO321. https://doi.org/10.4155/fsoa-2018-0029
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


