Доклады Российской академии наук. Науки о жизни, 2021, T. 501, № 1, стр. 573-579
ВЗАИМОДЕЙСТВИЕ НАНОЧАСТИЦ ОКСИДА ГРАФЕНА С КЛЕТКАМИ ЛИНИИ JURKAT В СИСТЕМЕ CELL-IQ
С. А. Заморина 1, *, П. В. Храмцов 1, М. Б. Раев 1, В. П. Тимганова 1, М. С. Бочкова 1, А. И. Нечаев 1, 2, Е. О. Шунькин 3, О. Г. Хазиахматова 1, 3, В. В. Малащенко 3, Л. С. Литвинова 3
1 Институт экологии и генетики микроорганизмов
УрО РАН – филиал Пермского федерального исследовательского центра Уральского отделения Российской академии наук
Пермь, Россия
2 Институт технической химии УрО РАН – филиал Пермского федерального исследовательского центра Уральского отделения Российской академии наук
Пермь, Россия
3 Балтийский федеральный университет им. И. Канта
Калининград, Россия
* E-mail: zamorina.sa@gmail.com
Поступила в редакцию 13.05.2021
После доработки 06.09.2021
Принята к публикации 07.09.2021
Аннотация
В последние годы материалы на основе оксида графена (ОГ) активно изучаются на предмет использования в биомедицине. Целью нашего исследования было изучение прироста клеточной массы и жизнеспособности Т-клеток опухолевой линии Jurkat при 24-часовом контакте с наночастицами ОГ системе прижизненного наблюдения Cell-IQ. В работе применяли наночастицы разного размера, покрытые линейным или разветвленным полиэтиленгликолем (ПЭГ) в концентрациях 5 и 25 мкг/мл. Впервые показано, что в результате прямого контакта с наночастицами ОГ более, чем в два раза снижался прирост клеточной массы в точках визуализации, независимо от размерности и концентрации наночастиц. Помимо этого, на 5–9% снижалось число живых клеток в культуре после суточного мониторирования. Таким образом, установлено, что наночастицы ОГ, покрытые ПЭГ, подавляют пролиферацию и жизнеспособность Т-лимфоцитов клеточной линии Jurkat.
ВВЕДЕНИЕ
Препараты на основе графена являются одним из самых перспективных материалов в биомедицине. В биологических и медицинских исследованиях преимущественно применяются окисленные формы графена, а именно оксид графена (ОГ) [1, 2]. Очевидно, что постоянно растущий спектр применения препаратов на основе графена в in vivo терапии и диагностике диктует необходимость всесторонней оценки его биосовместимости. Известно, что взаимодействие препаратов на основе графена с клетками живых организмов зачастую приводит к нарушению/изменению их активности либо гибели [3, 4]. На настоящий момент известно, что графен и его производные, в том числе ОГ, индуцируют апоптоз, некроз, или аутофагию клеток [5]. В то же время покрытие наночастиц биосовместимыми полимерами, из которых самым актуальным является полиэтиленгликоль (ПЭГ), существенно снижает цитотоксичность ОГ [6].
Очевидно, что клетки иммунной системы являются первой линией контакта с наноматериалами, индуцируя возникновение возможных побочных реакций. Учитывая тот факт, что применение препаратов на основе оксида графена предполагает модулирование функциональной активности клеток иммунной системы, в частности, при их использовании в качестве адъювантов, антибактериальных и противоопухолевых препаратов, необходимо полноценно исследовать взаимодействие ОГ с клетками иммунной системы. В данный момент информация о взаимодействии оксида графена с клетками иммунной системы разнородна и носит не системный характер [7, 8].
Таким образом, целью исследования являлось изучение взаимодействия наночастиц ОГ с клетками линии Jurkat в системе прижизненного наблюдения Cell-IQ. Итогом наблюдений стала оценка жизнеспособности клеток и прироста клеточной массы Т-клеток линии Jurkat в присутствии наночастиц ОГ разного размера, покрытых линейным или разветвленным ПЭГ.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводили в соответствии с Хельсинкской Декларацией ВМА 2000 г. и протоколом Конвенции Совета Европы о правах человека и биомедицине 1999 г., на работу было получено разрешение этического комитета “ИЭГМ УрО РАН” (IRB00010009) от 30.08.2019.
В работе использовались наночастицы ОГ размерами 100–200 нм (ОГ-S) и 1–5 мкм (ОГ-L) (“Ossila Ltd”, Великобритания), которые покрывались линейным (ПЭГ) и разветвленным (ПЭГ8) полиэтиленгликолем. Для процедур функционализации использовалась монохлоруксусная кислота (99%), 1-этил-3-(3-диметиламинопропил) карбодиимид (EDC, 98%), N-гидроксисукцинимид (NHS, >98%), 8-arm-полиэтиленгликоль-(трипентаэритритное ядро)-NH2 (ПЭГ8-NH2, Mw 10 000 г/моль), метоксиполиэтиленгликоль амин mПЭГ-NH2 (MW 5000 г/моль), производства “Alfa Aesar”, США. Все реактивы использовались без дополнительной очистки.
Модификация наночастиц ОГ линейным ПЭГ и разветвленным ПЭГ8 осуществлялась методом ковалентной пришивки аминогрупп к поверхностным карбоксильным группами ОГ с образованием амидной связи. Для этого растворы ОГ-L и ОГ-S (2 мг/мл) подвергались ультразвуковой обработке в течение 30 мин мощностью 25 и 150 Вт соответственно. Карбоксилирование ОГ проводилось в щелочной среде (NaOH) в присутствии Cl–CH2–COOH при ультразвуковой обработке в течение 1 ч. Полученный раствор ОГ-СООН нейтрализован многократной промывкой деионизованной водой. Далее к суспензии ОГ-СООН (рН 5, 6) при ультразвуковой обработке в течение 5 мин добавляли NHS (10 ммоль/л), EDC (4 ммоль/л) и ПЭГ-NH2 (или 8ПЭГ-NH2) (2 мг/мл), для окончания реакции ковалентной пришивки PEG раствор оставляли при комнатной температуре на сутки. Полученные суспензии ОГ-ПЭГ или ОГ-8ПЭГ очищались методом диализа и трехкратной промывкой с центрифугированием этиловым спиртом с финальной сушкой при 65°С под вакуумом [9].
Изменение состава и структуры ОГ при его модификации полиэтиленгликолями характеризовали методами ИК-Фурье и УФ-вид спектроскопиями. ИК-Фурье спектры исходных и модифицированных ОГ были получены на спектрометре IFS 66/S Bruker в области 400–4000 см–1. Образцы для анализа готовили прессованием таблеток с KBr (2 мг образца к 299 мг KBr). Спектры поглощения растворов исходного и модифицированных ОГ были определены на двухлучевом спектрофотометре UV 2600 в диапазоне длин волн 200–900 нм. Распределение исходного и модифицированных наночастиц ОГ по размеру, а также их дзета-потенциал в водных растворах определяли методом динамического светорассеяния на приборе ZetaPALS Brookhaven. Определение степени покрытия ОГ линейным ПЭГ и разветвленным ПЭГ8 проводили методом термогравиметрического анализа (ТГА). Термогравиметрический анализ исходных и модифицированных ОГ был проведен на совмещенном ТГ-ДСК приборе TGA/DSC 1 Mettler-Toledo при скорости нагревания 10 К/мин в диапазоне температур 30–900°С в инертной атмосфере аргона.
Для исследования in vitro использовали иммортализованную клеточную линию Jurkat 5332 (Российская коллекция клеточных культур позвоночных Института цитологии РАН, г. Санкт-Петербург) в конечной концентрации 1 млн жизнеспособных клеток на 1 мл питательной среды.
Клетки ресуспендировали в полной питательной среде, состоящей из 90% RPMI 1640, 10% бычьего сывороточного альбумина (“Sigma-Aldrich”) и 0.3 мг/мл L-глутамина (“Sigma-Aldrich”). Для каждого вида наночастиц ОГ делали три повторности культуры. Клетки с наночастицами культивировали в 24-луночном планшете (“Orange Scientific”, Бельгия, площадь лунки 1.86 см2), в течение 24 ч при температуре 37°С и 5% СО2. Контролем служила культура клеток без наночастиц ОГ [10]. Прирост клеточной массы изучали с использованием возможностей интегрированной платформы для непрерывной фазово-контрастной визуализации живых клеток в реальном времени Cell-IQ® v2 MLF (“CM Technologies”, Финляндия).
Для визуализации морфологических изменений и функциональной активности иммунокомпетентных клеток в каждой лунке выбирали три области съемки для фазово-контрастной микроскопии. В результате проведенного исследования было получено по 222 снимка для каждой лунки экспериментального планшета и по 74 снимка для каждой области визуализации. Для анализа прироста клеточной массы, по окончании съемки на основе полученных снимков формировались библиотеки изображений, на основе которых создавались протоколы, позволяющие с использованием специализированного программного обеспечения Cell-IQ Imagen™ (“CM Technologies”, Финляндия) проводить автоматизированный подсчет прироста клеточной массы в экспериментальных условиях. На основе полученных данных строились кривые, отражающие прирост клеточной массы.
По истечении 24 ч проводили окрашивание клеток йодидом пропидия (PI, “Thermo Fisher Scientific”, США) с последующим анализом на проточном цитофлуориметре MACS Quant Analyzer 10 (“Miltenyi Biotec”, Германия). Учитывая, что оксид графена обладает собственной автофлуоресценцией [11], для более четкой картины жизнеспособность оценивали на 2 каналах FL3 (585/40 нм) и FL4 (655–730 нм). Дополнительно оценивали количество клеток, интернализировавших или связавших наночастицы ОГ, по количеству высокогранулярных клеток в гейте живых Jurkat по показателю бокового светорассеяния (SSC). Обработка данных осуществлялась с использованием программы KALUZA Analysis Software (“Beckman Coulter”, США), результаты выражали в виде процента живых клеток в гейте целевой популяции и в виде процента высокогранулярных клеток (табл. 2).
Таблица 1.
Характеристика используемых в работе наночастиц ОГ-ПЭГ
| ОГ-ПЭГ- S | ОГ-ПЭГ8-S | ОГ-ПЭГ-L | ОГ-ПЭГ8 -L | |
|---|---|---|---|---|
| Средний эффективный диаметр, нм | 184 ± 73 | 287 ± 52 | 569 ± 14 | 1376 ± 48 |
| Индекс полидисперсности | 0.25 ± 0.02 | 0.23 ± 0.02 | 0.21 ± 0.02 | 0.30 ± 0.01 |
| Дзета-потенциал, мВ | –31.70 ± 1.70 | –34.28 ± 0.41 | –39.98 ± 1.17 | –53.56 ± 1.23 |
| Степень покрытия, мас. % | 17.2 ± 1.4 | 20.5 ± 1.8 | 19.4 ± 2.2 | 20.5 ± 1.1 |
Таблица 2.
Количество живых и высокогранулярных клеток в культурах Jurkat после инкубирования с наночастицами ОГ (Me (Q1–Q3), n = 3)
| Тип нано-частиц | Концен-трация | FL 3 (585/40 nm) PI-, % | FL 4 (655–730 nm) PI-, % |
Высокогранулярные клетки в гейте живых Jurkat, % |
|---|---|---|---|---|
| Контроль | 0 | 90.22 (87.89–91.28) | 91.07 (86.12–92.31) | 4.99 (4.79–5.12) |
| ОГ-ПЭГ- S | 5 мкг/мл | 88.59 (86.78–88.90) | 89.43 (84.52–89.56) | 4.95 (4.84–5.19) |
| 25 мкг/мл | 84.09 (83.78–85.28) | 81.96 (81.19–84.26) | 5.62 (5.34–5.68) | |
| ОГ-ПЭГ8-S | 5 мкг/мл | 87.40 (86.47–87.81) | 86.16 (85.65–87.47) | 6.64 (6.48–6.92) |
| 25 мкг/мл | 86.63 (85.51–86.86) | 86.72 (83.88–87.45) | 6.50 (6.43–6.64) | |
| ОГ-ПЭГ-L | 5 мкг/мл | 86.84 (83.29–88.36) | 85.42 (79.75–88.00) | 5.92 (5.83–6.24) |
| 25 мкг/мл | 85.92 (85.59–88.29) | 86.52 (84.16–88.80) | 6.79 (6.75–7.03) | |
| ОГ-ПЭГ8 -L | 5 мкг/мл | 87.05 (87.01–88.55) | 86.96 (85.68–89.19) | 6.82 (6.75–7.34) |
| 25 мкг/мл | 87.27 (86.32–88.37) | 86.08 (84.35–88.79) | 8.29 (7.95–8.47) |
Статистическая обработка результатов осуществлялась с помощью стандартных пакетов STATISTICA for Windows 10.0. Рассчитывали параметры распределений: медиану (Ме), 25%-ный (Q1) и 75%-ный (Q3) квартили, достоверность различий оценивали с использованием критерия Манна–Уитни. Различия считались достоверными при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведенные исследования полученных нами пегилированных образцов наночастиц ОГ показали, что процесс химической модификации прошел успешно вне зависимости от размеров графеновых частиц, ароматическая структура ОГ не изменилась, а средний размер наночастиц пегилированного ОГ по сравнению с исходным, заявленным производителем, снижается (табл. 1).
Клеточная линия Jurkat представляет собой иммортализованную клеточную линию Т-лимфоцитов, которые быстро пролиферируют и обладают характеристиками, сходными с Т-лимфоцитами человека. Т-клетки Jurkat используют для изучения иммунных и цитотоксических реакций на противоопухолевые препараты, токсиканты и биоматериалы [12].
В нашем исследовании изучалась динамика изменения клеточной массы Т-клеток Jurkat в условиях соинкубирования с наночастицами ОГ. Данные представлены в виде кривых динамики клеточной массы, где каждая кривая – это усредненное значение числа клеток по трем точкам визуализации. Показано, что в контрольных лунках наблюдалось почти двухкратное повышение числа клеток Jurkat в точках визуализации по прошествии 24 ч культивирования (рис. 1а).
Рис. 1.
Усредненные кривые динамики клеточной массы Jurkat при культивировании для трех повторностей в условиях взаимодействия с наночастицами ОГ (n = 3, по три точки визуализации). (а) Показано взаимодействие клеток Jurkat с наночастицами ОГ-ПЭГ-S; (б) Показано взаимодействие клеток Jurkat с наночастицами ОГ-ПЭГ-L.
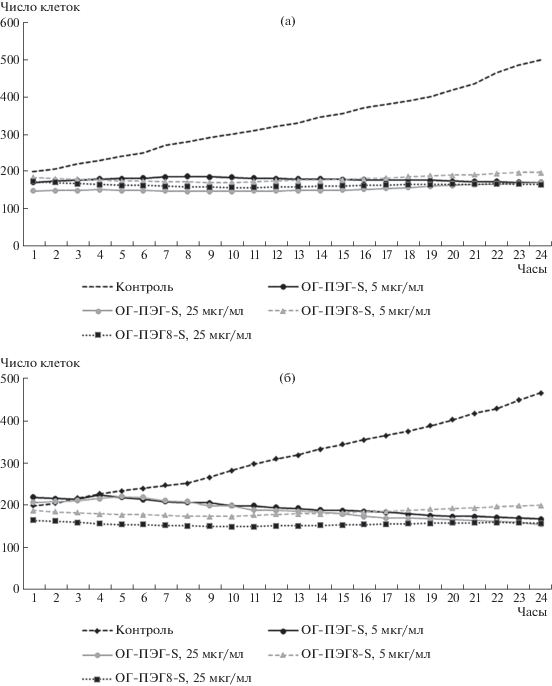
Стоит отметить линейность прироста клеток Jurkat начиная с первого часа культивирования и высокий уровень сходимости результатов между лунками. При анализе фотокадров мы также видим существенное увеличение числа клеток в точке визуализации за 24 ч инкубации (рис. 2).
Рис. 2.
Фотографии, демонстрирующие события в одной точке визуализации при взаимодействии клеток линии Jurkat с наночастицами ОГ-ПЭГ в динамике наблюдения (1 ч, 24 ч).

По сравнению с контрольной группой наночастицы ОГ-ПЭГ-S (5, 25 мкг/мл) не показывали прироста количества клеток в точках визуализации при обоих концентрациях исследуемого образца (рис. 1а). При анализе фотокадров мы видим, что наночастицы ОГ-ПЭГ-S в высокой концентрации (25 мкг/мл) вызывали формирование клеточных агрегатов, которое не сопровождалось, тем не менее, снижением жизнеспособности клеток в сравнении с пробой, содержащей ОГ-ПЭГ-S в низкой концентрации (5 мкг/мл) (рис. 2).
При культивировании клеток линии Jurkat с ОГ-ПЭГ8-S (5, 25 мкг/мл) количество клеток в точках визуализации практически не изменялось, уровень сходимости результатов в зависимости от повторности был высоким (рис. 1а). Таким образом, наночастицы малой размерности (ОГ-ПЭГ-S 184 ± 73 нм; ОГ-ПЭГ8-S 287 ± 52 нм) существенно (более чем в 2 раза) подавляли рост клеток в культурах по сравнению с контрольной группой, при этом тип пришитого к наночастицам ПЭГ не имел значения для реализации этих эффектов.
При культивировании клеток линии Jurkat с наночастицами большей размерности (ОГ-ПЭГ-L 569 ± 14 нм; ОГ-ПЭГ8-L 1376 ± 48 нм) было показано, что под воздействием ОГ-ПЭГ-L (5, 25 мкг/мл) отмечено плавное снижение количества клеток в точках визуализации с высоким уровнем сходимости результатов в зависимости от повторности. Довольно интересно, что в первые 4 ч фиксировался незначительный прирост клеток, который затем переходил в постепенное снижение числа клеток. Наночастицы, покрытые разветвленным ПЭГ (ОГ-ПЭГ8-L), также подавляли рост клеток Jurkat на протяжении всего периода наблюдения (рис. 1б). Аналогично с образцами ОГ малой размерности, наночастицы большой размерности подавляли количество клеток в точках визуализации при обоих концентрациях исследуемого образца. При анализе фотокадров мы видим, что наночастицы ОГ-ПЭГ-L в концентрации 25 мкг/мл вызывали формирование клеточных агрегатов, как и в случае с частицами ОГ-ПЭГ-S (рис. 2). Очевидно, что именно концентрация, а не тип наночастиц вызывает формирование клеточных агрегатов.
Таким образом, установлено, что наночастицы ОГ способны подавлять пролиферацию клеток линии Jurkat, при этом размер, концентрация и тип пегилирования не имели принципиального значения. Проведенный статистический анализ показал, что различия начинали фиксироваться после 4 ч в зависимости от типа частиц, однако по истечении 24 сут все эффекты были достоверны.
При оценке жизнеспособности клеток Jurkat после суточного сокультивирования с наночастицами ОГ было показано, что число живых клеток снижалось на 5–9%, независимо от типа используемых частиц (табл. 2). Невзирая на то что статистический анализ не выявил достоверных отличий, что связано с малым числом повторов, мы не можем игнорировать видимое снижение жизнеспособности клеток в нашей экспериментальной системе. В то же время проанализировав количество высокогранулярных клеток в культуре (табл. 2), мы увидели, что в присутствии наночастиц ОГ количество этих клеток увеличивается в среднем на 2–4%, что свидетельствует о том, что некоторые клетки линии Jurkat связывают и/или интернализируют наночастицы ОГ.
В целом получены сопоставимые результаты по приросту клеточной массы и количеству живых клеток в культуре клеток Jurkat при взаимодействии с наночастицами ОГ. Полученные данные свидетельствуют о том, что наши наночастицы ОГ оказывают цитотоксический эффект на клетки линии Jurkat, снижая уровень живых клеток на 5–6%, одновременно подавляя пролиферацию этих клеток. В частности, наночастицы ОГ более чем в два раза снижали прирост клеточной массы, фиксируемый в системе прижизненной визуализации CELL-IQ, при этом сохраняя стабильное число клеток в течение всего периода наблюдения (24 ч). Мы предполагали, что высокая концентрация наночастиц (25 мкг/мл) должна была оказывать более выраженный эффект, однако наша гипотеза не подтвердилась.
Известно, что наночастицы ОГ способны дозозависимо подавлять пролиферацию Т-лимфоцитов, при этом надо учесть тот факт, что исследователи применяли не модифицированные наночастицы ОГ размером ~1 мкм, в концентрации 1; 12; 25 мкг/мл [13]. Относительно недавно появились сведения о влиянии ОГ и аминированного ОГ (ОГ-NH2), полученные при помощи одновременного анализа транскриптома клетки с “single-cell” масс-цитометрией. Было продемонстрировано, что ОГ снижал жизнеспособность активированных Т-хелперов в большей степени, чем ОГ-NH2 [14].
Невзирая на то что в литературе отсутствуют сведения о непосредственном поглощении наночастиц ОГ клетками линии Jurkat, известно, что они способны пассивно интернализовать золотые наночастицы (25 и 50 нм) [15]. Мы продемонстрировали, что лишь малая часть клеток связывает или интернализует ОГ. Таким образом, цитотоксический эффект на клетки линии Jurkat обусловлен не поглощением, а присутствием частиц ОГ в культуральной среде.
Известно, что само присутствие частиц на основе графена способно подавлять пролиферацию клеток и вызывать их гибель [16]. Механизмы цитотоксического действия наночастиц ОГ описаны на разных типах клеток и включают в себя окислительный стресс, митохондриально-опосредованный апоптоз, аутофагию, лизис клеток и фрустрированный фагоцитоз [17]. Используемая в работе методология не позволяет достоверно оценить конкретный механизм цитотоксичности наночастиц ОГ, однако это станет целью нашей дальнейшей работы.
Список литературы
Dasari Shareena T.P., McShan D., Dasmahapatra A.K., Tchounwou P.B. A review on graphene-based nanomaterials in biomedical applications and risks in environment and health // Nanomicro Lett. 2018. V. 10. № 3. ID 53.
Raslan A., Saenz Del Burgo L., Ciriza J., Pedraz J.L. Graphene oxide and reduced graphene oxide-based scaffolds in regenerative medicine // Int. J. Pharm. 2020. V. 580. P. 119226.
Park M.V.D.Z., Bleeker E.A.J., Brand W., Cassee F.R., van Elk M., Gosens I., de Jong W.H., Meesters J.A.J., Peijnenburg W.J., Quik J.T.K., Vandebriel R.J., Sips A.J.A.M. Considerations for safe innovation: the case of graphene // ACS Nano. 2017. V. 11. P. 9574–93.
Makharza S., Cirillo G., Bachmatiuk A., Imad I., Ioannides N., Trzebicka B., Hampel S., Rümmeli M.H. Graphene oxide-based drug delivery vehicles: functionalization, characterization, and cytotoxicity evaluation // J. Nanoparticle Research. 2013. V. 15. P. 2099.
Ou L., Lin S., Song B., Liu J., Lai R., Shao L. The mechanisms of graphene-based materials-induced programmed cell death: a review of apoptosis, autophagy, and programmed necrosis // Int. J. Nanomedicine. 2017. V. 12. P. 6633–46.
de Melo-Diogo D., Lima-Sousa R., Alves C.G., Costa E.C., Louro R.O., Correia I.J. Functionalization of graphene family nanomaterials for application in cancer therapy // Colloids Surf. B Biointerfaces. 2018. V. 171. P. 260–275.
Dudek I., Skoda M., Jarosz A., Szukiewicz D. The molecular influence of graphene and graphene oxide on the immune system under in vitro and in vivo conditions // Arch. Immunol. Ther. Exp. (Warsz). 2016. V. 64. № 3. P. 195–215.
Feito M.J., Vila M., Matesanz M.C., Linares J., Gonçalves G., Marques P.A., Vallet-Regí M., Rojo J.M., Portolés M.T. In vitro evaluation of graphene oxide nanosheets on immune function // J. Colloid Interface Sci. 2014. V. 432. P. 221–228.
Hermanson G.T. Bioconjugate Techniques. San Diego. 2008.
Литвинова Л.С., Шуплецова В.В., Дунец Н.А., Хазиахматова О.Г., Юрова К.А., Хлусова М.Ю., Слепченко Г.Б., Черемпей Е.Г., Шаркеев Ю.П., Комаро- ва Е.Г., Седельникова М.Б., Хлусов И.А. Дисбаланс морфофункциональных реакций Т-лимфобластов линии JURKAT при краткосрочном культивировании с рельефным цинк- или медьсодержащим кальцийфосфатным покрытием на титане // Доклады Академии наук. 2017. Т. 472. № 3. С. 354–358.
Sunil K. Singh, Manoj K. Singh, Manasa K. Nayak, Sharda Kumari, Jose´ J.A. Gra’cio, Debabrata Dash. Characterization of graphene oxide by flow cytometry and assessment of its cellular toxicity // Carbon. 2011. V. 49. P. 684–692.
Jurkat Cell Line – an overview | ScienceDirect Topics [Electronic resource]. URL: https://www.sciencedirect.com/topics/immunology-and-microbiology/jurkat-cell-line (accessed: 07.10.2019).
Paino I.M., Santos F., Zucolotto V. Biocompatibility and toxicology effects of graphene oxide in cancer, normal, and primary immune cells // J. Biomedical Materials Research – Part A 2017. V.105 (3). P. 728–36.
Orecchioni M., Bedognetti D., Newman L., Fuoco C., Spada F., Hendrickx W., Marincola F.M., Sgarrella F., Rodrigues A.F., Ménard-Moyon C., Cesareni G., Kostarelos K., Bianco A., Delogu L.G. Single-cell mass cytometry and transcriptome profiling reveal the impact of graphene on human immune cells // Nat. Commun. 2017. V. 8 (1). P. 1109.
Mendes R.G., Koch B., Bachmatiuk A., Ma X., Sanchez S., Damm C., Schmidt O.G., Gemming T., Eckertaij J., Rümmeli M.H. A size dependent evaluation of the cytotoxicity and uptake of nanographene oxide // Journal of Materials Chemistry B. 2015. V. 3. P. 2522–2529.
Ou L., Lin S., Song B., Liu J., Lai R., Shao L. The mechanisms of graphene-based materials-induced programmed cell death: a review of apoptosis, autophagy, and programmed necrosis // International J. Nanomedicine. 2017. V. 12. P. 6633–6646.
Achawi S., Pourchez J., Feneon B., Forest V. Graphene-based materials in vitro toxicity and their structure-activity relationships: a systematic literature Review // Chem. Res. Toxicol. 2021.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


