Доклады Российской академии наук. Науки о жизни, 2022, T. 502, № 1, стр. 43-47
МЕТОД ПЕРВИЧНОГО СКРИНИНГА ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ НА КЛЕТОЧНОЙ МОДЕЛИ ЭУКАРИОТ PARAMECIUM CAUDATUM
Г. А. Груздев 1, *, О. В. Карпухина 1, 2, А. Н. Иноземцев 1, А. А. Каменский 1
1 Московский государственный университет
имени М.В. Ломоносова, биологический факультет
Москва, Россия
2 Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
Москва, Россия
* E-mail: Gleb-neuro.phys@mail.ru
Поступила в редакцию 19.10.2021
После доработки 25.10.2021
Принята к публикации 25.10.2021
- EDN: EKUZAX
- DOI: 10.31857/S2686738922010097
Аннотация
В работе исследовалось воздействие адреналина в различных концентрациях и дофамина в концентрации 10–10 моль/мл на поведение Paramecium caudatum. Показано, что адреналин снижает двигательную активность и изменяет стратегию движения этих простейших организмов, наблюдается дозозависимый поведенческий ответ от концентрации препарата. Эффект можно объяснить наличием рецепторов к адреналину, расположенных на поверхности мембраны клеток. Для изучения прямого воздействия адреналина на альфа и бета адренорецепторы в данной работе рассмотрено влияние неселективных адреноблокаторов ницерголина и тимолола. В то же время дофамин в концентрации 10–10 моль/мл рецепторов, к которому у этого организма не обнаружены, не оказывают достоверного воздействия на характер и величину двигательной активности в течение всего времени регистрации. Предложенный метод позволяет быстро и объективно оценивать характер воздействия различных фармакологических агентов, воздействующих на систему катехоламинов.
Требования, утвержденные биоэтическим сообществом для доклинических исследований, ужесточаются. Поэтому поиск объекта для исследования лекарственных препаратов, подходящего для моделирования многих болезней на протяжении десятилетий, был “святым Граалем” биомедицинских исследований [1]. Такой полезной моделью может стать Paramecium caudatum. Данный объект охватывает одновременно два уровня организации живой материи, являясь одновременно и клеткой, и организмом, что позволяет изучать молекулярные механизмы воздействия фармакологических препаратов комплексно и наблюдать поведенческий ответ животного [2]. Данная модель хорошо показала себя в токсикологических испытаниях [3, 4], однако потенциал объекта в современных доклинических исследований используется в неполном объеме. Нами предложен практичный метод первичного скрининга фармакологических препаратов с использованием одноклеточных организмов Рaramecium caudatum.
МАТЕРИАЛЫ И МЕТОДЫ
Работа была выполнена на стерильной культуре живых клеток Paramecium caudatum, которых содержали в приближенных к естественной среде условиях обитания при температуре 24 градуса при pH = 6.8—7.2 с соблюдением 12-часового светового дня и поддержанием плотности в размере 600 клеток/мл. Кормление инфузорий производилось ежедневно в объеме 200 мкл на колонию в 100 мл. В качестве корма использовался раствор дрожжей Saccharomyces cerevisiae. Для поддержания стерильности среды проводилась ежемесячная фильтрация колонии через мелкодисперсную губку. В день эксперимента кормление инфузорий приостанавливалось.
Для верификации предложенного нами метода исследования особенностей влияния фармакологических веществ на Paramecium caudatum были выбраны дофамин и адреналин, чьи концентрации после введения в исследуемый объем культуры (1 мл) составляли 10–10 моль/мл для дофамина и 10–8, 10–10 ,10–12 моль/мл для адреналина. Так же для определения, через какие адренорецепторы альфа или бета действует адреналин на парамеций, были применены неселективные адреноблокаторы: ницерголин и тимолол в концентрации 10–10 моль/мл.
Регистрация движения клеток велась с использованием тринокулярного стереоскопического микроскопа Olympus SZ6. Для анализа двигательной активности, по полученным видеозаписям, использовалась программа ImageJ (Fiji) плагин “Track Mate” [5].
Статистический анализ проводился в программе “Statistica 10” с помощью непараметрического критерия Манна–Уитни после проверки на нормальность критерием Шапиро–Уилка для больших выборок. Достоверные значения оценивались при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
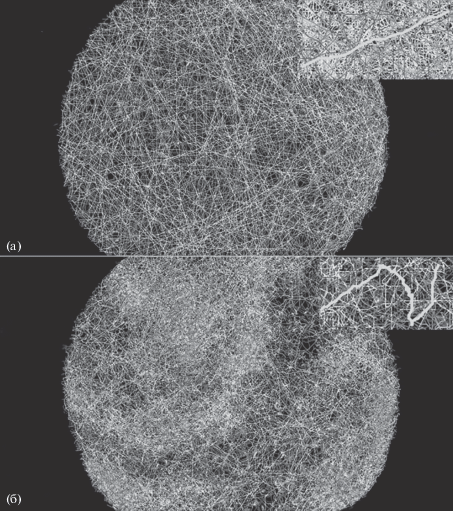
В контрольной группе животные распределялись по всему исследуемому объему, двигаясь с одинаковой скоростью и выдерживая преимущественно линейную траекторию плавания рис. 1а. После добавления адреналина в среду наблюдается снижение двигательной активности, которое становится прерывистым и нелинейным рис. 1б.
Рис. 1.
Возможные стратегии поведения парамеций в ответ на введение адреналина в концентрации (10–10 моль/мл).
а – поведение клеток контрольной группы (после внесения воды), б – проявление хемотаксиса после введения адреналина.
Показатели уменьшения скорости под воздействием адреналина относительно контроля приведены на рис. 2а.
Рис. 2.
Изменение скорости движения и активности Paramecium caudatum в ответ на предъявление адреналина в концентрации (10–10–10–12моль/мл). а – График изменения скорости (после введения адреналина на 5-й минуте регистрации). б – График изменения количества активных клеток после воздействия адреналина (активными клетками считаются все подвижные клетки в эксперименте).
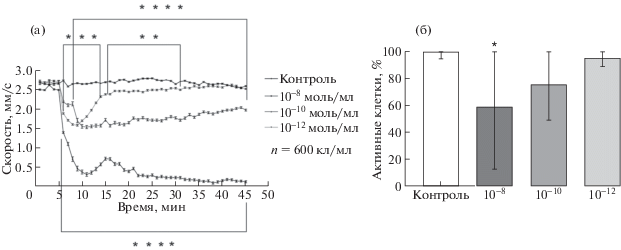
При регистрации характера движения парамеций в контрольных экспериментах было показано, что подавляющее число животных (95%) двигается прямолинейно, проходя за 40 мин опыта около 150 см (рис. 2а). При этом скорость движения парамеций в течение всего времени регистрации оставалось постоянной. Введение в среду адреналина привело к снижению скорости движения и уменьшению пробега, пройденного за время эксперимента.
Такой поведенческий эффект обусловлен наличием на мембране Рaramecium caudatum рецепторов к адреналину [6]. Вследствие активации этих рецепторов происходит деполяризация мембраны, что и приводит к снижению двигательной активности животного (рис. 2), т.к. скорость движения клеток по литературным данным напрямую зависит от потенциала на мембране [7].
Снижение активности клеток из опытной группы может быть связанно с активацией внутриклеточных процессов, таких как расщепление гликогена, эндоцитоз, конъюгация, пролиферация (рис. 2б).
Однако совсем иная картина отмечается после внесения в среду дофамина (рис. 3).
Рис. 3.
Изменение скорости движения и активности Рaramecium caudatum в ответ на предъявление дофамина в концентрации (10–10 моль). а – График изменения скорости (после введения дофамина на 5-й минуте регистрации). б – График изменения количества активных клеток после воздействия дофамина (активными клетками считаются все подвижные клетки в эксперименте).
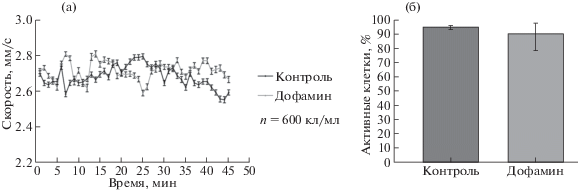
На графиках показано, что внесение в среду дофамина, в концентрации 10–10 моль/мл, не влияет на двигательную активность исследуемой модели в отличие от адреналина, предъявляемого в той же концентрации. Такой результат обусловлен отсутствием дофаминовых рецепторов на мембране Рaramecium caudatum.
Теперь рассмотрим влияние эндогенного адреналина, выделяемого клетками, на конкретные адренорецепторы, добавив в среду неселективные адреноблокаторы для каждой группы рецепторов (рис. 4).
Рис. 4.
Изменение скорости движения Paramecium caudatum в ответ на предъявление ницерголина и тимолола в концентрации (10–10 моль/мл). а – График изменения скорости после введения ницерголина (альфа блокатора), б – График изменения скорости после введения тимолола (бета блокатора).

В случае с предъявлением ницерголина эндогенный адреналин воздействует на бета-1 и бета-2 адренорецепторы, т.к. данный препарат является неселективным альфа блокатором. Это приводит к сильному снижению скорости движения парамеций (рис. 4а), такой ответ может быть связан с тем, что активация б1 и б2 рецепторов направлена на деполяризацию клеточной мембраны. Однако противоположную картину в изменении скорости можно увидеть при добавлении в среду тимолола, где эндогенный адреналин будет воздействовать уже на а1 и а2 адренорецепторы, т.к. бета рецепторы будут уже заблокированы (рис. 4б). В этом случае наблюдается характерный двухфазный ответ. Так, в течение 5 мин после введения препарата видим воздействие адреналина на а1 рецепторы, что приводит к снижению скорости, т.к. данный тип рецепторов так же является деполяризующим, как и б1, б2. Однако через 14 мин после предъявления тимолола скорость клеток возрастает. Такой ответ обусловлен активацией а2 рецепторов, которые направлены на гиперполяризацию мембраны и ингибируют секрецию адреналина в среду. Возможно, видимые различия в силе воздействия адреналина на а1 и а2 рецепторы объясняются разным количеством этих рецепторов на мембране или различной чувствительностью.
Из полученных нами данных следует, что физиологические реакции парамеций перспективны с позиций познания процессов функционирования медиаторных механизмов [8].
Таким образом, в представленном исследовании показано, что при воздействии адреналина наблюдается снижение двигательной активности клеток, в то время как при отсутствии рецепторов к дофамину параметры двигательной активности не имеют отличий от контрольных значений.
ЗАКЛЮЧЕНИЕ
В нашей работе показана возможность использовать Рaramecium caudatum в качестве доклинической модели при первичном скрининге фармацевтических препаратов, регистрируя изменение двигательной активности этого одноклеточного организма в ответ на активацию рецепторов разных типов, расположенных на клеточной мембране. Метод позволяет выявлять сродство к известным клеточным рецепторам парамеций, что позволяет дать оценку спектру фармакологического влияния исследуемых препаратов.
Список литературы
Hobson-West P., Davies A. Societal Sentience: Constructions of the Public in Animal Research Policy and Practice // Sci Technol Human. 2018. V. 43. P. 671–93.
Takeda N., Sugiyama K. Metabolism of biogenic monoamines in the ciliades protozoan, tetrahymena pyriformis // Biochem. Physid. 1993. V. 106. № 1. P. 63–70.
Inozemtsev A.N., Karpukhina O.V., Melikhov I.V., et al. Effect of low temperature plasma of atmospheric pressure on single-cell model organisms of ciliate Paramecium caudatum // J Phys Conf Ser. 2019. V. 1238. № 1. P. 012050.
Morgunov I.G., Kamzolova S.V., Karpukhina O.V., et al. Biosynthesis of isocitric acid in repeated-batch culture and testing of its stress-protective activity // Appl Microbiol Biotechnol. 2019. V. 103. P. 3539–3558.
Schindelin J., Arganda-Carreras I., Frise E., et al. Fiji: An open-source platform for biological-image analysis // Nat. Methods. 2012. V. 9. № 7. P. 676–682.
Wiejak J., Surmacz L., Wyroba E. Dynamin-association with agonist-mediated sequestration of beta-adrenergic receptor in single-cell eukaryote Paramecium. // J. Exp. Biol. 2004. V. 207. № 10. P. 1625–1632.
Schlaepfer C.H., Wessel R. Excitable Membranes and Action Potentials in Paramecia: An Analysis of the Electrophysiology of Ciliates. // J. Undergrad Neurosci Educ. 2015. V. 14. № 1. P. A82–A86.
Gundersen R.E., Thompson G.A. Further Studies of Dopamine Metabolism and Function in Tetrahymena // J. Protozool. 1985. V. 32. № 1. P. 25–31.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


