Доклады Российской академии наук. Науки о жизни, 2022, T. 502, № 1, стр. 37-42
ВЗАИМОСВЯЗЬ МЕЖДУ p53-ПОЗИТИВНЫМИ НЕЙРОНАМИ И ТЕМНЫМИ НЕЙРОНАМИ В ГИППОКАМПЕ КРЫС ПОСЛЕ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ НА ПЕРЕГОРОДКЕ НОСА
В. И. Торшин 1, И. В. Кастыро 1, *, академик РАН И. В. Решетов 2, М. Г. Костяева 1, В. И. Попадюк 1
1 ФГАОУ ВО Российский университет дружбы народов
Москва, Россия
2 ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет)
Москва, Россия
* E-mail: ikastyro@gmail.com
Поступила в редакцию 26.08.2021
После доработки 05.10.2021
Принята к публикации 08.10.2021
- EDN: BOYMER
- DOI: 10.31857/S2686738922010206
Аннотация
В исследовании оценивается взаимосвязь экспрессии белка p53 и появления темных нейронов (ТН) в гиппокампе у крыс при экспериментальном моделировании септопластики. Была проведена септопластика у 15 половозрелых крыс-самцов линии Wistar. Изучены гистологические срезы гиппокампа, окрашенные толуидиновым синим по Нисслю и антителами к белку p53. В субполе СА1 количество p53-позитивных нейронов достоверно повысилось на 2-й, 4-й (p < 0.001) и 6-й дни (p < 0.05). В динамике пик роста экспрессии белка p53 в цитоплазме нейронов СА1 и СА2 пришелся на 2–4-е сутки после операции, а на 6-й день количество этих нейронов снизилось (p < 0.001). В цитоплазме нейронов СА3 на всех сроках после хирургического вмешательства было отмечено увеличение экспрессии белка p53, по сравнению с контрольной группой. В пирамидном слое СА1 количество ТН на 6-й день снизилось (p < 0.001). В СА2 через 2 сут был отмечен минимум ТН, по сравнению с 4-м днем (p < 0.001). В СА3 на 4-й день наблюдался пик ТН, по сравнению с остальными днями (p < 0.001). Была обнаружена положительная сильная связь на всех сроках оценки и во всех субполях гиппокампа между ростом количества темных и p53-позитивных нейронов. Появление темных и p53-позитивных нейронов в гиппокампальной формации у крыс после моделирования септопластики является типовыми ответными реакциями нервной ткани на стресс. Очевидно, что экспрессия белка p53 связана с базофилией цитоплазмы нейронов, их морфофункциональным состоянием. Предположительно белок p53 может запускать не только активацию поврежденных нейронов в гиппокампе, но и играть нейропротективную роль. Предстоящие исследования должны определить роль белка p53 в дальнейшей судьбе поврежденных нейронов в пирамидном слое и дифференцировать механизмы его экспрессии.
ВВЕДЕНИЕ
Моделирование септопластики у крыс приводит к развитию мощного стрессового ответа [1]. На примере животных это позволяет нам понять то, какие процессы возможны при проведении подобных хирургических вмешательств [2]. Моделирование стрессовых воздействий приводит к нарушению функционального состояния нейронов с последующими морфологическими изменениями [3]. Особое внимание при стрессе уделяется гиппокампу [4, 5]. Белок p53 является активатором транскрипции определенного набора генов-мишеней, ингибирующим клеточный цикл регуляторным фактором и эффектором клеточных ответов на повреждения, которые включают остановку клеточного цикла и апоптоз [6]. Вместе с тем р53 является нейропротектором в модели тауопатии in vivo. Было показано, что р53 контролирует транскрипцию группы генов, участвующих в синаптической функции. Транскрипционный контроль р53 этих синаптических генов сохраняется в мышиных нейронах и человеческом мозге [7]. Поврежденные (темные) нейроны имеют специфические морфологические признаки: усохшая цитоплазма, сморщенное ядро с сегментированным хроматином и неровными границами, штопорообразный аксон [4, 8]. Считается, что в этих нейронах произошел запуск запрограммированной гибели клеток [9]. Однако не исключается, что темные нейроны при определенных условиях способны к восстановлению своего морфофункционального состояния [8].
Нейроны его пирамидного слоя чувствительны к различным стрессовым факторам, в том числе и при хирургическом стрессе. Так было показано, что моделирование хирургических манипуляций в полости носа у крыс провоцирует экспрессию белка p53 в нейронах гиппокампа и появление темных нейронов. При этом исследований, оценивающих одновременность этих процессов при моделировании септопластики у крыс, не проводилось.
В настоящем исследовании цель исследования заключалась в определении взаимосвязи появления p53-позитивных нейронов и темных нейронов в гиппокампе у крыс после хирургических вмешательств на перегородке носа.
МАТЕРИАЛЫ И МЕТОДЫ
Двадцати половозрелым крысам-самцам линии Wistar массой 205.25 ± 10.15 г. было проведено моделирование септопластики стандартным методом путем зигзагообразной скарификации слизистой оболочки полости носа (рис. 1а) [10].
Рис. 1.
(а) Схема проведения моделирования септопластики. Стрелками указано направление скарификации слизистой перегородки носа. (б) Расположение субполей гиппокампа крысы. Иммуногистохимическая реакция анти-p53. Докрашивание гематоксилином Майера. Ув. ×100.

Пять крыс составили контрольную группу. За 10 мин до операции 15 крысам, которые составили экспериментальную группу, в целях общей анестезии внутрибрюшинно вводили раствор золетила 100 в дозировке 15 мг/кг. В экспериментальной группе крыс гуманную эвтаназию проводили на 2-е, 6-е и 14-е сутки после операции по 5 особей путем введения летальных доз золетила 100. Фиксацию головного мозга всем крысам проводили до трепанации черепа 10% раствором формалина в течение 5–10 мин. После трепанации черепа головной мозг фиксировали 10% раствором формалина, после чего заключали в парафиновые блоки. У каждой крысы получали 8 срезов головного мозга во фронтальной плоскости толщиной 4 мкм, которые окрашивали антителами к белку р53 с докрашиванием гематоксилином Майера и толуидиновым синим по Нисслю. Изучали субполя гиппокампа СА1, СА2, СА3 и зубчатую извилину (DG) (рис. 1б). В пирамидном слое субполей подсчитывали абсолютное количество нейронов, у которых была положительная ядерная реакция с антителами к белку p53, а также количество темных нейронов.
Полученные данные с помощью методов подсчета клеток были представлены как среднее значение ±SE. Затем их сравнивали между обеими группами с помощью t-теста с SPSS 21software.
Работа была выполнена в соответствии с Хельсинкской декларацией 1975 г. и ее пересмотренным вариантом 2000 г.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ.
Согласно критерию Манна–Уитни, в СА1 количество p53-позитивных нейронов достоверно повысилось на 2-й, 4-й (p < 0.001) и 6-й дни (p < 0.05) после проведения моделирования септопластики, по сравнению с контрольной группой (рис. 2).
Рис. 2.
P53-позитивные нейроны (а, в, д) (желтые стрелки, окр. мышиными моноклональными антителами к белку p53, ув. ×600) и темные нейроны (б, г, е) (синие стрелки, окр. толуидиновым синим по Нисслю, ув. ×400) в гиппокампе у крыс на 2-й (а, б), 4-й (в, г) и 6-й дни (д, е) после моделирования септопластики. Примечание: зелеными стрелками обозначены нормальные нейроны.

В динамике пик роста экспрессии белка p53 в цитоплазме нейронов СА1 и СА2 гиппокампа пришелся на 2-4-е сутки, а на 6-й день количество этих нейронов значимо снизилось (p < 0.001). В СА2 на 6-й день по p53-позитивным нейронам экспериментальная группа не отличалась от контрольной (рис. 3а). В СА3 на всех сроках после хирургического вмешательства было отмечено повышение экспрессии белка p53, по сравнению с контрольной группой (p < 0.001). В DG, по сравнению с контролем, количество p53-позитивных нейронов было значимо выше на всех сроках оценки. Пик численности этих клеток пришелся на 4-й день, по сравнению с остальными сроками (p < 0.001) (рис. 3а).
Рис. 3.
Динамика изменения количества p53-позитивных нейронов (p53) (а) и темных нейронов (б) при моделировании септопластики. Примечание: * – достоверные различия между данными контрольной группы и сроками после операции (p < 0.001); ∨ – достоверные различия между данными контрольной группы и сроками после операции (p < 0.05); † – достоверные различия между сроками после операции внутри экспериментальной группы (p < 0.001); ‡ – достоверные различия между сроками после операции внутри экспериментальной группы (p < 0.05).
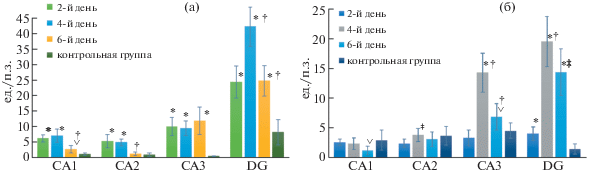
По количеству ТН в пирамидном слое гиппокампа в экспериментальной и контрольной группах распределение данных было не гауссово. В СА1 количество ТН на 2-й и 4-й дни достоверно не отличалось от контроля, но на 6-й день после операции было отмечено снижение их количества (p < 0.001) (рис. 2). В СА2 экспериментальная группа от контрольной значимо не различалась. Через 2 сут после операции был отмечен минимум количества ТН, по сравнению с 4-м днем (p < 0.001). В СА3 на 4-й день после операции наблюдался пик численности ТН, по сравнению с остальными днями (p < 0.001). В контроле количество ТН не отличалось от 2-го дня, но было достоверно ниже, по сравнению с 4-м (p < 0.001) и 6-м (p < 0.05) днями после операции (рис. 3б). В DG наблюдались схожие с СА3 результаты (рис. 3б).
Сопоставляя количество нейронов, в которых белок p53 экспрессировался в цитоплазму, и количество темных нейронов, была обнаружена положительная сильная связь на всех сроках оценки и во всех субполях гиппокампа (рис. 4). Самый низкий коэффициент детерминации был обнаружен при оценке субполя СА2 на 4-й день после операции (рис. 4е).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Апоптоз нейронов возникает при различных физиологических и патологических процессах и является генетически контролируемой формой гибели клеток [11]. Формирование темных нейронов в СА1 и СА3 гиппокампа крыс в настоящем исследовании, по-видимому, является типовой реакцией на стресс, в том числе и сопровождающийся воспалительными реакциями. Так, ранее было показано, что при моделировании острого перитонита у свиней и крыс в субполях CA1 и CA2 также наблюдается образование темных нейронов [12]. Это связывают с запуском механизмов апоптоза, так как рост количества ТН коррелирует с положительными TUNEL-нейронами [13]. Другие исследования также подтверждают, что сморщивание нейрона и его базофилия могут служить надежными критериями начинающейся его дегенерации [12]. Белок p53 активируется клеточным стрессом и повреждением ДНК и, в зависимости от тяжести стресса и конкретного типа клеток, может способствовать адаптивным ответам на стресс или может запускать остановку клеточного цикла или апоптоз [14]. Когда нормальные пролиферирующие клетки подвергаются повреждению ДНК, они реагируют одним из двух способов: остановка клеточного цикла или апоптоз, и р53 участвует в обоих этих процесcах [15]. Кроме широко изученной роли p53 как регулятора запуска апоптоза, была продемонстрирована и его нейропротективная роль [16]. Дефицит р53 приводит к более медленной пролиферации нейрональных стволовых клеток, потенциально из-за длительной фазы G2 [17]. Кроме того, было показано, что р53 служит для смягчения нарушения развития нейронов после облучения и, таким образом, может играть существенную роль в регулировании поздних эффектов в мозге после проведения радиотерапии [18]. Показано, что p53 регулирует некротическую гибель и аутофагическую активность нейронов [19]. В предыдущих исследованиях нами было продемонстрировано, что при моделировании септопластики в гиппокампе у крыс встречаются нейроны, в которых белок p53 появляется как исключительно в цитоплазме, так и в ядре. В последнем случае нейроны носили характерные морфологические признаки дегенерации – склеивание хроматина, нечеткость границ ядра, а в ряде случаев – распад клетки [4]. Можно предположить, что p53 может и не носить исключительно роль регулятора апоптоза.
Ранее также было показано, что темные нейроны могут как восстанавливать свое морфо-функциональное состояние за счет увеличения цистерн гранулярной эндоплазматической сети с образованием мембранных завитков, переходом этого процесса на астроцитарные отростки и, как следствие, с последующим снижением степени структурного уплотнения клетки [8], так и быть признаком конечного некротического распада клетки не зависимо от причины гибели нейрона, в том числе и от различных биохимических каскадов апоптоза [9]. Запуск апоптоза и/или повреждение нейронов гиппокампа в дальнейшей перспективе может привести к различным нейробиологическим последствиям – нарушению памяти, поведенческих реакций и др. [20]. Ранее нами было показано, что моделирование септопластики у крыс провоцирует повышение тонуса симпатической нервной системы и концентрации кортикостерона в плазме крови в течение первых 4–5 дней после операции [20], что косвенно свидетельствует о наличии причинно-следственных связей между нарушением баланса вегетативной нервной системы, активацией гипоталамо-гипофизарно-надпочечниковой оси, появлением “темных” и p52-позитивных нейронов в пирамидном слое гиппокампа и, как следствие, нарушений поведенческих реакций [20]. Кроме того, в предыдущих исследованиях нами были получены результаты, демонстрирующие, что при данном виде хирургических вмешательств развивается тревожное состояние у крыс [10], что можно связать не только с развитием общих воспалительных реакций, но и с сенсорной депривацией периферического отдела обонятельного анализатора [6].
Обнаруженные нами в настоящем исследовании высокие коэффициенты детерминации подтверждают теорию того, что вероятнее всего появление темных нейронов в гиппокампе и зубчатой извилине тесно связано с экспрессией белка p53 при хирургическом стрессе, спровоцированном моделированием септопластики у крыс.
ЗАКЛЮЧЕНИЕ
Появление темных и p53-позитивных нейронов в гиппокампальной формации у крыс после моделирования септопластики является типовыми ответными реакциями нервной ткани на стресс. Очевидно, что экспрессия белка p53 связана с базофилией цитоплазмы нейронов, их морфофункциональным состоянием. Предположительно белок p53 может запускать не только активацию поврежденных нейронов в гиппокампе, но и играть нейропротективную роль. Предстоящие исследования должны определить роль белка p53 в дальнейшей судьбе поврежденных нейронов в пирамидном слое и дифференцировать механизмы его экспрессии.
Список литературы
Dragunova S.G., Reshetov I.V., Kosyreva T.F., Severin A.E., Khamidulin G.V., Shmaevsky P.E., Inozemtsev A.N., Popadyuk V.I., Kastyro I.V., Yudin D.K., Yunusov T.Yu., Kleyman V.K., Bagdasaryan V.V., Alieva S.I., Chudov R.V., Kuznetsov N.D., Pinigina I.V., Skopich A.A., Kostyae-va M.G. Comparison of the Effects of Septoplasty and Sinus Lifting Simulation in Rats on Changes in Heart Rate Variability. // Doklady Biochemistry and Biophysics. 2021. V. 498. P. 165–169.
Demyashkin G.A., Kastyro I.V., Sidorin A.V., Borisov Y.S. The specific immunophenotypic features of nasopharyngeal carcinoma. // Vestnik Otorinolaringologii. 2018. V. 83. № 5. P. 40–44.
Haider S., Naqvi F., Batool Z., Tabassum S., Perveen T., Saleem S., Haleem D.J. Decreased Hippocampal 5-HT and DA Levels Following Sub-Chronic Exposure to Noise Stress: Impairment in both Spatial and Recognition Memory in Male Rats. Sci Pharm. 2012. V. 80. № 4. P. 1001–1011.
Kastyro I.V., Reshetov I.V., Khamidulin G.V., Shilin S.S., Torshin V.I., Kostyaeva M.G., Popadyuk V.I., Yunusov T.Y., Shmaevsky P.E., Shalamov K.P., Kupryakova A.D., Doroginskaya E.S., Sedelnikova A.D. Influence of Surgical Trauma in the Nasal Cavity on the Expression of p53 Protein in the Hippocampus of Rats. // Doklady Biochemistry and Biophysics. 2021. V. 497. P. 99–103.
Kirichuk V.F., Tsymbal A.A. Use of terahertz electromagnetic radiation at nitric oxide frequencies for the correction of thyroid functional state during stress. // Vestnik Rossiiskoi Akademii Meditsinskikh Nauk. 2010. V. 4. P. 37–40.
Sheahan S., Bellamy C.O., Treanor L., Harrison D.J., Prost S. Additive effect of p53, p21 and Rb deletion in triple knockout primary hepatocytes. // Oncogene. 2003. V. 23. № 8. P. 1489–1497.
Merlo P., Frost B., Peng S., Yang Y.J., Park P.J., Feany M. p53 prevents neurodegeneration by regulating synaptic genes // Proc Natl Acad Sci USA. 2014. V. 111. № 50. P. 18055–18060.
Csordás A., Mázló M., Gallyas F. Recovery versus death of “dark” (compacted) neurons in non-impaired parenchymalenvironment. Light and electron microscopic observations // Acta Neuropathol. 2003. V. 106. P. 37–49.
Kövesdi E., Pál J., Gallyas F. The fate of “dark” neurons produced by transient focal cerebral ischemia in a non-necrotic and non-excitotoxic environment: Neurobiological aspects // Brain Research. 2007. V. 1147. P. 272–283.
Kastyro I.V., Reshetov I.V., Khamidulin G.V., Shmaevsky P.E., Karpukhina O.V., Inozemtsev A.N., Torshin V.I., Ermakova N.V., Popadyuk V.I. The Effect of Surgical Trauma in the Nasal Cavity on the Behavior in the Open Field and the Autonomic Nervous System of Rats // Doklady Biochemistry and Biophysics. 2020. V. 492. P. 121–123.
Saeedi Borujeni M.J., Hami J., Haghir H., Rastin M., Sazegar Gh. Evaluation of Bax and Bcl-2 Proteins Expression in the Rat Hippocampus due to childhood Febrile Seizure // Iran J Child Neurol. 2016. V. 10. № 1. P. 53–60.
Ari I., Kafa I.M., Kurt M.A. Morphometric investigation of neurons in the hippocampal CA1, CA3 areas and dentate gyrus in a rat model of sepsis // Int. J. Morphol. 2010. V. 28. № 1. P. 183–192.
Rezaei M., Sazegar G., Homayoun M. Effect of chronic noise exposure on neuron in the hippocampus of wistar rats // International Journal of Advanced Biotechnology and Research (IJBR). 2016. V. 7. № 2. P. 434–442.
Joers A., Jaks V., Kase J., Toivo M. p53-dependent transcrip- tion can exhibit both on/off and graded response after genotoxic stress // Oncogene. 2004. V. 23. № 37. P. 6175–85.
Bellamy C. p53 and apoptosis // British Medical Bulletin. 1997. V. 53. № 3. P. 522–538.
Khurana V., Merlo P., DuBoff B., Fulga T.A., Sharp K.A., Campbell S.D., Götz J., Feany M.B. A neuroprotective role for the DNA damage checkpoint in tauopathy // Aging Cell. 2012. V. 11. № 2. P. 360–362.
Marin Navarro A., Pronk R.J., van der Geest A.T., Oliynyk G., Nordgren A., Arsenian-Henriksson M., Falk A., Wilhelm M. p53 controls genomic stability and temporal differentiation of human neural stem cells and affects neural organization in human brain organoids // Cell Death Dis. 2020. V. 11. P. 52.
Li Y.-Q., Cheng Z.W.-C., Liu S.K.-W., Aubert I., Wong C.S. P53 regulates disruption of neuronal development in the adult hippocampus after irradiation // Cell Death Discovery. 2016. V. 2. P. 16072.
Wang D.B., Kinoshita C., Kinoshita Y., Morrison R.S. p53 and mitochondrial function in neurons // Biochim Biophys Acta. 2014. V. 1842. № 8. P. 1186–97.
Kastyro I.V., Reshetov I.V., Popadyuk V.I., Torshin V.I., Ermakova N.V., Karpukhina O.V., Inozemtsev A.N., Khamidulin G.V., Shmaevsky P.E., Sardarov G.G., Gordeev D.V., Scopich A.A. Studying the physiological effects of a new model of septoplasty in rats // Head and Neck Russian Journal. 2020. V. 8. № 2. P. 33–38.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни



