Доклады Российской академии наук. Науки о жизни, 2022, T. 503, № 1, стр. 197-202
Сравнительное исследование влияния ядов змей на рост инфузорий Tetrahymena pyriformis: идентификация ядов с высокой антипротозойной активностью
Е. Г. Черемных 1, А. В. Осипов 2, В. Г. Старков 2, Ч. Т. Т. Нгуен (Nguyen Thi Thuy Trang) 3, Х. К. Нгуен (Nguyen Cuu Khoa) 4, А. Н. Хоанг (Hoang Ngoc Anh) 4, З. Т. Ле (Le Tien Dung) 4, член-корреспондент РАН В. И. Цетлин 2, Ю. Н. Уткин 2, *
1 Федеральное государственное бюджетное учреждение Научный центр психического здоровья (НЦПЗ)
Москва, Россия
2 ФГБУН Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова
Москва, Россия
3 Университет им. Нгуен Тат Тхань
Хо Ши Мин, Вьетнам
4 Институт Наук о Прикладных Материалах Вьетнамской Академии Наук и Технологий
Хо Ши Мин, Вьетнам
* E-mail: utkin@ibch.ru
Поступила в редакцию 20.10.2021
После доработки 25.12.2021
Принята к публикации 25.12.2021
- EDN: FRLESN
- DOI: 10.31857/S2686738922020068
Аннотация
Для поиска соединений с антипротозойной активностью исследовано влияние ядов змей на инфузорий Tetrahymena pyriformis из подцарства Protozoa, включающего и возбудителей протозойных инфекций. T. pyriformis использована как модельный организм для выбора ядов, наиболее активных против паразитических простейших. К клеткам добавляли различные концентрации ядов и регистрировали число выживших через 24 часа. Из исследованных ядов шести видов змей семейства Viperidae наибольшую активность проявил яд гадюки Vipera berus, полностью убивавший клетки при 49 мкг/мл. Из ядов четырех видов змей семейства Elapidae наиболее активными оказались исследованные нами ранее яды кобр, содержащие цитотоксины с высокой антипротозойной активностью, а также яд крайта Bungarus multicinctus (10 мкг/мл). Яды щитомордников и гадюки Никольского не проявили активности при концентрациях до 12.5 мг/мл. Таким образом, перспективными для выделения новых антипротозойных соединений являются яды V. berus и B. multicinctus.
Инфекционные заболевания являются актуальной социально-медицинской проблемой практически во всех регионах мира, и не малая доля из них обусловлена протозойными инфекциями, т.е. заболеваниями, вызываемыми простейшими. Протозойными инфекциями (протозоозами) поражены сотни миллионов человек, проживающих преимущественно в странах Азии, Африки и Латинской Америки. Лечение протозойных заболеваний имеет ограниченную эффективность и серьезные побочные эффекты (например, [1]). Помимо этого, эффективному лечению препятствует развитие лекарственной устойчивости у возбудителей заболеваний [2]. Токсичность лекарств, трудности введения и длительность лечения, а также их низкая эффективность стимулируют поиск новых природных антипротозойных соединений, например, среди компонентов животных ядов. Животные яды – это естественные библиотеки биологически активных соединений, которые могут давать новые лекарственные препараты для фармакотерапии. В частности, змеиные яды оказались перспективными источниками потенциальных новых антипротозойных агентов [3].
Так, недавно, используя в качестве модельных организмов инфузорий Tetrahymena pyriformis, мы установили, что яды кобр обладают высокой антипротозойной активностью [4]. Идентификация активных соединений показала, что антипротозойную активность проявляют цитотоксины, относящиеся к семейству трехпетельных белков. Однако цитотоксины обладают сравнительно высокой токсичностью для позвоночных и их использование в качестве антипротозойных препаратов не перспективно. Например, цитотоксины кобры Naja oxiana имеют ЛД50 в диапазоне 1–2 мг/кг [5]. Целью данной работы явился поиск соединений, менее токсичных для позвоночных, в ядах различных видов змей.
Яд одного вида змеи может содержать до нескольких сотен различных соединений, обычно называемых токсинами. Однако основная часть токсинов относится примерно к полутора десяткам семейств, наиболее представленными из которых являются фосфолипазы А2, сериновые и металлопротеиназы, а также трехпетельные токсины. Кроме цитотоксинов кобр, антипротозойная активность была продемонстрирована для фосфолипаз А2 [6] и оксидаз L-аминокислот [7]. При этом параметры токсичности фосфолипаз А2 очень сильно различались в зависимости от вида простейшего и вида змеи, из яда которой была выделена фосфолипаза А2. Так, при подавлении внутриэритроцитарного развития Plasmodium falciparum, вызывающего малярию, фосфолипазой А2 из яда кобры N. mossambica величина IC50 составила 0.032 нг/мл. В то же время при подавлении жизнеспособности клеток промастиготной формы Leishmania infantum, возбудителя висцерального лейшманиоза, фосфолипазой А2 BmajPLA2-II из яда ботропса Bothrops marajoensis IC50 не достигалась даже при концентрации 100 мкг/мл [6]. Оксидаза L-аминокислот BjussuLAAO-II из яда жараракусу B. jararacussu оказала токсическое действие на L. amazonensis, вызывающего кожный лейшманиоз, (IC50 4.56 мкг/мл) и Trypanosoma cruzi, вызывающего болезнь Шагаса (IC50 4.85 мкг/мл) [7]. Довольно высокую активность против простейших продемонстрировал кротамин, полипептид, принадлежащий к семейству миотоксинов, из яда гремучей змеи Crotalus durissus terrificus. Кротамин оказывал сильное ингибирующее влияние на скорость роста L. amazonensis (IC50 = 25.65 ± 0.52 мкг/мл) [9]. Кротамин проявил сильную антиплазмодиальную активность и ингибировал дозозависимым образом развитие паразитов P. falciparum, вызывающего малярию (IC50 = 9.13 мкг/мл) [10]. Среди других компонентов ядов змей, проявляющих антипротозойную активность, следует отметить кровирин, цистеин-богатый секреторной белок (CRISP) из C. viridis viridis (IC50 = 1–2 мкг/мл в зависимости от вида паразитического простейшего) [10]. Кроме того, дизинтегрин, выделенный из яда Cerastes cerastes, проявлял токсичность в отношении промастигот L. infantum [11]. При концентрации 0.1 мкг/мл это дизинтегрин вызывал гибель 97.6% промастигот через 72 ч [11].
Следует отметить, трипаносомоз, вызываемый простейшими рода Trypanosoma, и лейшманиоз, вызываемый простейшими рода Leishmania, представляют серьезную проблему для тропических регионов американского континента [12, 13]. Там же, в частности, в Бразилии, проводятся интенсивные исследования ядов змей и находится крупнейший в мире центр по исследованию ядовитых животных – Институт Бутантан (Instituto Butantan) [14]. Эти факты способствовали тому, что исследования по влиянию ядов змей на простейших выполнены, в основном, с применением ядов южноамериканских видов змей, относящихся к семейству Viperidae. При этом наиболее изучена антипротозойная активность ядов змей двух основных южноамериканских родов – американских копьеголовых змей (Bothrops/Bothropoides) и настоящих гремучников (Crotalus) [15]. В то же время практически отсутствуют данные об антипротозойной активности ядов змей семейства Viperidae, обитающих в Европе и Азии.
Целью настоящего исследования явились скрининг ядов змей и выявление наиболее перспективных для создания на их основе антипротозойных препаратов. В нашей работе мы поставили задачу исследовать яды евразийских змей: гадюк Vipera berus, V. nikolskii и V. ursinii renardi, а также щитомордников Gloydius blomhoffii и G. saxatilis и куфии Trimeresurus albolabris. Поскольку имелось сообщение об антилейшманиозной активности яда крайта Bungarus caeruleus [16], была поставлена задача исследовать также активность ядов двух других видов крайтов B. fasciatus и B. multicinctus. Яд кобры N. kaouthia, для которого ранее было показано наличие антипротозойной активности [4], использован в качестве контроля. Также были исследованы ранее не изученные яды кобры N. atra и скорпиона Heterometrus laoticus.
Исследование проводили на инфузориях T. pyriformis с применением приборно-вычислительного комплекса для автоматизированного биотестирования с системой визуализации и программным обеспечением для математической обработки данных БиоЛат-3.2 (ООО “Европолитест”, Московская обл., г. Пушкино). Использованная нами методика включает процедуру подсчета клеток тест-организмов инфузорий T. pyriformis, которая позволяет получить достоверный результат за короткое время (≤24 ч). Для сравнения токсической активности исследуемых ядов змей нами использован способ кратных разведений проб исследуемых объектов. Этот прием общепринят в практике оценки токсичности с помощью биологических методов. То есть методика оценки степени антипротозойной активности ядов змей для выбора наиболее эффективных препаратов, как наиболее токсичных для простейших, основана и на процедуре подсчета клеток в пробе, и на приеме кратных разведений.
Все эксперименты проводили на четырехсуточных инфузориях, которые культивировали по закрытой системе в стерильных условиях. Суспензию инфузорий из культивационной пробирки разводили в десять раз дистиллированной водой. Для контроля в опытах также использовали дистиллированную воду. В лунки планшета прибора БиоЛат-3.2 вносили 290 мкл проб, представляющих собой водные растворы ядов змей в различных концентрациях (табл. 1), включали программу AutoCiliata и помещали планшет с пробами в прибор. После оценки программой лунок с пробами без инфузорий вносили в каждую лунку суспензию инфузорий, содержащую 500–1000 клеток. Каждое разведение повторяли в 3 лунках. Далее производили десятикратный программный подсчет клеток и фиксировали результаты. Планшет помещали в термостат и через 24 ч повторно с использованием программы подсчитывали инфузорий во всех заданных лунках. Для количественной оценки рассчитывали коэффициенты выживаемости/роста (К)
где А24 – количество живых инфузорий в пробе после 24-часовой экспозиции; А0 – количество живых инфузорий в начале опыта. Коэффициенты роста/выживаемости по каждому разведению вычисляли как среднее по трем коэффициентам для лунок с одинаковыми пробами. В наших контрольных опытах, состоящих в 24-часовой экспозиции инфузорий в дистиллированной воде, этот коэффициент определяется соотношением: 2.5 ≥ К ≥ 2. Кроме того, для определения чувствительности простейших нами использовался раствор CuSO4 (0.1 мкМ), который вызывал гибель всех клеток в течение одного часа. Для определения зависимости гибели клеток от времени инкубации проводили регистрацию выживших инфузорий в течение часа. В краткосрочном эксперименте использовали от 2000 до 4000 клеток.Таблица 1.
Коэффициенты выживаемости1 инфузорий T. pyriformis в растворах ядов при экспозиции 24 ч
| Концентра-ция яда, мкг/мл | Вид животного2 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| NA | NK | BM | BF | VB | VU | TA | VN | GB | GS | HL | |
| Коэффициент выживаемости (К) | |||||||||||
| 12 500 | –3 | – | – | 0 | 0 | 0 | 0 | 3.22 ± 0.164 | 4.93 ± 0.18 | 3.1 ± 0.16 | 4.56 ± 0.21 |
| 6250 | – | – | – | 0 | 0 | 0 | 0 | 2.84 ± 0.23 | 4.71 ± 0.19 | 2.47 ± 0.22 | 4.47 ± 0.12 |
| 3120 | – | – | – | 0 | 0 | 0 | 0 | 2.19 ± 0.19 | 4.42 ± 0.12 | 2.26 ± 0.12 | 3.66 ± 0.2 |
| 1560 | – | – | – | 0 | 0 | 0 | 0 | 1.79 ± 0.18 | 2.93 ± 0.15 | 1.48 ± 0.11 | 3.43 ± 0.15 |
| 1000 | 0 | 0 | 0 | – | – | – | – | – | – | – | – |
| 780 | – | – | – | 0 | 0 | 1.19 ± 0.1 | 0.99 ± 0.11 | 1.51 ± 0.14 | 2.55 ± 0.17 | 1.61 ± 0.12 | 2.5 ± 0.15 |
| 390 | – | – | – | 0 | 0 | 1.79 ± 0.2 | 0.94 ± 0.14 | 2 ± 0.16 | 1.72 ± 0.14 | 1.34 ± 0.15 | 2.54 ± 0.13 |
| 195 | – | – | – | 0 | 0 | 2.92 ± 0.18 | 1.06 ± 0.15 | 2.13 ± 0,2 | 1.48 ± 0.08 | 0.96 ± 0.13 | 2.33 ± 0.15 |
| 100 | 0 | 0 | 0 | – | – | – | – | – | – | – | – |
| 98 | – | – | – | 2.08 ± 0.13 | 0 | 2.94 ± 0.14 | 1.37 ± 0.15 | 2.17 ± 0.13 | 1.55 ± 0.16 | 1.75 ± 0.16 | 2.38 ± 0.14 |
| 49 | – | – | – | 1.96 ± 0.21 | 0 | 1.64 ± 0.13 | – | – | – | – | – |
| 24 | – | – | – | 2.34 ± 0.15 | 1.53 ± 0.05 | 2.47 ± 0.16 | – | – | – | – | – |
| 12 | – | – | – | 3 ± 0.1 | 2.29 ± 0.2 | 2.39 ± 0.1 | – | – | – | – | – |
| 10 | 0 | 0 | 0 | – | – | – | – | – | – | – | – |
| 6 | – | – | – | 3.91 ± 0.25 | 2.49 ± 0.1 | 3.97 ± 0.23 | – | – | – | – | – |
| 3 | – | – | – | 3.48 ± 0.14 | 2.54 ± 0.17 | 2.2 ± 0.12 | – | – | – | – | – |
| 1.5 | – | – | – | 3.58 ± 0.09 | 2.06 ± 0.12 | 1.66 ± 0.18 | – | – | – | – | – |
| 1 | 0 | 0 | 1.99 ± 0.22 | – | – | – | – | – | – | – | – |
| 0.8 | – | – | – | 3.4 ± 0.1 | 2.33 ± 0.07 | 1.85 ± 0.08 | – | – | – | – | – |
| 0.1 | 2.0 ± 0.154 | 2.42 ± 0.09 | 1.9 ± 0.15 | – | – | – | – | – | – | – | – |
| 0.01 | 1.93 ± 0.07 | 2.7 ± 0.15 | 3.04 ± 0.14 | – | – | – | – | – | – | – | – |
1 Коэффициент выживаемости – отношение числа живых инфузорий в растворах ядов к числу живых инфузорий в контроле. 2 NA – кобра N. atra, NK – кобра N. kaouthia, BM – крайт B. multicinctus, BF – крайт B. fasciatus, VB – гадюка V. berus, VU – гадюка V. ursinii renardi, VN – гадюка V. nikolskii, TA – куфия T. albolabris, GB – щитомордник G. blomhoffii, GS – щитомордник G. saxatilis, HL – скорпион H. laoticus. 3 Дефис означает, что при данной концентрации анализ не проводился. 4 Среднее по трем измерениям ± стандартное отклонение.
Результаты исследования ядов четырех видов змей семейства Elapidae (кобры и крайты), шести видов змей семейства Viperidae и одного вида скорпиона приведены в табл. 1. Как видно из таблицы, коэффициенты выживаемости сильно зависели от концентрации яда и вида ядовитого животного. Коэффициенты, равные нулю, свидетельствуют о полной гибели инфузорий. Наиболее токсичными для T. pyriformis оказались яды кобр N. atra и N. kaouthia. Их яд убивал инфузории при концентрации 1 мкг/мл. Ранее мы показали, что в ядах кобр активными компонентами, вызывающими гибель инфузорий, являются цитотоксины [4].
Существенную токсичность по отношению к T. pyriformis проявил также яд крайта B. multicinctus, приводивший к гибели всех клеток при концентрации 10 мкг/мл. Менее активным оказался яд другого крайта B. fasciatus, показавший активность в концентрации около 200 мкг/мл. При разведениях яда крайта B. fasciatus до 12 мкг/мл и менее наблюдали увеличение коэффициента роста клеток T. pyriformis по сравнению с контролем. Этот же эффект для крайта B. multicinctus выявлен при концентрации яда 10 нг/мл. По-видимому, разная активность этих ядов по отношению к простейшим объясняется отличиями в их составе. Так, с использованием количественной протеомики было показано, что в яде B. multicinctus почти половина (45%) белков по массе представлена β-бунгаротоксинами, за ними следуют трехпетельные токсины (28%) и фосфолипазы А2 (16%), при этом другие белки присутствуют на уровне 1–3% [17]. В противоположность ему, яд B. fasciatus содержит крайне низкое количество трехпетельных токсинов (1%) и β-бунгаротоксинов (менее 1%), а основным компонентом являются фосфолипазы А2 (71%); за ними следуют оксидаза L-аминокислот (8%), ацетилхолинэстераза (5%) и металлопротеиназы (4%) [17]. Обнаруженный эффект усиленного роста клеток T. pyriformis по сравнению с контролем при разведении яда указывает на изменение направления воздействия, т.е. некоторые компоненты ядов, вероятно, могут усиливать рост клеток при уменьшении концентрации ингибирующих компонентов.
Из исследованных ядов змей семейства Viperidae наибольшую активность проявил яд обыкновенной гадюки V. berus, вызвавший гибель клеток при концентрации около 50 мкг/мл. Менее активными оказались яды степной гадюки V. ursinii renardi и белогубой куфии T. albolabris. Эти яды полностью убивают клетки при концентрации 1.56 мг/мл. Яды щитомордников G. blomhoffii и G. saxatilis, гадюки Никольского, а также скорпиона Heterometrus laoticus не проявили антипротозойной активности в концентрациях до 12.5 мг/мл. Наоборот, в высоких концентрациях они благоприятствуют росту инфузорий и, по-видимому, содержат соединения, ускоряющие рост микроорганизмов или являются для них питательной средой.
В краткосрочном опыте яд V. berus также показал высокую токсичность для простейших. При концентрации 1 мг/мл гибель всех клеток происходила в течение 10 мин (рис. 1). В то же время яды V. nikolskii и G. blomhoffii не проявили никакого эффекта при концентрации 6 мг/мл (рис. 2).
Рис. 1.
Изменение количества живых клеток T. pyriformis в зависимости от времени действия различных концентраций яда гадюки V. berus.
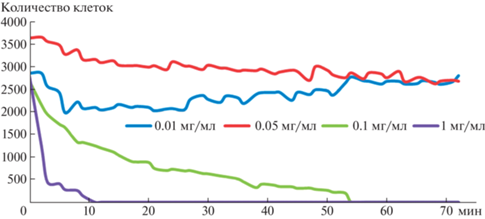
Рис. 2.
Изменение количества живых клеток T. pyriformis в зависимости от времени действия различных концентраций ядов гадюки V. nikolskii (VN) и щитомордника G. blomhoffii (GB).

Все изученные нами яды в том или ином количестве содержат фосфолипазы А2 и оксидазы L-аминокислот, яды змей семейства Viperidae – дизинтегрины, но ни один из ядов не содержит кротамин. Следует отметить, что яд B. multicinctus не содержит цитотоксины [17], но лишь на порядок менее активен, чем яды кобр (табл. 1). С другой стороны, он примерно на порядок более активен, чем яд B. fasciatus, содержание фосфолипаз А2 и оксидазы L-аминокислот в котором существенно выше [17]. Яд V. berus, проявивший самую высокую активность среди ядов змей семейства Viperidae, содержит меньше фосфолипаз А2, чем яды V. ursinii renardi и V. nikolskii [18, 19], а содержание оксидазы L-аминокислот в яде V. berus немного выше, чем в ядах других гадюк: приблизительно в два раза выше, чем в яде V. ursini renardi [18, 19], что не может объяснить 30-кратную разницу в их антипротозойной активности.
Таким образом, нельзя исключить, что яды V. berus и B. multicinctus содержат некоторые специфические соединения с антипротозойным эффектом. Какие конкретно компоненты этих ядов отвечают за антипротозойную активность, будет выявлено в последующих исследованиях.
Список литературы
Sperandio da Silva G.M., Mediano M.F., Alvarenga Americano do Brasil P.E., et al. A clinical adverse drug reaction prediction model for patients with chagas disease treated with benznidazole. // Antimicrob. Agents Chemother. 2014. V. 58. № 11. P. 6371–6377.
Meyer A., Holt H.R., Selby R., Guitian J. Past and ongoing tsetse and animal trypanosomiasis control operations in five African countries: a systematic review. // PLoS Negl Trop Dis. 2016. V. 10. № 12. P. e0005247.
Adade C.M., Souto-Padrón T. Venoms as Sources of Novel Anti-Parasitic Agents. In: Toxins and Drug Discovery. Gopalakrishnakone P., Cruz L., Luo S. (eds) 2017. P. 401–436. Springer, Dordrecht.
Kuleshina O.N., Kruykova E.V., Cheremnykh E.G., et al. Screening snake venoms for toxicity to Tetrahymena pyriformis revealed anti-protozoan activity of cobra cytotoxins. // Toxins (Basel). 2020. V. 12. № 5. P. 325.
Гришин Е.В., Сухих А.П., Адамович Т.Б., Овчинни-ков Ю.А. Выделение, свойства и аминокислотная последовательность двух цитотоксинов из яда среднеазиатской кобры Naja naja oxiana. // Биоорг. химия 1976. Т. 2. № 8. С. 1018–1034.
Teixeira S.C., da Silva M.S., Gomes A.A.S., et al. Panacea within a Pandora’s box: the antiparasitic effects of phospholipases A2 (PLA2s) from snake venoms. // Trends Parasitol. 2021. P. S1471–4922(21)00169-0.
Carone S.E.I., Costa T.R., Burin S.M., et al. A new l-amino acid oxidase from Bothrops jararacussu snake venom: Isolation, partial characterization, and assessment of pro-apoptotic and antiprotozoal activities. // Int. J. Biol. Macromol. 2017. V. 103. P. 25–35.
Katz S., Barbiéri C.L., Soler F.P.M., et al. Effect of Isolated Proteins from Crotalus Durissus Terrificus Venom on Leishmania (Leishmania) Amazonensis-Infected Macrophages. // Protein Pept. Lett. 2020. V. 27. № 8. P. 718–724.
El Chamy Maluf S., Dal Mas C., Oliveira E.B., et al. Inhibition of malaria parasite Plasmodium falciparum deve-lopment by crotamine, a cell penetrating peptide from the snake venom. // Peptides. 2016. V. 78. P. 11–16.
Adade C.M., Carvalho A.L., Tomaz M.A., et al. Crovirin, a snake venom cysteine-rich secretory protein (CRISP) with promising activity against Trypanosomes and Leishmania. // PLoS Negl. Trop. Dis. 2014. V. 8. № 10. P. e3252.
Allane D., Oussedik-Oumehdi H., Harrat Z., et al. Isolation and characterization of an anti-leishmanial disintegrin from Cerastes cerastes venom. // J. Biochem. Mol. Toxicol. 2018. V. 32. № 2.
Miles M.A., Llewellyn M.S., Lewis M.D., et al. The molecular epidemiology and phylogeography of Trypanosoma cruzi and parallel research on Leishmania: looking back and to the future. // Parasitology. 2009. V. 136. № 12. P. 1509–1528.
Romero G.A., Boelaert M. Control of visceral leishmaniasis in Latin America-a systematic review. // PLoS Negl. Trop. Dis. 2010. V. 4. № 1. P. e584.
Grego K.F., Vieira S.E.M., Vidueiros J.P., et al. Maintenance of venomous snakes in captivity for venom production at Butantan Institute from 1908 to the present: a scoping history. // J. Venom Anim. Toxins Incl. Trop. Dis. 2021. V. 27. P. e20200068.
Abdullahi Z.U., Musa S.S., He D., et al. Antiprotozoal Effect of Snake Venoms and Their Fractions: A Systematic Review. // Pathogens. 2021. V. 10. № 12. P. 1632.
Bhattacharya S., Ghosh P., De T., Gomes A., et al. In vivo and in vitro antileishmanial activity of Bungarus caeruleus snake venom through alteration of immunomodulatory activity. // Exp. Parasitol. 2013. V. 135. № 1. P. 126–33.
Ziganshin R.H., Kovalchuk S.I., Arapidi G.P., et al. Quantitative proteomic analysis of Vietnamese krait venoms: Neurotoxins are the major components in Bungarus multicinctus and phospholipases A2 in Bungarus fasciatus. // Toxicon. 2015. V. 107. Pt. B. P. 197–209.
Kovalchuk S.I., Ziganshin R.H., Starkov V.G., et al. Quantitative proteomic analysis of venoms from Russian vipers of Pelias group: phospholipases A2 are the main venom components. // Toxins (Basel). 2016. V. 8. № 4. P. 105.
Al-Shekhadat R.I., Lopushanskaya K.S., Segura Á., et al. Vipera berus berus venom from Russia: venomics, bioactivities and preclinical assessment of Microgen antivenom. // Toxins (Basel). 2019. V. 11. № 2. P. 90.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


