Доклады Российской академии наук. Науки о жизни, 2022, T. 503, № 1, стр. 177-182
Обнаружение и некоторые свойства стимулятора светоизлучения базидиомицета Neonothopanus nambi
Н. О. Ронжин 1, *, Е. Д. Посохина 1, О. А. Могильная 1, В. С. Бондарь 1
1 Институт биофизики Федерального исследовательского центра “Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
* E-mail: roniol@mail.ru
Поступила в редакцию 09.12.2021
После доработки 23.12.2021
Принята к публикации 23.12.2021
- EDN: THDUVL
- DOI: 10.31857/S2686738922020172
Аннотация
В водном экстракте из мицелия светящегося базидиомицета Neonothopanus nambi после его обработки β-глюкозидазой обнаружен стимулятор светоизлучения гриба. Добавки экстракта к светящемуся мицелию увеличивают уровень световой эмиссии от нескольких раз до 1.5 порядков и более. Стимулятор свечения является низкомолекулярным, термостабильным соединением – выявляется в подмембранной фракции при фильтрации экстракта через мембрану с пределом исключения 10 кДа, сохраняет стимулирующий эффект после термообработки при 100°С в течение 5 мин. В спектре поглощения водного образца стимулятора наблюдаются два основных пика в коротковолновой области (205 и 260 нм) и плечо в диапазоне 350–370 нм. Стимулятор свечения обладает синей флуоресценцией с максимумом эмиссии 440 нм при возбуждении длиной волны 360 нм. Установлено, что стимулирующий свечение компонент не является субстратом (или его предшественником) люминесцентной системы гриба N. nambi.
В недавних исследованиях мы использовали оригинальный способ обработки мицелия светящегося базидиомицета Neonothopanus nambi β-глюкозидазой для выделения его экстраклеточных ферментов с оксидазной функцией [1]. В дополнительных экспериментах с полученными водными экстрактами мы обнаружили интересный эффект. Добавки аликвот экстракта к образцам светящегося мицелия N. nambi значительно увеличивали интенсивность их световой эмиссии. При этом сами экстракты не обладали регистрируемым свечением. Это позволило высказать предположение, что в экстрактах присутствует компонент, который стимулирует свечение гриба.
Настоящая работа посвящена изучению некоторых свойств обнаруженного стимулятора свечения базидиомицета N. nambi.
В работе использовали мицелий высшего гриба N. nambi IBSO 2391 из Коллекции микроорганизмов (CCIBSO 836) Института биофизики ФИЦ КНЦ СО РАН (Красноярск), который был ранее предоставлен Н.В. Псурцевой из Коллекции культур базидиомицетов LE-BIN Ботанического института РАН (Санкт-Петербург). Эксперименты проводили с шарообразными пеллетами мицелия диаметром 2–7 мм, полученными при глубинном культивировании гриба в жидкой картофельно-сахарозной среде (“HiMedia Laboratory”, Индия) [1]. Выращивание биомассы проводили в течение 8 сут. После культивирования пеллеты извлекали из питательной среды и многократно промывали деионизированной (ДИ) водой (Milli-Q system, “Millipore”, США) для удаления остатков питательной среды и метаболитов. Водный экстракт, содержащий стимулятор свечения базидиомицета N. nambi, получали следующим образом. Отмытые пеллеты мицелия помещали в свежий объем ДИ воды, содержащей β-глюкозидазу из сладкого миндаля (“Serva”, Германия) в концентрации 0.5 МЕ/мл, и инкубировали при 25°C в течение 24 ч при медленном перемешивании со скоростью 80 об/мин (шейкер OS-10, “BIOSAN”, Латвия). Исходный раствор β-глюкозидазы готовили в 10 мM фосфатном буфере (рН 6.0). После инкубации жидкую часть (водный экстракт) отделяли от биомассы фильтрацией через бумажный фильтр. Разделение высоко- и низкомолекулярных компонентов полученного экстракта проводили с помощью его ультрафильтрации через мембрану с пределом исключения 10 кДа (“EMD Millipore Amicon, Darmstadt”, Германия). Для более полного отделения низкомолекулярных соединений от высокомолекулярных компонентов при ультрафильтрации экстракта в нем трижды заменяли ДИ воду, каждый раз собирая подмембранные фильтраты. После завершения диализа надмембранную фракцию, содержащую высокомолекулярные компоненты экстракта (экстраклеточные белки и ферменты гриба), отбирали и использовали в исследованиях. Содержащие низкомолекулярные компоненты подмембранные фильтраты объединяли и концентрировали на роторном испарителе Rotavapor R-215 (“Buchi”, Швейцария). Полученный концентрат использовали в экспериментах.
Спектральные исследования водных образцов, содержащих низкомолекулярные компоненты (экстракт, концентрат и пробы после его хроматографии), проводили на спектрофотометре UV-1800 (“Shimadzu”, Япония) и спектрофлуориметре Varian Cary Eclipse (“Agilent Technologies”, США).
Фракционирование низкомолекулярных компонентов и предварительную оценку молекулярной массы изучаемого стимулятора свечения проводили с помощью гель-фильтрационной хроматографии концентрата на колонке (0.8 × 20 см) с Bio-Gel P2 (“Bio-Rad”, США), уравновешенной ДИ водой. На колонку наносили 0.5 мл концентрата. Хроматографию проводили при скорости протока 0.2 мл/мин, используя в качестве элюента ДИ воду и собирая пробы объемом 1 мл. Наличие и распределение стимулятора в хроматографических пробах определяли по интенсивности их флуоресценции, регистрируемой при длине волны 440 нм (Varian Cary Eclipse) после возбуждения длиной волны 360 нм. Для оценки молекулярной массы стимулирующего компонента, при указанных выше условиях (размер колонки, объем наносимого образца, элюент и скорость протока) проводили хроматографию маркерных соединений, растворы которых готовили в ДИ воде. В качестве маркеров использовали рибофлавин и ФМН (“Sigma”, США), и НАД (“Serva”, Германия) с молекулярными массами 0.38, 0.46 и 0.66 кДа соответственно.
Эффект стимулятора на свечение гриба N. nambi оценивали с использованием пеллет мицелия, выращенных, как изложено выше, и проинкубированных в ДИ воде в течение 12 ч для более полного удаления остатков питательной среды и метаболитов. Интенсивность и динамику люминесценции регистрировали с помощью люминометра Glomax® 20/20 (“Promega BioSystems Sunnyvale, Inc.”, США) в режиме одно измерение в секунду. Индивидуальные пеллеты мицелия помещали в прозрачные пластиковые пробирки объемом 1.5 мл (“Eppendorf”, Германия), содержащие 500 мкл ДИ воды. Пробирки устанавливали в измерительную камеру люминометра и регистрировали начальный уровень свечения пеллет. После этого в пробы аккуратно (без перемешивания) вносили 5 мкл тестируемого образца стимулятора и вновь регистрировали интенсивность и динамику светового сигнала пеллет. Уровень люминесценции выражали в относительных единицах.
При исследовании термостабильности изучаемого стимулятора образцы концентрата низкомолекулярных соединений (объем 200 мкл) помещали в пластиковые пробирки и инкубировали при 100°С (термостат TB-85 Thermo Batch, “Shimadzu”, Япония) в течение 1–5 мин. После этого пробы охлаждали в ледяной бане и затем оценивали эффект термообработанного стимулятора на свечение мицелия N. nambi, как изложено выше.
Для проверки применимости обнаруженного стимулятора в качестве субстрата светоизлучающей системы базидиомицета N. nambi использовали люминесцентную систему, выделенную из мицелия гриба изложенным нами ранее методом [2]. Проверку функциональной активности полученной системы проводили следующим образом. Аликвоты препарата выделенной системы объ-емом 200 мкл вносили в пластиковые пробирки, которые помещали в люминометр (Glomax® 20/20) и добавкой 5 мкл раствора 10 мМ НАДФН и 5 мкл раствора 33 мкМ гиспидина инициировали люминесцентную реакцию, регистрируя интенсивность и динамику световой эмиссии. Доказано, что гиспидин является предшественником субстрата реакции светоизлучения высших грибов, который преобразуется НАД(Ф)Н-зависимой гидроксилазой в 3-гидроксигиспидин (люциферин) и затем окисляется люциферазой с излучением квантов видимого света [3–8], что согласуется с высказанной ранее гипотезой о двухстадийном процессе свечения базидиомицетов [9, 10]. В работе использовали НАДФН (“Serva”, Германия) и гиспидин (“Sigma-Aldrich”, США). Исходный раствор гиспидина с концентрацией 20 мМ готовили в метаноле (“Sigma-Aldrich”) и хранили при температуре –20°C. Для экспериментов водный раствор гиспидина с концентрацией 33 мкМ готовили in situ последовательными разведениями исходного раствора ДИ водой. Оценку применимости стимулятора в качестве субстрата (или его предшественника) светоизлучающей реакции проводили с помощью выделенной люминесцентной системы при указанных выше экспериментальных условиях. В этом случае вместо раствора гиспидина в реакционную смесь добавляли 5 мкл водного образца стимулятора.
В исследованиях мы установили, что обнаруженный нами стимулятор свечения базидиомицета N. nambi является низкомолекулярным соединением. При добавлении аликвот концентрата низкомолекулярных компонентов к пеллетам светящегося мицелия мы наблюдали быстрый (несколько секунд) подъем уровня их световой эмиссии, который мог превышать начальный уровень от нескольких раз до 1.5 порядков и более (рис. 1). Из представленных данных видно, что после выхода светового сигнала на максимум наблюдается его снижение в течение нескольких минут. Повторные добавки концентрата вновь стимулировали подъем свечения с амплитудой светового сигнала, соизмеримого или превышающего первый сигнал (рис. 1). Стимуляцию свечения мицелия N. nambi мы наблюдали при последовательных многократных (4–6 раз) добавках концентрата низкомолекулярных компонентов к одним и тем же образцам пеллет. В то же время добавки к светящимся пеллетам 5 мкл концентрата высокомолекулярных соединений (надмембранная фракция после ультрафильтрации экстракта) не вызывали сколько-нибудь заметных изменений в уровнях их световой эмиссии. Важно отметить, что использованные нами концентраты высоко- и низкомолекулярных компонентов экстракта из пеллет мицелия N. nambi не обладали регистрируемым свечением. При тестировании обоих препаратов уровни их люминесценции не отличались от фонового сигнала измерительного прибора (люминометр Glomax® 20/20).
Рис. 1.
Эффект возрастания интенсивности свечения пеллет мицелия N. nambi от нескольких раз (а) до 1.5 порядков (б) при последовательных добавках концентрата низкомолекулярных компонентов. Стрелками показаны моменты добавления концентрата (по 5 мкл) в пробу.

В работе мы установили, что обнаруженный нами стимулятор свечения гриба N. nambi является термостабильным соединением и сохраняет стимулирующий эффект после термообработки концентрата низкомолекулярных компонентов при 100°C в течение 5 мин.
В спектре поглощения концентрата, содержащего стимулятор свечения, мы выявили наличие двух основных пиков в коротковолновой области при 205 и 260 нм и плеча в районе 350–370 нм (рис. 2). В экспериментах было установлено, что возбуждение водных образцов концентрата длинами волн 350–370 нм сопровождается их флуоресценцией с максимумом световой эмиссии при 440 нм (рис. 2). При этом важно отметить, что мы не выявили изменений в спектре флуоресценции и величине максимума световой эмиссии после термообработки содержащего стимулятор свечения концентра в течение 5 мин при 100°C. Это позволило высказать версию, что обнаруженный нами термоустойчивый стимулятор свечения гриба N. nambi является флуоресцентным соединением.
Рис. 2.
Спектр поглощения (а) и спектры возбуждения и флуоресценции (б) концентрата низкомолекулярных соединений, содержащего стимулятор свечения гриба N. nambi. На вставке приведен фрагмент спектра поглощения в диапазоне 300–420 нм. В спектрах возбуждения и флуоресценции значения нормированы на максимальные уровни световой эмиссии.

Экспериментальную проверку высказанного выше предположения осуществляли следующим образом. Вначале мы провели разделение низкомолекулярных компонентов концентрата с помощью гель-фильтрационной хроматографии на колонке с Bio-Gel P2 с последующей оценкой уровня флуоресценции в полученных хроматографических пробах. При скрининге хроматографических фракций мы выявили наличие только одного пика флуоресценции (рис. 3). Исходя из этого, на следующей стадии мы объединили фракции, находящиеся на подъеме, в максимуме и на спаде флуоресцентного пика в три отдельных образца – 1, 2 и 3 соответственно, которые были затем сконцентрированы на роторном концентраторе (Concentrator 5301, “Eppendorf”, Германия) до одинаковых объемов. Сравнительную оценку эффекта полученных концентратов на свечение пеллет мицелия N. nambi проводили, как изложено выше, добавляя в тестируемые пробы одинаковые объемы (5 мкл) концентратов.
Рис. 3.
Гель-фильтрационная хроматография концентрата низкомолекулярных компонентов из мицелия N. nambi на колонке с Bio-Gel P2: 1 – профиль элюции, 2 – уровень флуоресценции хроматографических фракций.
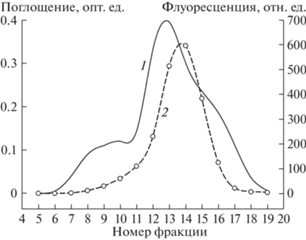
В сравнительных экспериментах мы установили, что сконцентрированный образец 2 обладал гораздо большим стимулирующим свечение мицелия N. nambi эффектом, по сравнению с образцами 1 и 3 (рис. 4). Это следует из анализа максимального уровня свечения пеллет, стимулированного добавлением образцов, и площади под кривыми регистрируемых люминесцентных сигналов, отражающей суммарный квантовый выход реакции (рис. 4).
Рис. 4.
Стимуляция свечения пеллет мицелия N. nambi образцами объединенных и сконцентрированных хроматографических фракций, находящихся на подъеме (1), в максимуме (2) и на спаде (3) флуоресцентного пика (см. рис. 3). Стрелками показаны моменты добавления образцов (по 5 мкл) к пеллетам.

Из расчетов площадей под кривыми люминесцентных сигналов при стимуляции свечения пеллет N. nambi образцами 1, 2 и 3 соотношение квантовых выходов составило 2 : 11 : 0.5 соответственно. Совокупность этих данных позволяет с достаточной уверенностью полагать, что обнаруженный нами стимулятор свечения является флуоресцентным соединением.
По предварительным данным гель-фильтрационной хроматографии на колонке с Bio-Gel P2 кажущаяся молекулярная масса стимулятора, рассчитанная нами из максимума пика флуоресценции (рис. 3), по данным нескольких экспериментов находится в диапазоне 0.4–0.6 кДа.
В исследованиях мы установили, что компонент, стимулирующий свечение пеллет мицелия N. nambi, не является субстратом (или его предшественником) люминесцентной системы, выделенной из данного гриба. По крайней мере после добавки 5 мкл содержащих стимулятор концентрата низкомолекулярных соединений и сконцентрированного после его хроматографии образца 2 к активированной НАДФН люминесцентной системе мы не наблюдали изменений в уровне ее световой эмиссии.
Таким образом, в экстрактах из мицелия светящегося гриба Neonothopanus nambi после обработки β-глюкозидазой обнаружен стимулятор грибного свечения. Установлено, что стимулятор свечения является низкомолекулярным, термостабильным соединением и при добавках к пеллетам светящегося мицелия увеличивает уровень их световой эмиссии от нескольких раз до 1.5 порядков и более. Результаты экспериментов свидетельствуют в пользу того, что обнаруженный компонент является флуоресцентным соединением и при возбуждении длинами волн 350–370 нм обладает синей флуоресценцией с максимумом световой эмиссии 440 нм. Установлено, что стимулятор свечения не является субстратом (или предшественником субстрата) люминесцентной системы гриба N. nambi. Механизм стимуляции свечения обнаруженным компонентом пока непонятен и требует дальнейшего изучения. Приоритетной ближайшей задачей дальнейших исследований будет являться выделение обнаруженного компонента в чистом виде для установления его структуры и механизма стимулирующего свечение эффекта.
Список литературы
Mogilnaya O.A., Ronzhin N.O., Bondar V.S. Estimating Levels of Light Emission and Extracellular Peroxidase Activity of Mycelium of Luminous Fungus Neonothopanus nambi Treated with β-glucosidase // Curr. Res. Environ. Appl. Mycol. 2018. V. 8. P. 75–85.
Бондарь В.С., Пузырь А.П., Пуртов К.В., и др. Выделение люминесцентной системы из светящегося гриба Neonothopanus nambi // ДАН. 2014. Т. 455. № 3. С. 346–348.
Purtov K.V., Petushkov V.N., Baranov M.S., et al. The Chemical Basis of Fungal Bioluminescence // Angew. Chem. Int. Ed. 2015. V. 54. P. 8124–8128.
Kaskova Z.M., Dörr F.A., Petushkov V.N., et al. Mechanism and Color Modulation of Fungal Bioluminescence // Sci. Adv. 2017. V. 3. P. e1602847.
Oba Y., Suzuki Y., Martins G.N.R., et al. Identification of Hispidin as a Bioluminescent Active Compound and Its Recycling Biosynthesis in the Luminous Fungal Fruiting Body // Photochem. Photobiol. Sci. 2017. V. 16. P. 1435–1440.
Teranishi K. Bioluminescence and Chemiluminescence Abilities of Trans-3-Hydroxyhispidin on the Luminous Fungus Mycena chlorophos // Luminescence. 2018. V. 33. P. 1235–1242.
Kotlobay A.A., Sarkisyan K.S., Mokrushina Y.A., et al. A genetically encodable bioluminescent system from fungi // PNAS. 2018. V. 115. P. 12728–12732.
Garcia-Iriepa C., Losantos R., Fernandez-Martinez D., et al. Fungal Light Emitter: Understanding Its Chemical Nature and pH-Dependent Emission in Water Solution // J. Org. Chem. 2020. V. 85. P. 5503–5510.
Airth R.L., McElroy W.D. Light Emission from Extracts of Luminous Fungi // J. Bacteriol. 1959. V. 77. P. 249–250.
Airth R.L., Foerster G.E. The Isolation of Catalytic Components Required for Cell-free Fungal Bioluminescence // Arch. Biochem. Biophys. 1962. V. 97. P. 567–573.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


