Доклады Российской академии наук. Науки о жизни, 2022, T. 504, № 1, стр. 229-234
ПОЛИМЕТАЛЛИЧЕСКИЙ СТРЕСС ИЗМЕНЯЕТ ЭНДОГЕННЫЙ СТАТУС БРАССИНОСТЕРОИДОВ И СНИЖАЕТ ЭФФЕКТИВНОСТЬ ФОТОХИМИЧЕСКИХ РЕАКЦИЙ ФОТОСИСТЕМЫ II У РАСТЕНИЙ ЯЧМЕНЯ
Е. Д. Данилова 1, *, Р. П. Литвиновская 2, И. Е. Злобин 3, Л. В. Коломейчук 1, О. К. Мурган 1, А. Л. Савчук 2, В. А. Хрипач 2, член-корреспондент РАН В. В. Кузнецов 1, 3, М. В. Ефимова 1
1 Национальный исследовательский Томский государственный университет
Томск, Россия
2 Институт биоорганической химии НАН Беларуси
Минск, Беларусь
3 Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: nusy.l.d@gmail.com
Поступила в редакцию 20.02.2022
После доработки 04.03.2022
Принята к публикации 04.03.2022
- EDN: ITPWXX
- DOI: 10.31857/S2686738922030039
Аннотация
Исследовали влияние полиметаллического стресса (Mn2+, Cd2+, Cu2+, Ni2+, Zn2+, Pb2+, а также Al3+) различной продолжительности и интенсивности на эндогенное содержание брассиностероидов (БС) и фотохимическую активность фотосистемы II у растений ячменя. Содержание стероидных гормонов определяли методом двухстадийного иммуноферментного анализа. Впервые установили, что растения ячменя реагировали на полиметаллический стресс изменением эндогенного содержания различных групп фитостероидов (24S-метилБС, 24-эпиБС, 28-гомоБС, В-лактонБС и 6-кетоБС). Показано, что стресс-зависимая динамика изменения эндогенного содержания различных групп БС характеризуется органоспецифичностью и определяется возрастным состоянием растений, интенсивностью действующего стрессора и спецификой брассиностероидов. Наблюдаемые изменения эндогенного статуса БС в растениях ячменя при полиметаллическом стрессе сопровождаются ингибированием ростовых процессов, снижением содержания основных фотосинтетических пигментов и некоторым понижением эффективности фотохимических процессов в ФС II (Fv/Fm, ETR, qN и NPQ). Принимая во внимание полифункциональный стресс-защитный эффект брассиностероидов, высказывается предположение, что изменение эндогенного статуса БС на фоне полиметаллического загрязнения носит адаптивный характер и позволяет минимизировать повреждающее воздействие токсичных тяжелых металлов и алюминия.
Глобальное загрязнение пахотных земель тяжелыми металлами представляет собой одну из самых актуальных проблем устойчивого развития мирового сельского хозяйства [1, 2]. Избыточные концентрации тяжелых металлов в среде негативно влияют на рост и развитие растений, нарушая физиологические и биохимические функции, что приводит к снижению продуктивности и пищевой ценности растительного сырья [3]. Некоторые тяжелые металлы, такие как ртуть, свинец, кадмий и хром, являются высокотоксичными элементами и могут представлять серьезную опасность для всей экосистемы.
Значительное число исследований демонстрирует реакции растений, в том числе злаковых, на избыточные концентрации тяжелых металлов. Однако, как правило, данные работы ограничиваются изучением влияния одного или нескольких ионов, когда как в естественной среде растения сталкиваются с повышением содержания в почве одновременно целого ряда тяжелых металлов [1, 4]. Это делает актуальным изучение ответа растения непосредственно на полиметаллический стресс.
Важную роль в процессе адаптации растений к неблагоприятным условиям среды играют фитогормоны, такие как абсцизовая кислота, гиббереллины, ауксины, цитокинины, этилен и брассиностероиды (БС) [5, 6]. Вызываемые стрессом изменения эндогенного баланса фитогормонов и их сигналинга способствуют адаптации растений к изменяющимся условиям обитания. Так, например, трансгенные растения арабидопсис со сниженным эндогенным уровнем БС характеризуются гиперчувствительностью к действию абиотических стрессоров [7]. Напротив, увеличенное содержание эндогенных БС приводит к повышению устойчивости растений кукурузы к засухе [8]. Кроме того, установлено, что в ответ на повышенную концентрацию ионов никеля [9] и кадмия [10] в растениях горчицы и риса наблюдается увеличение эндогенного содержания групп брассиностероидов, таких как 6-кетоны БС и 24-эпиБС. В свою очередь, экзогенные БС способствуют снижению негативного эффекта тяжелых металлов на растения [11]. Однако до сих пор остается открытым вопрос о том, каким образом изменяется эндогенное содержание БС при адаптации растений к полиметаллическому стрессу разной интенсивности и продолжительности действия.
Цель нашей работы заключалась в исследовании ответных физиологических реакций растений ячменя и, прежде всего, изменения эндогенного содержания брассиностероидов, на совместное действие полиметаллического стресса (Mn2+, Cd2+, Cu2+, Ni2+, Zn2+, Pb2+, а также Al3+) различной интенсивности и продолжительности.
Исследования проводили на растениях ячменя (Hordеum vulgаre L.) сорта Биом. Растения выращивали в грунте с добавлением перлита в течение пяти суток при температуре 20 ± 2°С, плотности потока квантов ФАР 200–250 мкмоль м2 с–1 и относительной влажности 40–60% в фитотроне с 16-часовым фотопериодом. Далее в течение пяти суток растения адаптировали к условиям жидкой питательной среды по Blamey (pH 4.5) [12] с низким содержанием фосфора. Данная питательная среда наиболее полно соответствует реальному почвенному составу подверженных закислению загрязненных территорий, где доступность металлов для растений повышена из-за низких значений рН [4]. После этого часть растений переносили на ту же питательную среду по Blamey (контроль) или на среду с тяжелыми металлами и алюминием в разных концентрациях (“низкой” и “высокой”) (табл. 1). Действующие концентрации используемых тяжелых металлов (Mn2+, Cd2+, Cu2+, Ni2+, Zn2+ и Pb2+) и алюминия (Al3+) подобраны на основании типичных значений концентраций данных ионов в почвенном растворе промышленно загрязненных кислых почв [13, 14] и по результатам ранее проведенных нами экспериментов [4].
Таблица 1.
Концентрации используемых тяжелых металлов и алюминия
| Наименование металла | Концентрация, мкМ | |
|---|---|---|
| “Низкая” | “Высокая” | |
| Al3+ | 10 | 20 |
| Mn2+ | 25 | 50 |
| Cd2+ | 1.4 | 2.8 |
| Cu2+ | 1 | 2 |
| Ni2+ | 8 | 16 |
| Zn2+ | 20 | 40 |
| Pb2+ | 15 | 30 |
Через пять (15-суточные растения) и десять (20-суточные растения) суток воздействия полиметаллического стресса оценивали ростовые параметры (длину осевых органов, суммарную площадь листовой поверхности (расчет осуществляли по формуле Аникеева и Кутузова [15]), сырую и сухую биомассы), содержание хлорофилла а, хлорофилла b и каротиноидов [16] и фотохимическую активность фотосинтетического аппарата растений на PAM-флуориметре (Mini-PAM II, “Heinz-Walz”, Germany). Образцы ячменя (побеги и корни) фиксировали в жидком азоте и лиофильно высушивали. Лиофилизацию растительных образцов проводили под вакуумом с помощью сублимационной камеры VirTis 6211 (“LabX”, США). Содержание стероидных гормонов группы брассинолида (24S-метил-БС), группы 24-эпибрассинолида (24-эпи-БС), группы 28-гомобрассинолида (28-гомо-БС), В-лактонов (B-лактонБС) и B-кетонов (6-кетоБС) проводили методом двухстадийного иммуноферментного анализа, как описано ранее [17, 18].
Эксперимент проводили в трех биологических повторностях; использовали не менее 70 растений на каждый вариант опыта. Полученные результаты представлены в таблицах и на рисунках в виде средней арифметической со стандартной ошибкой. Для сравнения независимых выборок, подчиняющихся закону нормального распределения, использовали параметрический критерий Стьюдента. Значения t-критерия находили для 95% уровня значимости (р <0.05).
При воздействии полиметаллического стресса отмечено снижение ростовых параметров – длины осевых органов, массы растений и суммарной площади ассимилирующей поверхности. Наибольшую чувствительность проявляли корни. Снижение длины корня в условиях полиметаллического стресса составляло 40% относительно контроля, тогда как снижение длины стебля на двадцатые сутки эксперимента не превышало 15% относительно контроля вне зависимости от действующей концентрации металлов (табл. 2). Наиболее выраженный негативный эффект полиметаллического загрязнения на рост корня объясним тем фактом, что именно корневая система первой подвергается воздействию веществ, находящихся в почве или жидкой среде.
Таблица 2.
Влияние полиметаллического стресса (ПМ) на ростовые параметры растений ячменя
| Возраст, сут | Варианты | Длина стебля, см |
Длина корня, см |
Суммарная пло-щадь листьев, см2 | Сырая масса всего растения, г |
|---|---|---|---|---|---|
| 15 | Контроль | 8.90 ± 0.28 | 16.53 ± 0.35 | 11.11 ± 0.21 | 0.63 ± 0.02 |
| Низкая концентрация ПМ (5 сут) | 8.78 ± 0.22 | 9.56 ± 0.23* | 8.97 ± 0.20* | 0.59 ± 0.01 | |
| Высокая концентрация ПМ (5 сут) | 8.38 ± 0.16* | 10.00 ± 0.20* | 8.13 ± 0.25* | 0.52 ± 0.02* | |
| 20 | Контроль | 11.13 ± 0.27 | 20.69 ± 0.30 | 17.43 ± 0.29 | 0.89 ± 0.02 |
| Низкая концентрация ПМ (10 сут) | 9.09 ± 0.20* | 12.47 ± 0.23* | 12.69 ± 0.22* | 0.64 ± 0.02* | |
| Высокая концентрация ПМ (10 сут) | 9.56 ± 0.18* | 11.89 ± 0.28* | 12.80 ± 0.18* | 0.64 ± 0.02* |
Через пять суток действия тяжелых металлов наблюдалась концентрационная зависимость ингибирования площади листовой поверхности и массы растений в зависимости от интенсивности полиметаллического стресса.
Помимо ростовых процессов, ключевой мишенью повреждающего действия тяжелых металлов у растений является фотосистема II (ФС II). Одним из основных критериев эффективности протекания фотохимических процессов в ФС II является максимальная квантовая эффективность (Fv/Fm). Полученные данные свидетельствуют о том, что Fv/Fm листьев растений снижалась на 3–8% относительно контроля (рис. 1), в зависимости от концентрации металлов и продолжительности их воздействия. Кроме того, в условиях стресса наблюдались достоверное уменьшение скорости транспорта электронов (ETR) и некоторое снижение коэффициентов нефотохимической нерегулируемой (qN) и регулируемой (NPQ) диссипации энергии на 3–7 и 4–26% соответственно, относительно контроля (рис. 1).
Рис. 1.
Влияние полиметаллического стресса (ПМ) на состояние фотосинтетического аппарата листьев ячменя. а – возраст 15 сут, действие полиметаллов 5 сут; б – возраст 20 сут, действие полиметаллов 10 сут. *p < 0.05 при сравнении с контрольным значением.

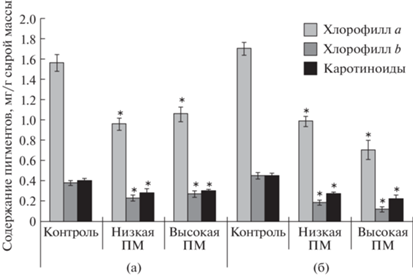
Из полученных данных следует, что избыточное содержание тяжелых металлов и алюминия в питательном растворе в течение пяти суток вызывало снижение уровня хлорофиллов и каротиноидов (на 24–39%) по сравнению с их содержанием в растениях контрольного варианта (рис. 2). Отмечено, что количество пигментов в контрольной группе растений возрастало в ходе эксперимента. Различия между содержанием хлорофиллов и каротиноидов в контрольных условиях и при стрессе на двадцатые сутки эксперимента составляли 40–70% (рис. 2). Наиболее подвержен действию металлов был хлорофилл b.
Рис. 2.
Влияние полиметаллического стресса (ПМ) на содержание фотосинтетических пигментов в листьях ячменя. а – возраст 15 сут, действие полиметаллов 5 сут; б – возраст 20 сут, действие полиметаллов 10 сут. *p < 0.05 при сравнении с контрольным значением.
В табл. 3 и 4 представлены результаты экспериментов по влиянию полиметаллического стресса разной интенсивности и продолжительности на эндогенное содержание разных групп БС (группы брассинолида – 24S-метилБС; 24-эпибрассинолида – 24-эпиБС; 28-гомобрассинолида – 28-гомоБС; В-лактонов – В-лактонБС и 6-кетонов – 6-кетоБС) в побегах (листьях и стеблях) и корнях растений ячменя. Полученные данные свидетельствуют, прежде всего, о том, что уровень всех анализируемых групп стероидных фитогормонов, за исключением 28-гомоБС, в побегах растений превышал их содержание в корнях (табл. 3). Кроме того, эндогенное содержание БС различных групп в побегах не зависело от возрастного состояния растений, тогда как в корнях уровень БС в значительной степени определялся возрастом. Самое высокое содержание фитогормонов отмечено у растений в возрасте пятнадцати суток, тогда как на двадцатые сутки (с момента помещения их в перлит) уровень брассиностероидов в пересчете на единицу массы снижался, за исключением групп 28-гомоБС и 6-кетонов (табл. 3, 4).
Таблица 3.
Влияние полиметаллического стресса (ПМ) на количественное содержание брассиностероидов (нг/г лиоф. веса) в растениях ячменя
| Возраст, сут | Варианты | 24S-метилБС | 24-эпиБС | 28-гомоБС | |||
|---|---|---|---|---|---|---|---|
| Побег | Корень | Побег | Корень | Побег | Корень | ||
| 15 | Контроль (5 сут) | 4.65 ± 0.92 | 0.48 ± 0.03 | 8.41 ± 0.76 | 7.36 ± 0.60 | 1.06 ± 0.09 | 0.92 ± 0.10 |
| Низкая концентрация ПМ (5 сут) | 2.72 ± 0.40* | 0.29 ± 0.02* | 7.44 ± 1.12 | 3.65 ± 0.78* | 0.75 ± 0.07* | 1.63 ± 0.13* | |
| Высокая концентрация ПМ (5 сут) | 3.98 ± 0.69 | 0.25 ± 0.02* | 5.79 ± 0.58* | 4.71 ± 0.13* | 0.44 ± 0.06* | 1.42 ± 0.13* | |
| 20 | Контроль (10 сут) | 5.05 ± 0.63 | <0.1 | 8.77 ± 0.79 | 3.39 ± 0.18 | 0.99 ± 0.17 | 0.92 ± 0.10 |
| Низкая концентрация ПМ (10 сут) | 7.10 ± 1.09 | 0.15 ± 0.01 | 5.24 ± 0.53* | 4.66 ± 0.16* | 0.71 ± 0.04 | 1.61 ± 0.19* | |
| Высокая концентрация ПМ (10 сут) | 6.93 ± 1.33 | 0.14 ± 0.01 | 2.13 ± 0.25* | 3.74 ± 0.37 | 0.47 ± 0.02* | 1.31 ± 0.20* | |
Таблица 4.
Влияние полиметаллического стресса (ПМ) на количественное содержание брассиностероидных В-лактонов и 6-кетонов (нг/г лиоф. веса) в растениях ячменя
| Возраст, сут | Варианты | В-лактоны БС | 6-кетоны БС | ||
|---|---|---|---|---|---|
| Побег | Корень | Побег | Корень | ||
| 15 | Контроль (5 сут) | 5.20 ± 0.80 | 3.07 ± 0.29 | 7.10 ± 0.61 | 2.43 ± 0.48 |
| Низкая концентрация ПМ (5 сут) | 6.80 ± 1.02 | 1.91 ± 0.19 | 7.97 ± 0.56 | 2.38 ± 0.41 | |
| Высокая концентрация ПМ (5 сут) | 8.07 ± 1.39* | 3.03 ± 0.19 | 7.86 ± 0.72 | 2.86 ± 0.24 | |
| 20 | Контроль (10 сут) | 4.97 ± 0.71 | 1.86 ± 0.19 | 10.80 ± 1.75 | 1.91 ± 0.21 |
| Низкая концентрация ПМ (10 сут) | 4.58 ± 0.80 | 4.28 ± 0.20* | 11.38 ± 1.54 | 3.20 ± 0.31 | |
| Высокая концентрация ПМ (10 сут) | 4.68 ± 0.46 | 3.89 ± 0.30* | 13.50 ± 2.40 | 2.35 ± 0.53 | |
Интересно, что содержание 24-эпиБС и 28-гомоБС в побегах растений ячменя снижалось в ответ на действие низкой и высокой интенсивностей ПМ загрязнения, при этом достоверная реакция отмечена при высокой концентрации стрессора (табл. 3). В то время как корни растений отвечали снижением уровня гормонов групп 24S-метилБС и 24-эпиБС, а также увеличением 28-гомоБС через пять суток воздействия ПМ вне зависимости от их концентрации. Увеличение всех групп анализируемых гормонов стероидной природы отмечено в корнях растений ячменя при ПМ воздействии низкой интенсивности в течение 10 сут. При этом двухкратное увеличение концентрации ПМ практически не изменяло содержание анализируемых групп БС (табл. 3, 4). Увеличение содержания эндогенных брассиностероидов при действии тяжелых металлов, вероятно, связан с процессами адаптации растений к стрессу. Однако ответная реакция растений на воздействие тяжелыми металлами не всегда однозначна и видоспецифична. Так, экзогенное влияние кадмия, свинца или меди не приводило к изменениям эндогенного содержания брассинолида у растений хлореллы [19].
Таким образом, полученные экспериментальные данные впервые позволили продемонстрировать, что растения ячменя отвечали на ПМ стресс разнонаправленным изменением эндогенного содержания анализируемых групп брассиностероидов (24S-метилБС, 24-эпиБС, 28-гомоБС, В-лактонБС и 6-кетоБС). Несмотря на столь сложную реакцию растений на совместное действие тяжелых металлов, стресс-зависимая динамика изменения эндогенного содержания различных групп БС определяется возрастным состоянием растений, интенсивностью действующего стрессора и спецификой брассиностероидов. Подобные изменения эндогенного статуса БС в растениях ячменя при ПМ стрессе сопровождаются органоспецифическим ингибированием ростовых процессов, снижением содержания основных фотосинтетических пигментов и некоторым падением эффективности фотохимических процессов в ФС II (Fv/Fm, ETR, qN и NPQ). Принимая во внимание полифункциональный стресс-защитный эффект брассиностероидов, нельзя исключать, что наблюдаемая нами динамика изменения эндогенного статуса фитостероидов в растениях ячменя на фоне полиметаллического загрязнения носит адаптивный характер и позволяет минимизировать повреждающее воздействие целого ряда токсичных тяжелых металлов и алюминия.
Список литературы
Srivastava V., Sarkar A., Singh S., et al. // Frontiers in Environmental Science. 2017. V. 5. P. 64.
Hou D., O’Connor D., Igalavithana A.D. et al. // Nature Reviews Earth & Environment. 2020. V. 1. P. 366–381.
Kisa D. // Journal of Natural and Applied Sciences. 2018. V. 22. P. 1–6.
Danilova E.D., Zlobin I.E., Kuznetsov V.V., et al. // Doklady Biochemistry and Biophysics. 2021. V. 499. P. 348–353.
Kolomeichuk L.V., Danilova E.D., Khripach V.A., et al. // Russian Journal of Plant Physiology. 2021. V. 68. № 3. P. 297–307.
Hossain A., Venugopalan V.K., Rahman M. A., et al. // Emerging Plant Growth Regulators in Agriculture. 2022. P. 99–130.
Zeng H., Tang Q., Hua X. // Journal Plant Growth Regulation. 2010. V. 29. № 1. P. 44–52.
Tumova L., Tarkowska D., Rehorova K., et al. // PLoS One. 2018. V. 13. № 5. e0197870.
Kanwar M.K., Bhardwaj R., Chowdhary S.P. et al. // Terrestrial and Aquatic Environmental Toxicology. 2012. V. 6. № 2. P. 84–89.
Yu L., Ding J., Wang Y., et al. // Analytical Chemistry. 2016. V. 88. P. 1286–1293.
Боднарь И.С., Чебан Е.В. // Принципы экологии. 2020. № 1. С. 27–42.
Blamey F.P.C., Hernandez-Soriano M.C., Cheng M., et al. // Plant Physiology. 2015. V. 169. № 3. P. 2006–2020.
Kopittke P.M., Blamey F.P.C., Asher C. J., et al. // Journal of Experimental Botany. 2010. V. 61. P. 945–954.
Li Z., Wang P., Menzies N. W., et al. // Ecotoxicology and Environmental Safety. 2018. V. 147. P. 872–880.
Аникеев В.В., Кутузов Ф.Ф. // Физиология растений. 1961. Т. 8. С. 375–377.
Lichtenthaler H.K. // Methods Enzymology. 1987. V. 148. P. 350–382.
Ефимова М.В., Литвиновская Р.П., Медведева Ю.В. и др. // Доклады Академии наук. 2019. Т. 485 (№ 1). С. 117–121.
Pradko A.G., Litvinovskaya R.P., Sauchuk A. L., et al. // Steroids. 2015. V. 97. P. 78–86.
Bajguz A. // Archives of Environmental Contamination and Toxicology. 2011. V. 60. P. 406–416.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


