Доклады Российской академии наук. Науки о жизни, 2022, T. 505, № 1, стр. 253-257
ЭКСПРЕССИЯ CASC8 РНК В КЛЕТОЧНЫХ КУЛЬТУРАХ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА
О. Ю. Буренина 1, *, Н. Л. Лазаревич 2, 3, И. Ф. Кустова 2, Т. С. Зацепин 4, М. П. Рубцова 4, академик РАН О. А. Донцова 1, 4
1 Центр молекулярной и клеточной биологии, Сколковский институт науки и технологий
Москва, Россия
2 НИИ канцерогенеза ФГБУ “Национальный медицинский исследовательский центр онкологии
имени Н.Н. Блохина” Министерства здравоохранения
Москва, Россия
3 Биологический факультет Московского государственного университета имени М.В. Ломоносова
Москва, Россия
4 Химический факультет и Научно-исследовательский институт физико-химической биологии
имени А.Н. Белозерского Московского государственного университета имени М.В. Ломоносова
Москва, Россия
* E-mail: alunit@inbox.ru
Поступила в редакцию 13.04.2022
После доработки 04.05.2022
Принята к публикации 04.05.2022
- EDN: PFSNFO
- DOI: 10.31857/S2686738922040035
Аннотация
Многие длинные некодирующие РНК (днРНК) экспрессируются в клетках человека в виде набора транскриптов, имеющих разную длину и состав экзонов. В случае ассоциированных с раком днРНК актуальной задачей является определение их конкретных изоформ, поскольку каждый транскрипт может выполнять собственную функцию при канцерогенезе и иметь уникальный профиль экспрессии в различных типах опухолей. Мы впервые проанализировали экспрессию днРНК CASC8 в клеточных линиях протоковой аденокарциномы поджелудочной железы человека и обнаружили, что в данном типе рака преобладает изоформа, ранее считавшаяся минорной. Мы также выявили крайне высокий уровень экспрессии всех транскриптов CASC8 в клетках MIA PaCa-2, и, наоборот, отсутствие этой днРНК в линии PANC-1, что позволит использовать их как удобные модели для дальнейших исследований in vitro.
Рак поджелудочной железы (преимущественно протоковая аденокарцинома, PDAC, от англ. “pancreatic duct adenocarcinoma”) является наиболее летальным среди злокачественных новообразований. Практически бессимптомное развитие и позднее выявление опухоли обусловливают крайне низкую выживаемость пациентов, которая в среднем в течение 5 лет не превышает 7%, а частота рецидивов после хирургического лечения или химиотерапии крайне высока [1]. На сегодняшний день для диагностики и прогнозирования развития PDAC в клинической практике используется только онкомаркер CA 19-9, определяемый в сыворотке крови. Однако область его применения крайне ограничена ввиду низкой чувствительности и специфичности, поскольку его повышение наблюдается и при других опухолях пищеварительной системы, а также при неопухолевых патологиях [2]. Перспективным направлением считается использование в качестве онкомаркеров длинных некодирующих РНК (днРНК), которые могут быть напрямую измерены в биологических жидкостях, биоптате или постоперационных тканях с помощью ПЦР с обратной транскрипцией с детекцией в режиме реального времени (ОТ-ПЦР) [3]. На сегодняшний день известно несколько десятков днРНК, уровень экспрессии которых меняется при PDAC [4, 5], однако большинство из них – “универсальные” онкогенные днРНК, такие как MALAT1, ANRIL, H19, UCA1 и др. Более тканеспецифичные для поджелудочной железы или, в целом, для органов пищеварительной системы днРНК, как правило, имеют низкие уровни экспрессии, что лимитирует возможность их использования в клинической практике, а также затрудняет научные исследования с целью выяснения их свойств и функций. Таким образом, актуальной задачей является идентификация новых днРНК, экспрессия которых активируется в PDAC по сравнению со здоровыми тканями поджелудочной железы.
В ходе предварительного анализа доступных биоинформатических данных TCGA (The Cancer Genome Atlas) мы обнаружили малоизученную днРНК CASC8 (от англ. “Cancer Susceptibility Candidate 8”), существенная активация экспрессии которой наблюдается при раке органов желудочно-кишечного тракта и легких (рис. 1а), а ее максимальная экспрессия замечена в случае PDAC при практически полном отсутствии этой днРНК в нормальных тканях поджелудочной железы. Данные различия являются статистически значимыми, позволяя предсказать диагностический потенциал CASC8 (рис. 1а). Высокая смертность пациентов с повышенным уровнем экспрессии CASC8 (рис. 1б) указывает на ее возможную проонкогенную роль и позволяет рассматривать эту днРНК и в качестве потенциального прогностического биомаркера.
Рис. 1.
Экспрессия CASC8 при различных онкологических заболеваниях по данным онлайн сервера GEPIA (Gene Expression Profiling Interactive Analysis, www.gepia.cancer-pku.cn) (а) Топ-5 опухолей с максимальной экспрессией CASC8 по сравнению со неопухолевыми тканями. Усредненные данные TCGA по количеству образцов: T – опухоль, N – норма. PDAC – протоковая аденокарцинома поджелудочной железы, COAD – аденокарцинома толстой кишки, LUSC – плоскоклеточный рак легкого, READ – аденокарцинома прямой кишки, STAD – аденокарцинома желудка. (б) Общая выживаемость (кривая Каплана–Мейера) пациентов с PDAC в группах с высоким (n = 88) и низким (n = 88) уровнем экспрессии CASC8 в постоперационных опухолевых образцах.

Тем не менее большинство опубликованных научных работ о CASC8 носит аналитический характер и посвящено установлению корреляции отдельных нуклеотидных полиморфных замен в ее гене с рисками развития различных типов рака [6]. Попытки выявить функциональную роль самой днРНК CASC8 были проведены лишь в нескольких экспериментальных исследованиях. Было показано, что экспрессия CASC8 в клетках ретинобластомы способствует снижению уровня опухолесупрессорной miR-34a и последующему усилению пролиферативной активности [7]. В случае немелкоклеточного рака легкого подавление экспрессии CASC8 приводило к ингибированию пролиферации клеток, их способности к инвазии, миграции и колониеобразованию, а также повышало их чувствительность к осимертинибу [8]. В работе [9] было продемонстрировано, что подавление экспрессии CASC8 в PDAC приводит к активации miR-129-5p и ингибированию мРНК TOB1, однако биологическая значимость данного влияния, как и функция TOB1 при канцерогенезе, не выяснена.
Мы обнаружили, что во всех исследованиях было полностью проигнорировано существование четырех различных изоформ CASC8, аннотированных в базах данных (Ensembl, NCBI, USCS). Причем в работе 2014 г. [10] были проведены эксперименты по определению 5'- и 3'-концов всех транскриптов CASC8 c помощью метода RACE (от англ. “Rapid Amplification of cDNA Ends”) в клетках рака толстой кишки. Исходя из полученных результатов (рис. 2а) можно сделать вывод, что продукты экспрессии гена CASC8 представлены протяженным транскриптом (i1), состоящим из трех первых экзонов, и двумя короткими изоформами: i2 содержит экзоны 5, 6 и 7, а i3 – экзоны 5 и 7. Изоформа i1a по данным [10] не экспрессируется и, вероятно, является результатом аннотирования предшественника днРНК. При этом транскрипты i1 и i2/i3 не имеют общих экзонов, т.е. представляют собой две совершенно разные днРНК. Примечательно, но во всех ранее опубликованных работах про CASC8 при проведении ОТ-ПЦР использовали праймеры, комплементарные экзонам 1-3, т.е. специфичные для i1. При этом согласно доступной информации из базы данных UCSC, данная изоформа практически отсутствует в тканях PDAC. Таким образом, целью данной работы являлись идентификация различных изоформ CASC8 днРНК в клеточных культурах PDAС и сравнительный анализ уровней их экспрессии.
Рис. 2.
Сравнительный анализ относительной экспрессии (ОТ-ПЦР) различных изоформ CASC8. (а) Схема экзонной организации транскриптов CASC8. Штриховкой обозначены экзоны (или их части), аннотированные в базах данных, сплошным цветом – экзоны, наличие которых подтверждено экспериментально [10]. Пунктирными линиями указаны участки, комплементарные праймерам ПЦР для амплификации каждой из изоформ. (б) Уровни экспрессии транскриптов CASC8 (i1, i2, i3) в различных клеточных линиях рака поджелудочной железы по сравнению с контрольными клетками.
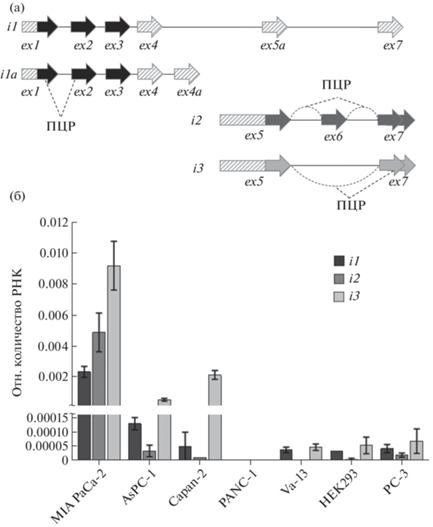
В качестве объектов исследования были выбраны четыре линии протоковой аденокарциномы поджелудочной железы: MIA PaCa-2, PANC-1, AsPC-1 и Capan-2, отличающиеся по скорости пролиферации и/или степени дифференцировки [11]. Для контроля также использовали клетки PC-3 (аденокарцинома предстательной железы), VA-13 (фибробласты легкого) и HEK293 (фетальные клетки почки). Измерение количества РНК проводили с помощью ОТ-ПЦР, для нормировки использовали U6 мяРНК. Пары праймеров для ПЦР подбирали таким образом, чтобы они были комплементарны разным экзонам CASC8, а в случае i2 и i3 – местам соединения экзонов (рис. 2а), т.е. амплифицировали каждую изоформу отдельно.
Все три контрольные линии PC-3, VA-13 и НЕК293, а также Capan-2 (наименее агрессивная линия PDAC) демонстрировали крайне низкие уровни экспрессии транскрипта i1 CASC8 – едва ли выше уровня детекции ОТ-ПЦР. Чуть более явная экспрессия была детектирована в случае AsPC-1, тогда как для MIA PaCa-2 количество i1 было в ~20 раз выше. Кроме того, в данных клетках был также зафиксирован экстремально высокий уровень экспрессии i2, хотя по распределению транскриптов в других проанализированных клеточных линиях i2 является минорной изоформой. Напротив, изоформа i3, судя по всему, является преобладающей для клеток PDAC, и ее максимальная экспрессия была также зафиксирована для клеток MIA PaCa-2.
Исключением являются клетки PANC-1, для которых не удалось детектировать экспрессию ни одного из транскриптов CASC8. Таким образом, данная клеточная линия является своего рода природным нокдауном, что может быть использовано в последующих экспериментах. Напротив, клетки MIA PaCa-2 экспрессируют максимальное количество всех вариантов CASC8 РНК, включая условно минорный транскрипт i2. Мы полагаем, что данное отличие может быть обусловлено различной природой MIA PaCa-2 и PANC-1 [12]. Несмотря на то что обе клеточные линии происходят от агрессивных низкодифференцированных опухолей PDAC, они довольно сильно отличаются по морфологии, гетерогенности клеточной популяции и по экспрессии различных факторов. Основные споры вызывает эпителиально-мезенхимальный (EMT) статус данных линий. Хотя и MIA PaCa-2, и PANC-1 проявляют так называемый мезенхимальный фенотип, в большинстве научной литературы они считаются “квази-мезенхимальным” субтипом клеток PDAC [13]. При этом PANC-1 практически не экспрессирует Е-кадгерин и обладает более явным метастатическим потенциалом [12]. Тем не менее в клеточных линиях AsPC-1 и Capan-2 преобладающей изоформой CASC8 также является i3, что свидетельствует об ограниченной применимости существующих литературных данных о функционировании CASC8 в PDAC [9], поскольку в этих исследованиях рассматривали только изоформу i1. Мы полагаем, что неверное аннотирование изоформ CASC8 также может являться причиной, по которой в некоторых научных исследованиях не удалось подтвердить факт активации этой днРНК в тканях поджелудочной железы пациентов с PDAC [14], поскольку при проведении ОТ-ПЦР использовали праймеры, комплементарные i1. Корректное аннотирование основного транскрипта CASC8 в последующих работах также является необходимым для оценки ее диагностического потенциала.
Таким образом, в ходе данного исследования мы впервые оценили экспрессию различных изоформ CASC8 в клетках протокового рака поджелудочной железы и выявили наиболее представленный транскрипт. Было обнаружено, что максимальная экспрессия всех изоформ CASC8 наблюдается в клеточной линии MIA PaCA-2, в то время как в клетках PANC-1 данная днРНК вовсе не экспрессируется. Данное отличие позволяет использовать PANC-1 как контрольную линию в экспериментах in vitro, а также как удобный модельный объект для суперэкспрессии CASC8. Отметим, что ген CASC8 расположен в локусе 8q24.21, кодирующем целый ряд важных про-опухолевых днРНК (PCAT1, PVT1, CCAT1, CCAT2, ССВС26 и др.) и микроРНК (miR-1204, miR-3686, miR-5194 и др.), находящихся в непосредственной близости от онкогена Myc и в том числе влияющих на его экспрессию [15]. Установление функциональной роли CASC8 (и ее отдельных транскриптов) может привнести существенный вклад в понимание механизмов регуляции данного локуса.
Список литературы
Rawla P., Sunkara T., Gaduputi V. // World J Oncol. 2019. V. 10. P. 10–27.
Tsen A., Barbara M., Rosenkranz L. // Pancreatology. 2018. V. 18. P. 862–867.
Bolha L., Ravnik-Glavač M., Glavač D. // Dis Markers. 2017. V. 2017. P. 7243968.
Mortoglou M., Tabin Z.K., Arisan E.D., et al. // Transl. Oncol. 2021. V. 14. P. 101090.
Ghafouri-Fard S., Fathi M., Zhai T., et al. // Biomolecules. 2021. V. 11. P. 1665.
Cui Z., Gao M., Yin Z., et al. // Cancer Manag Res. 2018. V. 10. P. 3141–3148.
Yang B., Gu B., Zhang J., et al. // Cancer Manag Res. 2020. V. 12. P. 13461–13467.
Jiang X., Guan J., Xu Y., et al. // J Cancer. 2021. V. 12. P. 387–396.
Zhu W., Gao W., Deng Y., et al. // Onco Targets Ther. 2020. V. 13. P. 12083–12096.
Kim T., Cui R., Jeon Y.J., et al. // Proc Natl Acad Sci USA. 2014. V. 111. P. 4173–4178.
Deer E.L., González-Hernández J., Coursen J.D., et al. // Pancreas. 2010. V. 39. P. 425–435.
Gradiz R., Silva H., Carvalho L., et al. // Sci Rep. 2016. V. 6. P. 21648.
Collisson E.A., Sadanandam A., Olson P., et al. // Nat Med. 2011. V. 17. P. 500–503.
Wang Y., Yang Y., Wang Y., et al. // Front Cell Dev Biol. 2020. V. 8. P. 392.
Wilson C., Kanhere A. // Int. J. Mol. Sci. 2021. V. 22. P. 1094.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


