Доклады Российской академии наук. Науки о жизни, 2022, T. 505, № 1, стр. 263-270
АНКСИОЛИТИЧЕСКОЕ ДЕЙСТВИЕ ПЕПТИДОВ МОРСКОЙ АНЕМОНЫ HETERACTIS CRISPA, МОДУЛЯТОРОВ TRPV1 И ASIC КАНАЛОВ
О. В. Синцова 1, Р. С. Калина 1, И. Н. Гладких 1, Ю. А. Паликова 2, В. А. Паликов 2, Н. А. Бороздина 2, А. А. Климович 1, А. С. Меньшов 1, И. А. Дьяченко 2, Е. В. Лейченко 1, *
1 Тихоокеанский институт биоорганической химии
им. Г.Б. Елякова Дальневосточного отделения Российской академии наук
Владивосток, Россия
2 Филиал Института биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
* E-mail: leychenko@gmail.com
Поступила в редакцию 15.03.2022
После доработки 02.04.2022
Принята к публикации 04.04.2022
- EDN: BGHRXO
- DOI: 10.31857/S268673892204014X
Аннотация
Ранее сообщалось о вовлеченности ваниллоидных (TRPV) и кислоточувствительных (ASIC) ионных каналов в физиологические процессы, связанные с развитием тревожных расстройств. Это делает их лиганды новыми потенциальными анксиолитическими средствами. Нами была изучена эффективность двух пептидов морской анемоны Heteractis crispa, Hcr 1b-2 и HCRG21, модуляторов ASIC1a и TRPV1 каналов, соответственно, в тестах открытое поле и приподнятый крестообразный лабиринт. Согласно полученным данным, HCRG21 вызывает достоверное снижение уровня тревожности и стимулирует активность животных в исследуемых дозах 0.01−1 мг/кг, в то время как Hcr 1b-2 оказывает слабо выраженное анксиолитическое действие только в дозе 0.1 мг/кг. Изучение фармакодинамики HCRG21 показало, что пептид оказывает анксиолитическое действие в течение 2 ч, при этом эффективность исследуемого пептида выше эффективности препарата сравнения.
Тревожные расстройства (генерализованное тревожное расстройство, паническое расстройство, социальное тревожное расстройство и др.) являются распространенными психическими расстройствами [1]. Диагностика тревожных расстройств часто затруднена (особенно при обращении пациентов к специалистам общего профиля), что связано с большим разнообразием клинических проявлений [2].
Препараты первого выбора для лечения таких расстройств – это селективные ингибиторы обратного захвата серотонина и ингибиторы обратного захвата серотонина-норадреналина. Другие варианты лечения включают прегабалин, трициклические антидепрессанты, буспирон, моклобемид и другие, которые, к сожалению, также не лишены побочных эффектов [1]. В то же время поиск и изучение новых лидерных соединений для их лечения представляются актуальным.
Установлено, что в физиологических процессах, связанных с тревожным поведением, важную роль играют ваниллоидные (TRPV) и кислоточувствительные (ASIC) ионные каналы [3–5]. В этом контексте каналы TRPV1 кажутся многообещающей терапевтической мишенью [6]. Синаптическая коммуникация и процессы долговременной депрессии также связаны с активностью TRPV1 [7]. Кроме того, TRPV1 каналы способны влиять на эндованиллоидную и опиоидную системы, участвующие в патофизиологии таких расстройств, как зависимость и тревожность [8]. Наконец, показано, что TRPV1 косвенно вовлечен в модуляцию активности µ-опиоидных рецепторов (MOR) и рецепторов каннабиноидного типа 1 (CB1) [8]. Некоторые доклинические данные позволяют предположить, что подтип TRPV1 является наиболее подходящей мишенью-кандидатом для разработки терапевтически полезных модуляторов для лечения депрессии, паники, беспокойства и аддиктивных расстройств [9, 10].
Еще одним из механизмов, лежащих в основе развития чувства страха и тревожных расстройств, является ASIC1a-опосредованный молекулярный механизм [11]. Помимо участия ASIC1a в обучении, памяти и синаптической пластичности, эти каналы являются хеморецепторами ЦНС, реагирующими на снижение pH в головном мозге в результате вдыхания CO2. Это приводит к активации ASIC1a каналов в миндалевидном теле, ответственных за реализацию поведения, связанного со страхом, и провоцирует повышение тревожности [11]. Показано, что мыши, нокаутные по гену, кодирующему ASIC1a, значительно менее подвержены возникновению чувства тревоги в ответ на резкие шумы и запах хищника [12], тогда как повышенная экспрессия каналов в организме приводит к усилению этого чувства [13].
В настоящей работе анксиолитический эффект двух пептидных модуляторов ионных каналов, HCRG21 − блокатора TRPV1 (IC50 6.9 мкМ) [14] и Hcr 1b-2 − ингибитора ASIC1a (IC50 4.8 мкМ) [15], был изучен на мышах линии ICR в тестах открытое поле и приподнятый крестообразный лабиринт. В качестве препарата сравнения использовали афобазол − широко применяемое в клинической практике лекарственное средство с выраженным анксиолитическим эффектом.
Пептид Hcr 1b-2 (41 а.о., 4522 Да) был выделен из экстракта морской анемоны Heteractis crispa, как было описано ранее [15], тогда как пептид HCRG21 (56 а.о., 6228 Да), аминокислотная последовательность которого была установлена при анализе транскриптов, кодирующих пептиды Кунитц-типа той же морской анемоны, был получен с помощью гетерологической экспрессии в системе Escherichia coli [14].
Влияние пептидов на двигательную активность и ориентировочно-исследовательское поведение животных было изучено с помощью стандартных установок “Открытое поле” (Opto-varimex ATM3 auto system, Columbus, USA) и “Приподнятый крестообразный лабиринт” (ПКЛ) (Open Science, Россия). Анксиолитическая активность пептидов оценивалась по снижению уровня тревожности и страха, по увеличению уровня исследовательской мотивации, показателя принятия решения и общей двигательной активности, которая определялась по времени пребывания в открытых зонах и по латентному периоду ухода с центра площадки [16].
В экспериментах использовались самцы мышей линии ICR. Животные были получены из НПП ФИБХ РАН питомника лабораторных животных “Пущино” в возрасте 4 нед. Животные содержались в комнате содержания животных барьерной зоны 2 в контролируемых условиях окружающей среды (температура 20–24°C, относительная влажность 30–70%, 12-часовой цикл освещения (08:00–20:00 – “день”, 20:00–08:00 – “ночь”) и, по крайней мере, 10-кратная смена объема воздуха комнаты в час). Все экспериментальные процедуры одобрены Комиссией по контролю за содержанием и использованием лабораторных животных “ФИБХ РАН”.
Пептиды в дозах 0.01−1 мг/кг в физиологическом растворе были введены внутримышечно за 1 ч до тестирования. В качестве препарата сравнения был использован доступный коммерческий анксиолитический препарат “Афобазол”, который вводился мышам контрольной группы перорально в дозе 5 мг/кг за 1 ч до тестирования. Анксиолитический эффект препарата “Афобазол” в условиях стресса проявляется в снижении внутреннего напряжения, беспокойства, тревоги, страха, улучшении адаптивных способностей и восстановлении когнитивных функций. При этом наблюдается “пассивный” тип эмоционально-стрессовой реакции у животных: снижение подвижности и исследовательской мотивации, которое проявляется в реакции замирания.
В результате оценочных тестов (продолжительность тестирования составляла 3 мин на установке “Открытое поле” и 5 мин на ПКЛ) было установлено, что оба пептида оказывают выраженное анксиолитическое действие и умеренный стимулирующий эффект на ЦНС.
Пептид HCRG21 стимулировал двигательную и ориентировочно-исследовательскую активность животных при отсутствии выраженного возбуждающего действия на ЦНС. В группах животных, пролеченных HCRG21, наблюдалось умеренное увеличение как пройденного расстояния, так и времени активности, в том числе и вертикальной активности, по сравнению с контрольной группой (рис. 1). Достоверность статистических различий определяли с помощью параметрического t-критерия Стьюдента для независимых выборок. За достоверные принимали различия при P ≤ 0.05. Статистическую и графическую обработку экспериментальных данных осуществляли с использованием статистического пакета Microsoft Excel 2007. Нейростимулирующий эффект HCRG21 был дозозависимым (рис. 1а). Пептид Hcr 1b-2 не оказывал стимулирующее действие на ЦНС, хотя в дозе 0.1 мг/кг (рис. 1б) наблюдалось достоверное увеличение пройденного расстояния, при этом время активности было сравнимо с контрольной группой (рис. 1в).
Рис. 1.
Показатели локомоторной и ориентировочно-исследовательской активности животных в тесте “Открытое поле”: а – пройденное расстояние; б – вертикальная активность; в – время активности и время пассивности животных во время тестирования (3 мин). Результаты представлены как MEAN ± SD, при n = 7. Достоверные отличия представлены относительно контрольной группы (Физ. раствор), * – p ≤ 0.05, ** – p ≤ 0.01, (t-тест).

Пептиды заметно снижали уровень тревожности и стимулировали исследовательскую мотивацию животных. В тесте ПКЛ было обнаружено достоверное увеличение времени, проводимого в открытых зонах лабиринта, при одновременном уменьшении времени пребывания в закрытых рукавах по сравнению с контрольной группой (рис. 2). Учитывая боязнь высоты и открытого освещенного пространства у грызунов, данные показатели можно рассматривать как проявление меньшей тревожности у мышей. Следует отметить, что HCRG21 оказывал анксиолитическое действие во всех исследуемых дозах и превосходил по эффективности препарат сравнения “Афобазол”, тогда как достоверное анксиолитическое действие Hcr 1b-2 в тесте ПКЛ проявлялось только в дозе 0.1 мг/кг.
Рис. 2.
Показатели эмоционально-двигательного поведения разных групп животных в тесте ПКЛ при внутримышечном введении пептидов. а – закрытые рукава, б – открытые зоны (открытые рукава, центральная площадка). Результаты представлены как MEAN ± SD, при n = 7. Достоверные отличия представлены относительно контрольной группы (физ. раствор), * − p ≤ 0.05, ** − p ≤ 0.01 (t-тест).

Примечательно, что блокатор TRPV1 канала, пептид HCRG21, обладал более выраженным анксиолитическим эффектом, чем пептид Hcr 1b-2, ингибитор канала ASIC1a, при относительно близких значениях IC50 данных пептидов по отношению к соответствующим каналам. Данный факт может косвенно указывать на большую вовлеченность TRPV1, нежели ASIC1a каналов, в процессы патогенеза тревожных расстройств, с одной стороны, но также быть результатом выраженного неспецифического действия пептида Hcr 1b-2 на ряд молекулярных мишеней [17].
Для HCRG21 была изучена фармакодинамика при внутримышечном и пероральном способах введения в дозах 0.1 и 0.5 мг/кг в тесте ПКЛ. Для перорального введения в качестве препарата сравнения был использован препарат “Афобазол” в дозе 5 мг/кг. Для внутримышечного введения в дозе 5 мг/кг использовали действующее вещество препарата “Афобазол” − фабомотизол, который получали экстракцией таблеток массой 4.5 г (содержание действующего вещества 0.3 г) 0.05 М раствором гидрокарбоната натрия (температура 25°С, 1 ч), с последующим извлечением его из солевого раствора этилацетатом (соотношение объемов фаз 1 : 1). Наличие фабомотизола было подтверждено методом 1H-ЯМР спектроскопии (300.13 МГц, DMSO-d6, δ, м.д., J, Гц): 7.34 (d, 8.7 Hz,1H), 6.95 (d, 2.31 Hz,1H), 6.76 (dd, J = = 8.70, 2.40 Hz, 1H), 4.02 (q, J = 6.96 Hz, 2H), 3.83 (t, J = 4.71 Hz, 4H), 3.60 (t, J = 7.17 Hz, 2H), 3.38 (t, J = 6.45 Hz, 2H), 3.20 (br.s., 4H), 1.33 (t, J = 6.84 Hz, 3H) (рис. 3). Полученные значения химических сдвигов (δ) и констант спин-спинового взаимодействия (J) соответствовали литературным данным [18]. Чистота фабомотизола была подтверждена с помощью масс-спектрометрии высокого разрешения (рис. 4). Теоретическое и полученное значения m/z для пика моноизотопного [M + H]+ иона составили 308.1427 и 308.1431 Да соответственно.
Рис. 3.
Спектр 1H-ЯМР. Шкала химических сдвигов привязана к сигналу протонов диметилсульфоксида (2.49 м.д.).

Рис. 4.
ИЭР масс-спектр фабомотизола. Масс-спектр был получен на масс-спектрометре Agilent 6510 Q-TOF LC/MS (Agilent Technologies, США), оборудованном источником ионизации электрораспылением Dual-Spray ESI, с помощью программ MassHunter Data Acquisition и MassHunter Qualitative Analysis (вер. 02.00, Agilent Technologies, США).

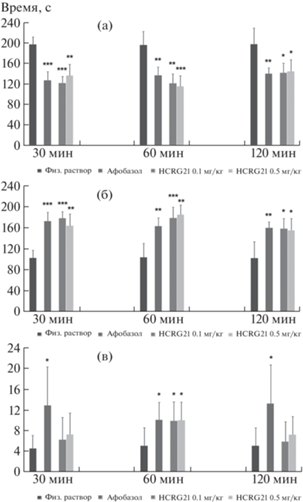
Установлено, что при внутримышечном введении пептид в обеих дозах достоверно увеличивал время пребывания животных на открытых зонах ПКЛ, и латентный период ухода с центральной площадки и уменьшал время пребывания в закрытых рукавах. Анксиолитическое действие HCRG21 проявлялось уже спустя 30 мин и повышалось спустя 60 мин после введения, причем его эффект был сравним (через 30 мин) или превосходил (через 60 мин) эффект фабомотизола (рис. 5). Через 120 мин после введения было отмечено незначительное (примерно на 10%) снижение эффективности, как пептида в обеих дозах, так и фабомотизола.
Рис. 5.
Динамика анксиолитического действия пептида HCRG21 при внутримышечном введении в тесте ПКЛ. а – время пребывания в закрытых рукавах, б – время пребывания в открытых зонах (открытые рукава, центральная площадка), в – латентный период ухода с центральной площадки. Результаты представлены как MEAN ± SD, при n = 7. Достоверные отличия представлены относительно контрольной группы (физ. раствор), * − p ≤ 0.05, ** − p ≤ 0.01, *** − p ≤ 0.001 (t-тест).
При пероральном способе введения анксиолитическое действие HCRG21 было менее выраженным и пролонгированным, чем при внутримышечном. Через 60 мин после введения эффект пептида в обеих дозах был сопоставим с эффектом афобазола в дозе 5 мг/кг: наблюдались достоверное уменьшение времени пребывания в закрытых рукавах и повышение времени пребывания в открытых зонах. Через 120 мин эффект HCRG21 заметно снижался (рис. 6).
Рис. 6.
Динамика анксиолитического действия пептида HCRG21 при пероральном введении в тесте ПКЛ. а – время пребывания в закрытых рукавах, б – время пребывания в открытых зонах (открытые рукава, центральная площадка), в – латентный период ухода с центральной площадки. Результаты представлены как MEAN ± SD, при n = 7. Достоверные отличия представлены относительно контрольной группы (физ. раствор), * − p ≤ 0.05, ** − p ≤ 0.01, *** − p ≤ 0.001 (t-тест).

Представленные в работе результаты согласуются с данными, полученными для ряда других ингибиторов ASICs и TRPV1 в различных экспериментах, связанных с изучением анксиолитического и антидепрессивного действия [3, 4, 19–21]. Они не только подтверждают гипотезу об участии ионных каналов в генезе тревожных расстройств, но и создают предпосылки для разработки новых эффективных противотревожных препаратов.
Список литературы
Bandelow B., Michaelis S., Wedekind D. Treatment of anxiety disorders // Dialogues Clin. Neurosci. 2017. V. 19. № 2. P. 93–107.
Wittchen H.-U. Generalized anxiety disorder: prevalence, burden, and cost to society // Depress. Anxiety. 2002. V. 16. № 4. P. 162–171.
Coryell M.W., Wunsch A.M., Haenfler J.M., et al. Acid-Sensing ion channel-1a in the amygdala, a novel therapeutic target in depression-related behavior // J. Neurosci. 2009. V. 29. № 17. P. 5381–5388.
Sluka K.A., Winter O.C., Wemmie J.A. Acid-sensing ion channels: A new target for pain and CNS diseases // Curr. Opin. Drug Discov. Devel. 2009. V. 12. № 5. P. 693–704.
Aguiar D.C., Terzian A.L.B., Guimaraes F.S., et al. Anxiolytic-like effects induced by blockade of transient receptor potential vanilloid type 1 (TRPV1) channels in the medial prefrontal cortex of rats // Psychopharmacology (Berl). 2009. V. 205. № 2. P. 217–225.
Escelsior A., Sterlini B., Murri M.B., et al. Transient receptor potential vanilloid 1 antagonism in neuroinflammation, neuroprotection and epigenetic regulation: Potential therapeutic implications for severe psychiatric disorders treatment // Psychiatr. Genet. 2020. V. 30. № 2. P. 39–48.
Grueter B.A., Brasnjo G., Malenka R.C. Postsynaptic TRPV1 triggers cell type-specific long-term depression in the nucleus accumbens // Nat. Neurosci. 2010. V. 13. № 12. P. 1519–1526.
Zador F., Wollemann M. Receptome: Interactions between three pain-related receptors or the “triumvirate” of cannabinoid, opioid and TRPV1 receptors // Pharmacol. Res. 2015. V. 102. P. 254–263.
Naziroglu M., Demirdas A. Psychiatric disorders and TRP channels: Focus on psychotropic drugs // Curr. Neuropharmacol. 2015. V. 13. № 2. P. 248–257.
Quagliato L.A., Nardi A.E. The role of convergent ion channel pathways in microglial phenotypes: a systematic review of the implications for neurological and psychiatric disorders // Transl. Psychiatry. 2018. V. 8. P. 259.
Ziemann A.E., Allen J.E., Dahdaleh N.S., et al. The amygdala is a chemosensor that detects carbon dioxide and acidosis to elicit fear behavior // Cell. 2009. V. 139. № 5. P. 1012–1021.
Coryell M.W., Ziemann A.E., Westmoreland P.J., et al. Targeting ASIC1a reduces innate fear and alters neuronal activity in the fear circuit // Biol. Psychiatry. 2007. V. 62. № 10. P. 1140–1148.
Wemmie J.A., Coryell M.W., Askwith C.C., et al. Overexpression of acid-sensing ion channel 1a in transgenic mice increases acquired fear-related behavior // Proc. Natl. Acad. Sci. 2004. V. 101. № 10. P. 3621–3626.
Monastyrnaya M., Peigneur S., Zelepuga E., et al. Kunitz-Type peptide HCRG21 from the sea anemone Heteractis crispa is a full antagonist of the TRPV1 receptor // Mar. Drugs. 2016. V. 14. № 12. P. 229.
Kalina R., Gladkikh I., Dmitrenok P., Chernikov O., Koshelev S., Kvetkina A., Kozlov S., Kozlovskaya E., Monastyrnaya M. New APETx-like peptides from sea anemone Heteractis crispa modulate ASIC1a channels. Peptides 2018. V. 104. P. 41–49.
Миронов А.Н., ред. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М.: Гриф и К, 2013.
Pinheiro-Junior E.L., Kalina R., Gladkikh I., et al. A tale of toxin promiscuity: The versatile pharmacological effects of Hcr 1b-2 sea anemone peptide on voltage-gated ion channels // Mar. Drugs. 2022. V. 20. № 2. P. 147.
Электронный источник: https://www.tsbiochem. com/compound/Afobazole%20 hydrochloride. Ссылка активна на 5 марта 2022.
Тишкина А.О., Мартьянова Е.К., Логашина Ю.А., и др. Эффекты интраназального введения пептидного антагониста ванилоидного рецептора типа I (TRPV1) на центральную нервную систему грызунов // Доклады биологических наук. 2016. Т. 470. № 1. С. 234–236.
Kasckow J.W., Mulchahey J.J., Geracioti T.D. Effects of the vanilloid agonist olvanil and antagonist capsazepine on rat behavior // Prog. Neuro-Psychopharmacology Biol. Psychiatry. 2004. V. 28. № 1. P. 291–295.
Hayase T. Differential effects of TRPV1 receptor ligands against nicotine-induced depression-like behaviors // BMC Pharmacol. 2011. V. 11. № 1. P. 6.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


