Доклады Российской академии наук. Науки о жизни, 2022, T. 506, № 1, стр. 411-416
ПЕРЕСТРОЙКА ОПТОКИНЕТИЧЕСКОГО РЕФЛЕКСА В ПЕРИОД МЕТАМОРФОЗА У ОБЫКНОВЕННОЙ ЧЕСНОЧНИЦЫ (Pelobates fuscus, Laur.)
Е. И. Киселева 1, О. Ю. Орлов 2, В. А. Бастаков 1, 2, *
1 Институт проблем экологии и эволюции
им. А.Н. Северцова Российской академии наук
Москва, Россия
2 Институт проблем передачи информации
им. А.А. Харкевича Российской академии наук
Москва, Россия
* E-mail: perrli@yandex.ru
Поступила в редакцию 24.04.2022
После доработки 26.05.2022
Принята к публикации 26.05.2022
- EDN: VLUSHQ
- DOI: 10.31857/S2686738922050158
Аннотация
Исследована перестройка системы стабилизации взора у обыкновенной чесночницы методом количественного анализа оптомоторной реакции с использованием видеосъемки. Стабилизация взора – важная составляющая в системе нейронных механизмов формирования глубины зрительного пространства. Показано, что у головастиков обыкновенной чесночницы, ведущих водный образ жизни, оптомоторная реакция похожа на таковую рыб (движение животного в направлении движения зрительного фона и нистагм глаз, состоящий из быстрой и медленной фаз). В период метаморфоза (переход от водного к наземному образу жизни) сеголетки чесночниц реагировали на движение зрительного фона нистагмом глаз и головы. Через год после метаморфоза сеголетки чесночниц реагировали в ответ на движение зрительного фона как взрослые бесхвостые амфибии – только нистагмом головы (медленная и быстрая фазы), а движения глаз практически отсутствовали. Обсуждены вопросы, связанные с причинами утраты бесхвостыми амфибиями в процессе эволюции активных движений глаз.
Стабилизация изображения на сетчатке во время собственных перемещений имеет огромное значение для всех животных, ведущих активный образ жизни. Быстрое смещение изображения по сетчатке может привести к расфокусированию изображения, к утрате контраста и остроты зрения. Стабилизация изображения на сетчатке предназначена для сведения к минимуму этих разрушительных последствий движений тела и головы на способность адекватно воспринимать структурированную окружающую среду. Стабилизацию изображения как во время собственных перемещений, так и во время движения всего или большей части зрительного фона (как, например, при движении листьев и веток деревьев во время порывов ветра) обеспечивают компенсаторные рефлексы, которые активируются в вестибулярной системе, в сетчатке и проприоцептивной системе [1, 2]. Зрительная составляющая системы стабилизации взора изучена в т.н. оптокинетической реакции. В лабораторных условиях эта реакция выявляется в ответ на движение всего или большей части зрительного фона и традиционно в качестве стимула используются движущиеся перемежающиеся черные и белые полосы. При такой стимуляции лягушки и жабы реагируют прослеживающими движения головы и/или глаз и быстрым возвратом глаз и/или головы в исходное положение – компенсирующие движения [2, 3]. Оптокинетический рефлекс в ответ на движение полос оптомоторного барабана можно рассматривать как ответ на «динамическую» имитацию ситуации, которая возникает на сетчатке во время собственных перемещений животного и позволяет оценить отдельно вклад зрительных и других механизмов в систему стабилизации взора при собственной локомоторной активности. Но недавно получены данные о новом альтернативном механизме стабилизации взора у головастиков шпорцевой лягушки (Xenopus laevis), посредством которого копии ритмических моторных команд из центров спинного мозга (генерирующих волнообразные движения хвоста) могут напрямую вызывать движения глаз, подходящие, как считают авторы, для стабилизации изображения во время перемещений животного, и провоцировать компенсирующие движения глаз перед моторным актом [4]. Схожие результаты были получены и на мальках Danio rerio [5]. Показано также, что у постоянно живущих в воде Xenopus laevis в период метаморфоза происходит переключение источников регуляции движениями глаз от моторных центров спинного мозга с хвостового на центры, генерирующие моторные команды задних конечностей [6]. Альтернативный механизм стабилизации взора при собственных перемещениях важен для водных животных, которые большую часть жизни активно двигаются, – мальки и взрослые рыбы, личинки тритонов, головастики и водные лягушки. Но при переходе большинства видов бесхвостых амфибий в период метаморфоза на наземный образ жизни от рыбоподобной личинки удельный вес оптокинетических и вестибулярных механизмов стабилизации должен возрастать, поскольку постметаморфозные и взрослые бесхвостые амфибии в значительной своей части малоподвижны и, в нагульный период проявляют себя как засадные хищники, за исключением относительно коротких периодов весенних и осенних миграций.
Целью настоящей работы являлось изучение перестройки зрительной составляющей системы стабилизации взора в ряду головастики – животные в период метаморфоза – взрослые в возрасте один год.
В экспериментах использовали 24 головастика на 36–38 стадии развития, 15 особей на стадии метаморфоза (45–46 стадии) (Gosner, 1960) и 16 годовалых особей чесночницы обыкновенной (Pelobates fuscus Laur.). Отлов головастиков производили в естественном водоеме в районе реки Москва около деревни Шихово, Звенигородского района, Московской области. Головастиков на стадии 36–38 [7] содержали в аквариумах из пластика объемом 15 л по пять особей в каждом. Воду в аквариумах периодически меняли. Головастиков кормили детритом из родного водоема, а также вареными и растертыми листьями молодой крапивы (Urtica dioica L.). Годовалые чесночницы содержались индивидуально, каждая в своем аквариуме, где поддерживался высокий уровень влажности. Чесночниц кормили кузнечиками, а также различными двукрылыми. Для исследования зрительных реакций в ответ на движение зрительного фона использовали оптомоторный барабан, представляющий из себя цилиндр диаметром 17 см, на внутреннюю поверхность которого были нанесены чередующиеся черные и белые полосы шириной 2.5 см. В предварительных опытах были определены эти параметры стимула как оптимальные как для взрослых чесночниц и их головастиков. Барабан приводился в движение электрическим мотором с редуктором, что позволяло менять скорость его вращения в диапазоне от 0.3 до 3 см/с. Далее скорость рассчитывали в угловых градусах в сек. При исследовании особенностей оптомоторной реакции животных в период метаморфоза использовали оптимальные параметры стимула, выявленные в опытах со взрослыми животными. Реальную скорость стимула рассчитывали с учетом положения животного в стеклянном цилиндре (15 см в диаметре), поскольку и головастики, и взрослые чесночницы во время эксперимента обычно располагались ближе к стенкам цилиндра. Поведение животных в ответ на движение полос барабана регистрировали на цифровую видеокамеру Samsung HMX-S16. Скорость видеосъемки составляла 50 кадров/с. В отдельных случаях, для учета быстрых движений глаз и головы животных в оптомоторном барабане скорость видеорегистрации составляла 300 кадров/с. Для анализа поведения головастиков и взрослых чесночниц использовали видео редакторами iMovie и QuickTime Player, Movavi. Время тестирования составляло 60 с для трех возрастных групп чесночниц – головастиков, сеголеток и чесночниц возрастом один год. Перед тестированием животных адаптировали к условиям эксперимента в течение одной минуты. Видеоматериал анализировали и оценивали количество движений глаз, головы и тела, которые вызывались движением полос оптомоторного барабана (нистагм глаз, нистагм головы, проявления смещенной активности – моргания и вытирающие движения лапами глаз). Также была измерена амплитуда движений глаз у одного головастика. Из каждой возрастной группы чесночниц в экспериментах использовали по 10 особей. Полученные экспериментальные данные обработаны статистически. Для статистической обработки полученного материала использовали программу STATISTICA. Для сравнения числа движений глазами и головой внутри каждой возрастной группы использовали критерий Фридмана и Вилкоксона для сопряженных пар. Также этот критерий использовали для сравнения среднего количества нистагмов глаз головастиков в ответ на все варианты скорости движения чередующихся полос оптомоторного барабана. Для сравнения разницы в числе движений глазами и головой между группами разного возраста использовали критерий Манна–Уитни.
Суммарные данные по трем возрастным группам чесночниц – головастики, метаморфы и чесночницы в возрасте 1 год представлены в табл. 1. Для каждой возрастной группы подсчитывали количество визиомоторных реакций в ответ на движение оптомоторного стимула. Учитывали нистагм глаз, нистагм головы, перемещение животного в направлении и против направления движения стимула для 10 представителей каждой из возрастных прупп животных за 60 с.
Таблица 1.
Реакции обыкновенной чесночницы на оптомоторный стимул на разных стадиях индивидуального развития
| Стадии онтогенеза по Госнеру (Gosner, 1960) | Поведенческая реакция | |||
|---|---|---|---|---|
| нистагм | перемещение животного в/или против направления движения полос барабана | особенности реакции | ||
| глаз | головы | |||
| головастики, стадия 36–38 | + | – | – | отмечались только движения глаз* (ампли-туда около 20°) и редко некоординированное плавание в направлении движения по-лос барабана |
| чесночницы, стадия 45–46 (метаморфоз) | + | + | – | регистрировались как движения глаз* (ам-плитуда 5–7°), так и нистагм головы (ам-плитуда 3–5°), метаморфы были мало по-движны |
| чесночницы в возрасте 1 год | – | + | + | движений глаз нет*, амплитуда нистагма головы составляла 10–15° |
* статистические данные приведены на рис. 2 и 3
Как видно из табл. 1, головастики демонстрируют только движения глаз в ответ на движение оптомоторного стимула.
Систематическое плавание головастиков в направлении движения полос барабана (движение тела в направлении движения полос) отмечалось редко в отличие от взрослых и мальков рыб, у которых эта реакция ярко выражена.
В ответ на движение оптомоторного стимула головастики отчетливо демонстрируют прослеживающие и компенсирующие движения глаз в движущемся оптомоторном барабане. Амплитуда движений глаз у головастиков составляла около 20° (рис. 1). В период метаморфоза наблюдается постепенный переход системы компенсации взора при собственных перемещениях – замена движений глаз в ответ на оптомоторную стимуляцию на таковые движения головой. Обнаруживается определенная динамика данной перестройки, поскольку у большинства лягушат наблюдались одновременно и движения глаз, и движения головы в ответ на движения всего зрительного фона в виде движения чередующихся полос оптомоторного барабана. Последовательность оптомоторной реакции выглядела следующим образом – компенсирующие движения головы и очень редко наблюдались движения туловища в направлении движения полос оптомоторного барабана в ответ на движение полос оптомоторного барабана. Чесночницы в возрасте один год в ответ на движение полос оптомоторного барабана реагируют исключительно движением головы и отчасти тела в направлении движения полос барабана – прослеживание в направлении движения полос барабана и быстрые возвратные движения головой; движений глаз в этих экспериментах не наблюдали. Также следует отметить, что движение полос оптомоторного барабана у взрослых животных представляет собой некомфортную ситуацию и, как следствие этого, во время тестов наблюдали смещенные реакции – частые моргания глазами и движениями передних лап, имитирующие “смахивания” изображения с глаз. В соотношении числа движений глазами и числа движений головой обнаружены статистически значимые различия во всех трех возрастных группах. При сравнении среднего количества нистагмов глаз головастиков в ответ на все варианты скорости движения чередующихся полос оптомоторного барабана критерий Фридмана показал наличие значимых различий (p = 0.00004). Головастики значимо чаще реагировали движениями глаз (критерий Вилкоксона для сопряженных пар: N = 10, Т = 0, p = 0.005), метаморфы – движениями головы (N = 10, Т = 0, p = 0.005). Годовалые особи также реагировали значимо чаще движениями головы (N = 10, Т = 0, p = 0.005). Изменения в соотношении числа движений глазами и головой между головастиками и метаморфами статистически значимы (критерий Манна–Уитни: N1 = 10, N2 = 10, U = 0, p = 0.0002). Также изменения в этом соотношении статистически значимы между метаморфами и годовалыми особями обыкновенной чесночницы (N1 = 10, N2 = 10, U = 12.5, p = 0.005) (рис. 2, 3).
Рис. 1.
Пример нистагма глаз головастика чесночницы. Движения глаз головастиков обыкновенной чесночницы в ответ на движение полос оптомоторного барабана. Диаграмма построена по крайним точкам отклонений во время движений глаза.

Рис. 2.
Количество движений глазами и головой в ответ на оптомоторный стимул у головастиков, метаморфов и годовалых особей обыкновенной чесночницы.
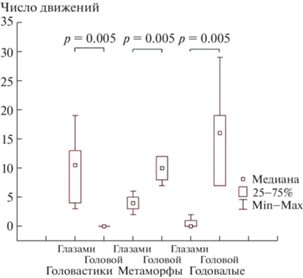
Рис. 3.
Сравнение между числом движений глазами и головой в ответ на предлагаемый стимул в оптомоторном барабане у головастиков, метаморфов и годовалых особей обыкновенной чесночницы.

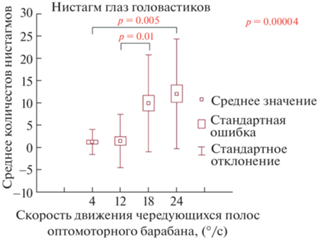
Результаты подсчета количества движений глаз головастиков в оптомоторном барабане представлены на рис. 4, из которого видно, что ответные реакции на оптомоторный стимул с шириной полос около 20° при разных скоростях движения стимула (4°, 12°, 18° и 28°/с) неодинаковы. Более высокие скорости движения оптомоторного стимула (12° и 28°/с) были более эффективны, чем меньшие скорости и достоверно чаще вызывали движение глаз (рис. 4). При сравнении среднего количества нистагмов глаз головастиков в ответ на все варианты скорости движения чередующихся полос оптомоторного барабана критерий Фридмана показал наличие значимых различий (p = 0.00004). Далее, при парном сравнении критерий Вилкоксона показал, что значимых различий в количестве нистагмов в ответ стимулы, движущиеся со скоростью 4° и 12°/с, нет. Также критерий Вилкоксона не выявил значимых различий в количестве нистагмов в ответ стимулы, движущиеся со скоростью 18° и 24°/с. В парном сравнении среднего количества нистагмов глаз головастиков в ответ на стимул, движущийся со скоростью 12° и 18°/с, выявлены значимые различия (p = 0.01). Также выявлены значимые различия (p = 0.005) в парном сравнении среднего количества нистагмов глаз головастиков в ответ на стимул, движущийся со скоростью 4°/с, и стимул, движущийся со скоростью 24°/с. Таким образом, среднее количество нистагмов глаз головастиков достоверно различается при сравнении стимулов со скоростями 4° и 12°/с со стимулами со скоростями 18° и 24°/с. Красным цветом выделены значимые различия (p < 0.05) (рис. 4).
Рис. 4.
Среднее количество движений глазами у головастиков в оптомоторном барабане при разных скоростях движения стимула. Ось Y – среднее количество компенсирующих движений глаз в ответ на движение оптомоторного стимула – движение чередующихся черно-белых полос размером 20 угловых градуса; ось Х – четыре фиксированных скорости движения чередующихся полос оптомоторного барабана.
При сравнении среднего количества нистагмов головы взрослых особей в ответ на все варианты скорости движения чередующихся полос оптомоторного барабана критерий Фридмана показал наличие значимых различий (p = 0.00076). Так, при парном сравнении критерий Вилкоксона показал, что достоверно отличаются (от реакций на остальные стимулы) только реакции на стимул со скоростью 4 (p = 0.004). Реакции на стимул, движущийся со скоростями 12°, 18° и 24°/с, статистически значимо не различаются (p = 0.5). Это также подтверждается при сравнении с использованием критерия Фридмана, статистически незначимое значение p выделено черным. Красным цветом выделены значимые различия (p < 0.05). Таким образом, реакция на стимул, движущийся со скоростью 4°/с, значимо отличается от каждого из остальных стимулов.
Таким образом, эффективность скоростей движения оптомоторного стимула, вызывающего нистагм головы у чесночниц в возрасте один год в диапазоне 12°–24°/с, достоверно не отличалась (рис. 5).
Рис. 5.
Среднее количество компенсирующих движений головой в оптомоторном барабане при разных скоростях движения стимула. Ось Y – среднее количество компенсирующих движений глаз в ответ на движение оптомоторного стимула – движение чередующихся черно-белых полос размером 20 угловых градуса; ось Х – четыре фиксированных скорости движения чередующихся полос оптомоторного барабана.

В период метаморфоза (переход от водного к наземному образу жизни) метаморфы чесночниц реагировали на движение зрительного фона и нистагмом глаз и головы. Причем, амплитуда нистагма глаз у метаморфов была значительно ниже, чем амплитуда нистагма у головастиков, а амплитуда нистагма головы у метаморфов также была значительно ниже, чем у взрослых (табл. 1).
Головастики практически всех видов бесхвостых амфибий в естественных условиях находятся в постоянном движении в поисках растительной пищи. Двигательная активность животных значительно уменьшается у источника пищи, но при этом колебания хвоста не прекращаются, что связано с необходимостью постоянного позиционирования тела. Переход в процессе метаморфоза от рыбоподобной личинки (головастика) к четвероногой особи сопровождается глубокими преобразованиями в строении организма. Постепенно появляются конечности, происходит резорбция хвоста (за счет этого животное питается), меняются ротовой аппарат и пищеварительная система. Вследствие этих и других преобразований кардинально меняется поведение. В естественных условиях после окончания метаморфоза животные располагаются у кромки воды и при опасности скрываются в воде или закапываются в песчаный грунт. Также происходит трансформация двигательного режима с хвостового (осевого) на передвижение с помощью четырех конечностей. После окончания метаморфоза меняется среда обитания и происходит переход к хищничеству. Важно отметить, что сеголетки и взрослые бесхвостые амфибии в большинстве своем являются засадными хищниками и обычно не преследуют добычу, т.е. по сравнению с головастиками они малоподвижны.
Переход в процессе метаморфоза от рыбоподобной личинки к наземному образу жизни у бесхвостых амфибий, в числе прочего, приводит и к кардинальным изменениям системы стабилизации взора. Результаты тестирования реакций чесночниц в оптомоторном барабане показали, что на стадии личиночного развития 36–38 головастики реагируют на движение полос оптомоторного барабана только движениями глаз. Но уже у метаморфов (лягушата с остатками хвоста) в ответ на движение полос барабана отмечались как движения глаз, так и движения головы. Обе эти поведенческие реакции отличались от таковых у головастиков и выглядели как бы редуцированными c амплитудой смещения 2–5 угловых градуса. Через год после метаморфоза чесночницы при оптомоторной стимуляции реагируют только нистагмом головы амплитудой 15–18 угловых градусов. Хотя всем позвоночным животным свойственен оптокинетический рефлекс, экспериментально выявлены отличительные особенности его проявления у разных позвоночных. Млекопитающие способны компенсировать более высокие скорости движения фона, в то время как амфибии, например, не могут этого сделать. У птиц, рептилий и амфибий 80% стабилизации взгляда осуществляется за счет движений головы и движениями тела, в то время как у млекопитающих и рыб стабилизация взора в значительной степени реализуется за счет движений глаз [8, 9]. Лягушки и жабы в ряду позвоночных занимают промежуточное положение за счет того, что в течение жизни занимают две экологические ниши – водную и наземную [10, 11]. Стабилизация взора за счет движений глаз больше привязана к поведенческим ситуациям, когда зрительный фон перемещается с бóльшей скоростью, т.е. для животных, ведущих более активный образ жизни за счет более высоких скоростей собственных перемещений. Головастики чесночницы компенсировали более высокие скорости движения зрительного фона по сравнению со взрослыми животными (рис. 2). Нейронные структуры, формирующие оптокинетический рефлекс у всех позвоночных, изученных до настоящего времени, выявлены в добавочной зрительной системе (ядро базального оптического тракта) и в претектальных зрительных центрах, т.е. в стволовых отделах мозга, но у млекопитающих в систему стабилизации взора вовлечены и корковые структуры [8, 12, 13 ] .
Список литературы
Birukow G. // Z. Vgl. Physiol. 1937. V. 25. P. 92–142.
Chochran S.L., Dieringer N., Precht W. // J. Neurosci. 1984. V. 4. P. 43–57.
Dieringer N., Precht W. // Exp. Brain Res. 1982. V. 47. P. 394–406.
Sha Sun, Zhentao Zuo, Michelle Manxiu Ma, et al. // bioRxiv preprint 2019.
von Uckermann G., Le Ray D., Combes D., et al. // J Neurosci. 2013. V. 33. P. 4253–4264.
Gosner K.L. // Herpetologica. 1960. V. 16. P. 183–190.
Fite K.V. // Brain Behav. Evol. 1985. V. 26. P. 71–90.
Masseck O.A., Hoffmann K.P. // Ann N Y Acad Sci. 2009. V. 1164. P. 430–439.
Katte O., Hoffmann K.-P. // J. Comp. Physiol. 1980. V. 140. P. 53–57.
Chochran S.L., Dieringer N., Precht W. // J. Neurosci. 1984. V. 4. P. 43–57.
Lazar G. 1989. Altering the direction of optokinetic head nystagmus: a lesion study and a hypothetical model. Exp. Brain Res. 77: 193–200.
Bastakov V.A., Kiseleva E., Orlov O.Yu. // J. Integr. Neurosci. 2015. V. 14. P. 491–501.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


