Доклады Российской академии наук. Науки о жизни, 2022, T. 507, № 1, стр. 520-524
ЛИПОПРОТЕИДЫ ПЛАЗМЫ КРОВИ: ОКИСЛЯЕМОСТЬ И УЧАСТИЕ В ТРАНСПОРТЕ АЦИЛГИДРОПЕРОКСИ-ПРОИЗВОДНЫХ ФОСФОЛИПИДОВ
В. З. Ланкин 1, *, А. К. Тихазе 1, В. Я. Косач 1, А. Д. Дорощук 1
1 ФГБУ “Национальный медицинский исследовательский центр кардиологии им. акад. Е.И. Чазова” Минздрава РФ
Москва, Россия
* E-mail: lankin0309@mail.ru
Поступила в редакцию 08.07.2022
После доработки 31.08.2022
Принята к публикации 02.09.2022
- EDN: QXMIGC
- DOI: 10.31857/S2686738922060166
Аннотация
Окислительно модифицированные липопротеиды плазмы крови играют важную роль в молекулярных механизмах повреждения стенки сосудов при атеросклерозе и сахарном диабете. Установлено, что окисляемость липопротеидов низкой плотности (ЛНП) более чем на порядок выше окисляемости липопротеидов высокой плотности (ЛВП). Показано, что ацилгидроперокси-производные фосфолипидов окисленных биомембран преимущественно захватываются частицами ЛНП, но не ЛВП, что опровергает гипотезу об участии ЛВП в обратном транспорте липогидропероксидов (LOOH). Результаты работы свидетельствуют о возможности различных механизмов накопления LOOH в ЛНП: вследствие повышенной окисляемости ЛНП и вследствие эффективного трансмембранного переноса LOOH частицами ЛНП.
Нарушение транспорта липидов играет важную роль в механизме повреждения стенки сосудов при атеросклерозе и сахарном диабете [1]. Липид-транспортирующая система организма представлена двумя основными классами липид-белковых наноструктур плазмы крови – липопротеиды низкой плотности (ЛНП) и липопротеиды высокой плотности (ЛВП), которые существенно различаются по метаболическим функциям, а также по размеру и химическому составу частиц. Частицы ЛВП содержат апопротеины А1, С2 и Е, тогда как частицы меньших по размеру ЛНП содержат единственный белок – апоВ-100. Образующиеся в печени ЛНП транспортируют липиды в периферические ткани, а ЛВП осуществляют обратный транспорт липидов для их утилизации в печени. Апопротеин В-100 частиц ЛНП может подвергаться химической модификации с участием низкомолекулярных дикарбонилов, образующихся при свободнорадикальном окислении полиеновых липидов (таких как 4-гидроксиноненаль и малоновый диальдегид) и при ферментативном окислении или автоокислении глюкозы и других 6 атомных углеводов соответственно (таких как глиоксаль и метилглиоксаль) [1]. Частицы окислительно модифицированных ЛНП активно захватываются scavenger-рецепторами клеток сосудистой стенки, что сопровождается возникновением предатерогенных повреждений сосудов при атеросклерозе и диабете [2]. Кроме того показано, что частицы окисленных ЛНП могут образовывать комплекс с рецептором LOX-1 эндотелиоцитов, стимулируя запуск апоптоза, приводящий к дисфункции эндотелия [3]. Таким образом очевидно, что окислительные превращения липопротеидов могут играть ведущую роль в молекулярных механизмах развития атеросклероза и сахарного диабета [1, 4]. Тем не менее в литературе не существует общего мнения относительно сравнительной окисляемости частиц ЛНП и ЛВП [5–7], поскольку при сравнении скорости окисления обычно используют не только различные (зачастую некорректные) методы анализа, но и производят расчеты на количество белка, что при большой разнице в содержании апопротеинов в частицах ЛНП и ЛВП существенно искажает результаты и не позволяет сделать однозначных выводов. Было показано, что частицы ЛВП могут не только ингибировать окисление ЛНП при совместной инкубации этих частиц in vitro [8], но и осуществлять “антиоксидантный” эффект in vivo, подавляя окисление ЛНП в кровотоке [9, 10]. Кроме того, была высказана гипотеза о том, что частицы ЛНП способны аккумулировать окисленные фосфолипиды с надмолекулярных липид-белковых комплексов (липопротеидов и биомембран) и транспортировать их в печень для ферментативной детоксикации липопероксидов [10]. К сожалению, эта гипотеза не была подтверждена экспериментально с использованием адекватных подходов и методов, позволяющих получить неопровержимые результаты. Исходя из вышесказанного, в настоящей работе исследовали потенциальную способность частиц ЛНП и ЛВП к свободнорадикальному перекисному окислению, а также способность этих липопротеидов абсорбировать гидроперокси-производные фосфолипидов с поверхности окисленных биомембран.
Препаративное выделение ЛНП и ЛВП проводили методом ультрацентрифугирования в градиенте плотности NaBr на ультрацентрифуге Beckman Optima XPN-80 (США) с использованием ротора Ti-60 [11]. После диализа содержание белка в образцах липопротеидов определяли по методу Лоури, а затем пробы разбавляли до 50 мкг белка/мл раствором, содержащим 0.154 М NaCl в 50 мМ K,Na-фосфатном буфере рН 7.4 и окисление частиц ЛНП и ЛВП при 37°С индуцировали введением в среду инкубации 30 мкМ CuSO4, после чего через фиксированные интервалы времени измеряли накопление липогидропероксидов (LOOH) при 233 нм на спектрофотометре UV-2600 Shimadzu (Япония) [4]. Содержание липогидропероксидов (конъюгированные диены – ∆D233) в частицах ЛНП и ЛВП рассчитывали, используя коэффициент молярной экстинции 22 000 моль–1 см–1 для LOOH и исходя из содержания апопротеинов В-100 и А1, измеренных на анализаторе Abbott Architect C8000 (США) при использовании тест-наборов этой же фирмы.
Для выделения митохондрий печень крыс (самцы линии WKY, 250–300 г) перфузировали охлажденным изотоническим раствором KCl и гомогенизировали (1:10 вес/объем) в гомогенизаторе Поттера с тефлововым пестиком в 0.25 М растворе сахарозы, содержащем 10 мM МОРS и 1 мМ ЭДТА [12]. Ядра и дебрис осаждали при 700 g в течение 10 мин в рефрижераторной центрифуге Eppendorf 5804R (Германия) и супернатант подвергали повторному центрифугированию при 8000 g в течение 10 мин для осаждения “тяжелых” митохондрий. Осадок ресуспендировали в среде выделения без ЭДТА и дважды переосаждали митохондрии, после чего органеллы вновь ресуспендировали в изотоническом K,Na-фосфатном буфере рН 7.4 (1 мг белка/мл) и свободнорадикальное окисление полиеновых фосфолипидов митохондриальных мембран индуцировали внесением 0.5 мМ аскорбата для восстановления эндогенного железа. Кинетику свободнорадикального окисления митохондрий в аэробных условиях измеряли при 233 нм на спектрофотометре UV-2600 Shimadzu (Япония) c интегрирующей сферой ISR-2600, позволяющей проводить анализы в мутных средах. После 4-часовой инкубации (достижение плато на кинетической кривой) окисление митохондрий ингибировали внесением 1 мМ ЭДТА. Осадок окисленных митохондрий (8 мкмоль LOOH/мг белка) ресуспендировали в среде инкубации без аскорбата, содержащей 1 мМ ЭДТА, дважды переосаждали при 8000 g в течение 10 мин и осадок вновь ресуспендировали (1 мг белка/мл) в изотоническом K,Na-фосфатном буфере рН 7.4, содержащем 1 мМ ЭДТА. После этого в среду вносили ЛНП или ЛВП (200 мкг белка/мл) и проводили инкубацию в течение 6 ч. Через определенные интервалы времени отбирали аликвоты инкубационной среды, центрифугировали при 10 000 g в течение 10 мин для осаждения митохондрий и фрагментов их мембран, а затем в супернатанте, содержащем только частицы липопротеидов, измеряли поглощение конъюгированных диенов при 233 нм.
Результаты исследования сравнительной кинетики окисляемости частиц ЛНП и ЛВП представлены на рис. 1. Как видно из рис. 1, при расчете на 1 частицу скорость свободнорадикального окисления частиц ЛНП in vitro в идентичных условиях более чем на два порядка превышает скорость окисления частиц ЛВП.
Рис. 1.
Сравнительная кинетика свободнорадикального Cu2+-индуцируемого окисления ЛНП (кривая 1) и ЛВП (кривая 2) при расчете на одну частицу.

Из полученных данных следует, что частицы ЛНП и в условиях in vitro должны быть значительно более чувствительны к индукции свободнорадикального окисления в наружном фосфолипидном слое, чем частицы ЛВП. Следует отметить, что исходное содержание липогидропероксидов (ацилгидроперокси-производных фосфолипидов) в изолированных ЛНП составляло 4.2 ± ± 0.11 пикомоль × 10–11 LOOH на частицу, тогда как исходное содержание первичных продуктов свободнорадикального окисления в ЛВП составляло 0.20 ± 0.04 пикомоль × 10–11 LOOH на частицу. Таким образом, исходная окисленность частиц ЛНП in vivo также была на порядок выше окисленности частиц ЛВП. Из этого следует, что скорость свободнорадикального окисления в частицах ЛНП in vivo должна быть на порядок выше, чем скорость окисления в частицах ЛВП, поскольку при деструкции липогидропероксидов (LOOH) из них образуются алкоксильные свободные радикалы (LО•), способные инициировать дальнейшее свободнорадикальное окисление липидного субстрата по цепному механизму. Поскольку повышенная чувствительность частиц ЛНП к индукции в них свободнорадикального окисления (susceptibility to oxidation) определяется, преимущественно, особенностями структуры этих частиц, можно полагать, что и в условиях in vivo при инициации окисления активными формами кислорода (АФК) в процессе развития окислительного стресса частицы ЛНП будут подвергаться свободнорадикальному окислению в значительно большей степени, чем частицы ЛВП.
Результаты исследования возможности переноса ацилгидроперокси-производных фосфолипидов с окисленных биомембран на частицы ЛНП и ЛВП представлены на рис. 2.
Рис. 2.
Кинетика встраивания гидроперокси-производных фосфолипидов из подвергнутых свободнорадикальному окислению мембран митохондрий печени крысы в частицы ЛНП (кривая 1) и ЛВП (кривая 2). Условия эксперимента описаны при изложении методов исследования.
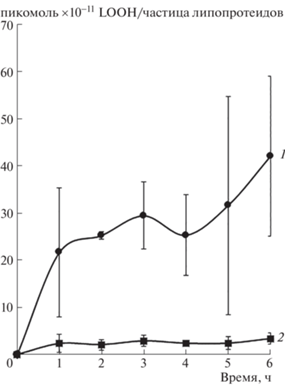
Полученные данные свидетельствуют о том, что нативные частицы ЛНП при совместной инкубации с окисленными митохондриями могут активно захватывать ацилгидроперокси-производные фосфолипидов, тогда как скорость дрейфа окисленных фосфолипидов с биомембран на частицы ЛВП весьма незначительна (рис. 2, кривые 1 и 2).Таким образом, высказанная ранее гипотеза о возможности обратного транспорта окисленных липидов частицами ЛВП в печень [10] в наших экспериментах подтверждения не получила. Следует отметить, что принципиальная возможность переноса ацилгидроперокси-производных фосфолипидов с окисленных мембран (“теней” эритроцитов) в ЛНП при совместной инкубации этих биоструктур была продемонстрирована ранее [13] и не представляется чем-то необычным. Важно другое – что именно частицы ЛНП способны не только легко подвергаться эффективному свободнорадикальному окислению, но и активно захватывать окисленные фосфолипиды с других липид-белковых надмолекулярных комплексов при взаимодействии с ними. Обогащенные гидроперокси-производными фосфолипидов частицы ЛНП подвергаются модификации вторичными продуктами деструкции липогидропероксидов – α, oxo-альдегидами, такими как окси- и гидроксиноненали и малоновый диальдегид [14], причем карбонильная модификация апопротеина В-100 частиц ЛНП, вероятно, играет ключевую роль в пусковых механизмах атерогенеза [1] и сахарного диабета [1, 3, 4]. Полученные нами данные свидетельствуют о существовании различных механизмов, приводящих к обогащению “атерогенных” частиц ЛНП первичными и, как следствие этого, вторичными продуктами свободнорадикального окисления, что в конечном итоге лишний раз подтверждает опасность патогенетически важной окислительной трансформации этих частиц in vivo [1–3], тогда как “антиоксидантная” функция ЛВП [15] остается не доказанной. Результаты наших исследований свидетельствуют о необходимости медикаментозных мероприятий, направленных на снижение окисленности частиц ЛНП для подавления молекулярных механизмов повреждения стенки сосудов при атеросклерозе и сахарном диабете.
Список литературы
Lankin V.Z., Tikhaze A.K. Role of Oxidative Stress in the Genesis of Atherosclerosis and Diabetes Mellitus: A Personal Look Back on 50 Years of Research // Curr Aging Sci 2017. V. 10. № 1. P. 18–25.
Lankin V.Z., Tikhaze A.K., Kumskova E.M. Macrophages actively accumulate malonyldialdehyde-modified but not enzymatically oxidized low density lipoprotein // Mol Cell Biochem 2012. V. 365. № 1–2. P. 93–98.
Sun Y., Chen X. Ox-LDL-induced LOX-1 expression in vascular smooth muscle cells: role of reactive oxygen species // Fundam Clin Pharmacol, 2011. V. 25. № 5. P. 572–579.
Lankin V.Z., Konovalova G.G., Tikhaze A.K., Shumaev K.B., Kumskova E.M., Viigimaa M. The Initiation of the Free Radical Peroxidation of Low-Density Lipoproteins by Glucose and Its Metabolite Methylglyoxal: a Common Molecular Mechanism of Vascular Wall Injure in Atherosclerosis and Diabetes // Mol. Cell. Biochem. 2014. V. 395. № 1/2. P. 241–252.
Raveh O., Pinchuk I., Fainaru M., Lichtenberg D. Kinetics of lipid peroxidation in mixtures of HDL and LDL, mutual effects. Free Radic Biol Med. 2001. V. 31. № 11. P. 1486–1497.
Fumiaki I., Tomoyuki I. High-Density Lipoprotein (HDL) Triglyceride and Oxidized HDL: New Lipid Biomarkers of Lipoprotein-Related Atherosclerotic Cardiovascular Disease. Antioxidants(Basel). 2020. V. 9. № 5. P. 362.
Bowry V.W., Stanley K.K., Stocker R. High density lipoprotein is the major carrier of lipid hydroperoxides in human blood plasma from fasting donors // Proc Natl Acad Sci USA 1992. V. 89. № 21. P. 10316–10320.
Klimov A.N., Kozhemyakin L.A., Pleskov V.M., Andreeva L.I. Antioxidative effect of high density lipoproteins in the oxidation of low density lipoproteins // Bull Exptl. Biol. Med. 1987. V. 103. P. 550–556.
Klimov A.N., Gurevich V.S., Nikiforova A.A., Shatilina L.V., Kuzmin A.A., Plavinsky S.L., Teryukova N.P. Antioxidative activity of high density lipoproteins in vivo // Atherosclerosis 1993. V. 100. № 1. P. 13–18.
Klimov A.N., Nikiforova A.A., Kuzmin A.A., Kuznetsov A.S., Mackness M.I. Is high density lipoprotein a scavenger for oxidized phospholipids of low density lipoprotein? Advances in Lipoprotein and Atherosclerosis Research, Diagnostics and Treatment. Jena: Gustav Fisher Verlag; 1998, P. 78–82.
Lindgren F.T. Preparative ultracentrifugal laboratory procedures and suggestions for lipoprotein analysis. In: Analysis of lipids and lipoproteins, Ed. Perkins E.G., Champaign: Amer. Oil. Chemists Soc., 1975, P. 204–224.
Saporito-Magrina C., Musacco-Sebio R., Acosta J.M., Bajicoff S., Paredes-Fleitas P., Boveris A., Repetto M.G. Rat liver mitochondrial dysfunction by addition of copper (II) or iron (III) ions // J Inorganic Biochem 2017 V. 166. № 1. P. 5–11.
Vila A., Korytowski W., Girotti A.W. Spontaneous transfer of phospholipid and cholesterol hydroperoxides between cell membranes and low-density lipoprotein: assessment of reaction kinetics and prooxidant effects // Biochemistry 2002. V. 41. № 46. P. 13705–13716.
Amarnath V., Amarnath K. Scavenging 4-Oxo-2-nonenal // Chem Res Toxicol 2015.V. 28. № 10. P. 1888–1890.
Mackness B., Mackness M. The antioxidant properties of high-density lipoproteins in atherosclerosis // Panminerva Med 2012. V. 54. № 2. P. 83–90.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


