Доклады Российской академии наук. Науки о жизни, 2022, T. 507, № 1, стр. 515-519
ВЗАИМОСВЯЗЬ ГЕНОТИПА ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ КЛАССА I С ЛЕТАЛЬНОСТЬЮ COVID-19 У ПАЦИЕНТОВ С САХАРНЫМ ДИАБЕТОМ
М. Ю. Шкурников 1, 2, *, Д. А. Аверинская 1, А. Г. Комаров 3, И. А. Карбышев 3, Г. И. Спешилов 3, И. А. Штинова 3, Д. А. Дорошенко 4, В. И. Вечорко 4, академик РАН О. М. Драпкина 5
1 НИУ Высшая школа экономики, Факультет биологии
и биотехнологии
Москва, Россия
2 Институт биоорганической химии им. академиков
М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук
Москва, Россия
3 ГБУЗ “Диагностический центр (Центр лабораторных исследований) Департамента здравоохранения города Москвы”
Москва, Россия
4 ГБУЗ “Городская клиническая больница № 15
им. О.М. Филатова” Департамента
здравоохранения г. Москвы
Москва, Россия
5 ФГБУ “Национальный медицинский исследовательский центр терапии и профилактической медицины” Министерства здравоохранения Российской Федерации
г. Москва, Россия
* E-mail: mshkurnikov@hse.ru
Поступила в редакцию 11.08.2022
После доработки 31.08.2022
Принята к публикации 02.09.2022
- EDN: ZDDLDM
- DOI: 10.31857/S2686738922060324
Аннотация
В многочисленных исследованиях было показано, что сахарный диабет (СД) повышает риск летального исхода COVID-19 в пять раз. Принято считать, что высокая летальность COVID-19 на фоне СД обусловлена основными осложнениями данного заболевания: микро- и макроангиопатиями, сердечной и почечной недостаточностью. Кроме того, показано, что острая респираторная вирусная инфекция увеличивает выработку интерферона гамма и повышает резистентность мышц к инсулину, модулирует активность эффекторных CD8+ Т-лимфоцитов. Способность CD8+ Т-лимфоцитов распознавать зараженные SARS-CoV-2 клетки зависит не только от гуморальных факторов, но и от индивидуальных генетических особенностей, в том числе индивидуального набора молекул главного комплекса гистосовместимости класса I (ГКГС-I). В данном исследовании на выборке из 222 пациентов была изучена взаимосвязь генотипа ГКГС-I пациентов с СД в возрасте не старше 60 лет с исходом COVID-19. Показано, что летальные исходы COVID-19 у пациентов с СД связаны с низкой аффинностью взаимодействия индивидуального набора молекул ГКГС-I с пептидами SARS-CoV-2.
ВВЕДЕНИЕ
В многочисленных исследованиях было показано, что сахарный диабет (СД) повышает риск летального исхода COVID-19 в пять раз [1, 2]. Принято считать, что высокая летальность от COVID-19 на фоне СД обусловлена основными осложнениями данного заболевания: микро- и макроангиопатиями, сердечной и почечной недостаточностью. Кроме того, показано, что острая респираторная вирусная инфекция увеличивает выработку интерферона гамма и повышает резистентность мышц к инсулину, что осложняет течение СД. Резистентность к инсулину, в свою очередь, приводит к компенсаторной гиперинсулинемии для поддержания нормального уровня глюкозы. Следует отметить, что гиперинсулинемия может повышать противовирусный иммунитет за счет прямой стимуляции функциональной активности CD8+ эффекторных Т-клеток [3].
Эффекторные CD8+ Т-лимфоциты играют ключевую роль в противовирусном иммунитете на начальных этапах COVID-19 [4]. Молекулы главного комплекса гистосовместимости (ГКГС) класса I определяют эффективность презентации антигенов COVID-19. Сразу после попадания в клетку SARS-CoV-2 индуцирует трансляцию своих белков. Часть из них попадает в протеасомы инфицированной клетки, расщепляется до пептидов длиной 8–12 аминокислотных остатков и связывается с молекулами ГКГС класса I. После связывания комплекс, состоящий из молекулы ГКГС класса I и вирусного пептида, переносится из комплекса Гольджи на поверхность клетки, где он может быть распознан Т-клеточным рецептором CD8+ эффекторного Т-лимфоцита. В ответ на взаимодействие CD8+ Т-лимфоцит активируется и разрушает инфицированную клетку с помощью перфоринов и сериновых протеаз [5].
Молекулы ГКГС класса I кодируются генами HLA-A, HLA-B и HLA-C, каждый из которых может быть представлен в двух вариантах (аллелях). В популяции существуют десятки вариантов каждого аллеля, кодирующих молекулы ГКГС-I с индивидуальной способностью взаимодействовать с чужеродными пептидами. Индивидуальные комбинации молекул ГКГС-I существенно влияют на тяжесть многих инфекционных заболеваний [6].
Ранее нами было показано, что генотип HLA-I является значимым фактором риска тяжелого течения COVID-19 только у пациентов в возрасте не старше 60 лет [6]. Целью данного исследования была оценка вклада HLA-I генотипа у пациентов с СД в возрасте не старше 60 лет в исход COVID-19.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 36 пациентов с сахарным диабетом 1 и 2 типа (коды МКБ Е10 и Е11), переболевшие COVID-19. В качестве группы сравнения была подобрана сопоставимая по возрасту группа из 186 пациентов, переболевших COVID-19 без сахарного диабета в анамнезе. Протокол исследования был одобрен этическим комитетом ГБУЗ ГКБ № 15 им. О.М. Филатова ДЗМ. Все пациенты подписали информированное согласие.
Оценка уровня D-димера осуществлялась на коагулометре ACL TOP 700 (IL Werfen, США) с помощью набора реагентов D-Dimer HS 500 (№ 0020500100). Уровень С-реактивного белка (СРБ) определялся с помощью набора реагентов CRP_2 (№ 06522059) на биохимическом анализаторе ADVIA 1800 (Siemens, ФРГ).
Геномную ДНК выделяли из замороженных образцов цельной крови с использованием набора реагентов ПРОБА-ГС-ГЕНЕТИКА (ООО “НПО ДНК-Технология”, Россия). Библиотеки для секвенирования 2 и 3 экзоны генов HLA-A, HLA-B и HLA-C готовили с помощью набора реагентов HLA-Эксперт (ООО “ДНК-Технологии”, Москва, Россия). Секвенирование осуществляли с помощью платформы MiSeq (Illumina, Сан-Диего, Калифорния, США) в режиме парноконцевого чтения по 250 нуклеотидов с использованием набора реагентов набора реагентов MiSeq 600 cycles v3. Аннотирование результатов секвенирования осуществлялось с использованием базы данных последовательностей основного комплекса гистосовместимости человека IMGT/HLA v3.41.0 [7].
Оценку отклонения распределений частот генотипов от канонического распределения Харди-Вайнберга проводили с помощью критерия Хи-квадрат, оценку степени различий по частоте аллелей между исследуемыми группами проводили с помощью точного критерия Фишера. Сравнение значимости различий в уровне D-димера и СРБ проводили с использованием критерия Вилкоксона. Статистический анализ результатов осуществлялся в среде R.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Была сформирована выборка из 222 пациентов, переболевших COVID-19, выполнено HLA-генотипирование и проведен анализ данных уровня D-димера и С-реактивного белка. Характеристика пациентов представлена в табл. 1. Группы сравнения значимо различались по исходу заболевания. Так, в группе пациентов с СД было отмечено 8 летальных исходов против 18 в группе сравнения (отношение шансов (ОШ) – 2.65, р = 0.4, 95% доверительный интервал (ДИ) 0.9–7.2). Подобная частота летальных исходов в два раза превосходит полученные ранее результаты для сопоставимой по возрасту выборки пациентов с СД [8]. Более высокая летальность может быть связана с тем, что в наше исследование вошли пациенты со среднетяжелым и тяжелым течением COVID-19. Необходимо отметить высокую частоту встречаемости ожирения (ОШ – 9.1, ДИ 3.8–22.3, р = 7.4e-08) и гипертонической болезни (ОШ – 5.1, ДИ 2.3–12.1, р = 1.6e-05) в группе пациентов с СД.
Таблица 1.
Характеристика выборки пациентов с COVID-19
| Показатель | Пациенты с СД | Пациенты без СД | p |
|---|---|---|---|
| n | 36 | 186 | |
| Возраст, медиана [25%–75%] | 50.5 [44–58] | 47.5 [44–51] | 0.07 |
| Пол (муж./жен.) | 23/13 | 106/80 | 0.47 |
| Тяжесть | 0.68 | ||
| Средняя | 26 | 141 | |
| Тяжелая | 10 | 45 | |
| Исход | 0.04 | ||
| Летальный | 8 | 18 | |
| Выписан | 28 | 168 | |
| Ожирение | 19 | 20 | 7.4e-08 |
| Сердечно-сосудистые заболевания | 8 | 19 | 0.053 |
| Гипертония | 24 | 52 | 1.6e-05 |
| Заболевания органов дыхания | 4 | 10 | 0.25 |
| Онкологические заболевания в стадии ремиссии | 2 | 8 | 0.67 |
Таблица 2.
Характеристика частот аллелей ГКГС-I в выборке пациентов с COVID-19
| Аллель | Частота аллели в группе | p | ОШ | |
|---|---|---|---|---|
| без СД | СД | |||
| HLA–A*02:01 | 0.26 | 0.38 | 0.1 | 1.86 |
| HLA–A*01:01 | 0.14 | 0.07 | 0.2 | 0.48 |
| HLA–C*04:01 | 0.14 | 0.15 | 0.84 | 1.14 |
| HLA–A*03:01 | 0.13 | 0.17 | 0.41 | 1.38 |
| HLA–C*07:02 | 0.13 | 0.09 | 0.51 | 0.65 |
| HLA–C*07:01 | 0.11 | 0.17 | 0.27 | 1.65 |
| HLA–C*12:03 | 0.11 | 0.12 | 0.83 | 1.08 |
| HLA–C*06:02 | 0.1 | 0.07 | 0.64 | 0.72 |
| HLA–A*11:01 | 0.09 | 0.04 | 0.22 | 0.44 |
| HLA–B*07:02 | 0.09 | 0.09 | 1 | 0.93 |
Анализ уровня СРБ показал, что его концентрация в плазме крови во время COVID-19 значимо выше у пациентов с СД (рис. 1а). Так, у пациентов без СД максимальный уровень СРБ составлял 60 (8–117) мг/л против 123 (62–170) мг/л у пациентов с СД (р < 0.01). СРБ преимущественно вырабатывается гепатоцитами в ответ на воздействие провоспалительных цитокинов, прежде всего интерлейкинов 6 и 1 [9, 10]. Принято считать, что высокий уровень СРБ характерен для бактериальных инфекций, так как он способен связываться с полисахаридами бактериальной стенки и инициировать комплекс комплимента через C1q [11]. При COVID-19 СРБ может не только подавлять сопутствующую бактериальную инфекцию, но и активизировать Т-клеточный иммунитет. Связываясь с фосфатидилхолином на поверхности апоптозных альвеоцитов, СРБ усиливает классический путь активации комплемента, что облегчает их поглощение макрофагами, имеющими рецепторы для комплемента CR3 и CR4 [12].
Рис. 1.
Панель а – максимальная концентрация СРБ в группах сравнения. Панель б – максимальная концентрация D-димера в группах сравнения.
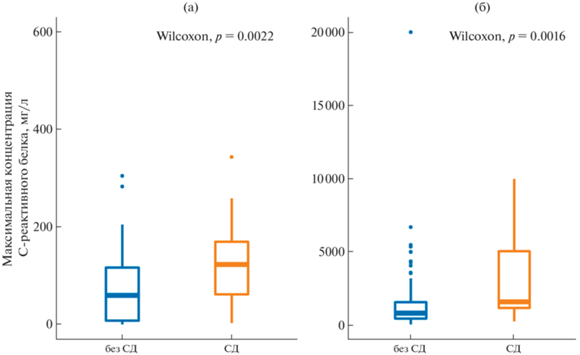
В группе пациентов с СД также был отмечен повышенный уровень D-димера (рис. 1б). У пациентов без СД максимальный уровень D-димера составлял 830 (453–1578) нг/мл при максимальных значениях у пациентов с СД 1591 (1182–5014) нг/мл (р < 0.01). D-димер – продукт распада фибрина. Его высокий уровень при COVID-19 ассоциирован с микротромбозом капилляров и обструкцией легочных сосудов [13]. В то же время показано, что уровень D-димера не является независимым фактором риска для пациентов в возрасте до 70 лет [14].
HLA-генотипирование пациентов показало, что наиболее частыми аллелями в группе пациентов без СД были HLA-A*02:01 (частота 0.26) и HLA-A*01:01 (частота 0.14), что характерно для популяции московского региона [6]. Малый объем выборки не позволил выявить взаимосвязи отдельных аллелей HLA-I с СД (табл. 2). Тем не менее был оценен индекс риска тяжелого течения COVID-19 [6], отражающий интегральную способность индивидуального набора молекул ГКГС-I презентировать пептиды SARS-CoV-2 (рис. 2). Различия в индексе риска между пациентами без СД оказались недостоверными (p = 0.69). Однако в группе пациентов с СД индекс риска значимо различался между выздоровевшими пациентами и пациентами с летальным исходом (p = 0.011). При пороговом уровне индекса риска 53 чувствительность прогноза летального исхода составила 100%, а специфичность – 39.3% (AUC = 0.8). В группе пациентов с СД и индексом риска более 53 было отмечено 7 летальных исходов против 1 в группе с индексом риска менее 53 (ОШ – 10.2, р = 0.4, 95% ДИ 1.1–514). Данные результаты могут свидетельствовать о существенном вкладе способности ГКГС-I презентировать пептиды вируса SARS-CoV-2 в тяжесть течения COVID-19 у пациентов с СД.
ЗАКЛЮЧЕНИЕ
1. Анализ уровня СРБ и D-димера подтверждает данные о более сильной воспалительной реакции и микротромбозе у пациентов с СД по сравнению с пациентами с нормальным гликемическим контролем.
2. Летальные исходы COVID-19 у пациентов с СД связаны с низкой аффинностью взаимодействия индивидуального набора молекул ГКГС-I с пептидами SARS-CoV-2.
3. Настоящее исследование демонстрирует дополнительные возможности в оценке риска тяжести течения COVID-19 у пациентов с СД.
Список литературы
Shafiee A., Teymouri Athar M.M., Nassar M., et al. Comparison of COVID-19 outcomes in patients with Type 1 and Type 2 diabetes: A systematic review and meta-analysis // Diabetes & Metabolic Syndrome: Clinical Research & Reviews. 2022. V. 16. № 6. P. 102512.
Yang J.K., Feng Y., Yuan M.Y., et al. Plasma glucose levels and diabetes are independent predictors for mortality and morbidity in patients with SARS. // Diabet Med. 2006. V. 23. № 6. P. 623–628.
Šestan M., Marinović S., Kavazović I., et al. Virus-Induced Interferon-γ Causes Insulin Resistance in Skeletal Muscle and Derails Glycemic Control in Obesity // Immunity. 2018. V. 49. № 1. P. 164–177.e6.
Kusnadi A., Ramírez-Suástegui C., Fajardo V., et al. Severely ill COVID-19 patients display impaired exhaustion features in SARS-CoV-2-reactive CD8+ T cells. // Sci Immunol. 2021. V. 6. № 55.
Wherry E.J., Ahmed R. Memory CD8 T-cell differentiation during viral infection. // J Virol. American Society for Microbiology (ASM), 2004. V. 78. № 11. P. 5535–5545.
Shkurnikov M., Nersisyan S., Jankevic T., et al. Association of HLA Class I Genotypes With Severity of Coronavirus Disease-19 // Front Immunol. Frontiers, 2021. V. 12. P. 641900.
Robinson J., Barker D.J., Georgiou X., et al. IPD-IMGT/HLA Database // Nucleic Acids Res. 2020. V. 48. № D1. P. D948–D955.
Shestakova M.V., Vikulova O.K., Isakov M.A., et al. Diabetes and COVID-19: analysis of the clinical outcomes according to the data of the russian diabetes registry // Problems of Endocrinology. 2020. V. 66. № 1. P. 35–46.
du Clos T.W., Mold C. C-Reactive Protein: An Activator of Innate Immunity and a Modulator of Adaptive Immunity // Immunol Res. 2004. V. 30. № 3. P. 261–278.
Szalai A.J., van Ginkel F.W., Dalrymple S.A., et al. Testosterone and IL-6 requirements for human C-reactive protein gene expression in transgenic mice. // J Immunol. 1998. V. 160. № 11. P. 5294–5299.
Volanakis J. Human C-reactive protein: expression, structure, and function // Mol Immunol. 2001. V. 38. № 2–3. P. 189–197.
Pittoni V., Valesini G. The clearance of apoptotic cells: implications for autoimmunity. // Autoimmun Rev. 2002. V. 1. № 3. P. 154–161.
Goudot G., Chocron R., Augy J.-L., et al. Predictive Factor for COVID-19 Worsening: Insights for High-Sensitivity Troponin and D-Dimer and Correlation With Right Ventricular Afterload // Front Med (Lausanne). 2020. V. 7.
Chocron R., Duceau B., Gendron N., et al. D-dimer at hospital admission for COVID-19 are associated with in-hospital mortality, independent of venous thromboembolism: Insights from a French multicenter cohort study // Arch Cardiovasc Dis. 2021. V. 114. № 5. P. 381–393.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни



