Доклады Российской академии наук. Науки о жизни, 2022, T. 507, № 1, стр. 465-474
ОЦЕНКА ПРИНАДЛЕЖНОСТИ МАЛОНОВОГО ДИАЛЬДЕГИДА К МОДУЛЯТОРАМ И СУБСТРАТАМ БЕЛКА-ТРАНСПОРТЕРА Р-ГЛИКОПРОТЕИНА
А. В. Щулькин 1, Ю. В. Абаленихина 1, *, П. Ю. Мыльников 1, И. В. Черных 1, Е. Н. Якушева 1
1 Рязанский государственный медицинский университет им. академика И.П. Павлова
Рязань, Россия
* E-mail: abalenihina88@mail.ru
Поступила в редакцию 01.07.2022
После доработки 15.07.2022
Принята к публикации 18.07.2022
- EDN: JTGQMJ
- DOI: 10.31857/S2686738922060300
Аннотация
В исследовании на клетках линии Сасо-2 проведена оценка принадлежности малонового диальдегида (МДА) к модуляторам и субстратам Р-гликопротеина (Pgp), а также изучена биологическая роль Pgp в условиях окислительного стресса (ОС). МДА использовали в концентрациях 10, 50, 100 и 150 мкМ, ОС моделировали добавлением пероксида водорода (Н2О2) в концентрациях 0.1–100 мкМ в течение 24 ч. Относительное количество Pgp оценивали методом вестерн-блот, активность – по транспорту его субстрата фексофенадина (метод ВЭЖХ с УФ-детектированием), количество МДА (ВЭЖХ МС/МС). В ходе исследования было показано, что МДА в концентрациях 10 и 50 мкМ и длительности экспозиции 24 ч повышает относительное количество и активность Pgp, действуя через CAR и PXR, при этом МДА может транспортироваться Pgp. Индукция Pgp под действием МДА при развитии ОС возможно, имеет иметь защитное значение, обеспечивая выведение продукта пероксидации из клеток во внеклеточное пространство, тем самым увеличивая жизнеспособность клеток.
ВВЕДЕНИЕ
Р-гликопротеин (Pgp, ABCB1, MDR1-белок) – эффлюксный белок-транспортер суперсемейства АВС-транспортеров, обеспечивающий выведение субстратов из клеток во внеклеточное пространство и биологические жидкости [1].
Впервые Pgp был выделен R.L. Juliano и V. Ling в 1976 г. из цитоплазматической мембраны клеток яичника китайского хомячка, отобранных по устойчивости к колхицину и демонстрирующих перекрестную резистентность к широкому спектру амфифильных веществ [2].
Белок был назван P-гликопротеином от слова permeability (от англ. проницаемость), потому что считалось, что он участвует в развитии лекарственной устойчивости, снижая проницаемость клеточной мембраны для химиопрепаратов [3].
В дальнейшем A.T. Fojo et al. (1987) показали, что ген, кодирующий Pgp – MDR1, у людей в больших количествах экспрессируется в надпочечниках и почках, на среднем уровне – в легких, печени, тощей кишке, ободочной и прямой кишке (образцы получены парацентезом) [4].
F. Thiebaut et al. (1987) на тканях человека, полученных при аутопсии или хирургических операциях, иммуногистохимически изучили локализацию Pgp. Ими было показано, что в печени Pgp локализуется преимущественно на билиарной поверхности гепатоцитов и на апикальной поверхности эпителиальных клеток в маленьких билиарных протоках. В поджелудочной железе Pgp был обнаружен на апикальной поверхности эпителиальных клеток маленьких, но не больших протоков. В почках – на апикальной поверхности эпителиальных клеток проксимальных почечных канальцев. Ободочная и тощая кишки показали высокий уровень Pgp на апикальной поверхности эпителиальных клеток. Надпочечники характеризовались высоким уровнем Pgp на поверхности клеток в мозговом и корковом веществе [5]. В 1994 г. A.H. Schinkel et al. выявили экспрессию mdr1a в капиллярах эндотелиальных клеток в гематоэнцефалическом барьере [6].
Учитывая указанную локализацию, в настоящее время считается, что Pgp выполняет следующие функции: на апикальной поверхности энтероцитов тонкого и толстого кишечника – препятствует всасыванию субстратов из просвета кишечника; на билиарной поверхности гепатоцитов – выводит эндо- и ксенобиотики в желчь; на апикальной поверхности эпителия почечных канальцев – выводит эндо- и ксенобиотики в просвет почечных канальцев; в эндотелиальных клетках гистогематических барьеров (гематоэнцефалического, гематоплацентарного, гематотестикулярного) – препятствует проникновению эндо- и ксенобиотиков в забарьерные органы; в опухолевых клетках – защищает их от воздействия цитостатиков за счет выведения из клеток [7].
В ряде исследований было показано, что развитие окислительного стресса (ОС) приводит к повышению количества и активности Pgp, а также экспрессии его гена [8].
Однако механизм индукции и ее значение на данный момент не известны. Можно предположить, что накапливающиеся при ОС продукты пероксидации стимулируют экспрессию гена MRD1, кодирующего Pgp, через рецепторы ксенобиотиков (CAR и PXR), а сам Pgp выполняет защитную роль, выводя их из клеток во внеклеточное пространство и, таким образом, снижая их токсическое действие. На проверку данной гипотезы и направлено настоящее исследование.
МАТЕРИАЛЫ И МЕТОДЫ
Культивирование клеток. Исследование выполнено на линии клеток аденокарциномы ободочной кишки человека (Caco-2) (ЦКП “Коллекция культур клеток позвоночных”, Санкт-Петербург, Россия). Клетки культивировали при 37°С и 5% содержании СО2 в инкубаторе WS-189C (“World Science”, Корея) в модифицированной по способу Дульбекко среде Игла (DMEM) с высоким содержанием глюкозы (4500 мг/л), с добавлением L-глутамина (4 мМ), 15% эмбриональной бычьей сыворотки, 100 ед./мл и 100 мкг/мл пенициллина и стрептомицина (все составляющие производства “Sigma-Aldrich” Германия) соответственно. Клетки культивировали в течение 21 сут, поскольку при данном сроке происходит их спонтанная дифференцировка в энтероцитоподобные клетки, гиперэкспрессирующие Pgp [9].
Оценка цитотоксического действия МДА выполнялась в ходе МТТ-теста. Для этого клетки культивировали в 96-луночном планшете. МДА (“Sigma-Aldrich”, Германия) добавляли в питательную среду до получения конечных концентраций 10, 50, 100 и 150 мкМ и инкубировали в течение 24 ч. На каждый эксперимент было выполнено по 3 повторения. После завершения инкубации в каждую лунку 96 луночного планшета добавляли по 20 мкл 0.5% раствора бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил тетразолия (МТТ) и инкубировали в течение 2 ч, затем раствор МТТ удаляли и добавляли 200 мкл 1% раствора диметилсульфоксида (“ПанЭко”, Россия). Поглощение измеряли через 10 мин при 530 нм на спектрофотометре для планшетов Stat Fax 2100 (“Awareness Technology”, США).
Жизнеспособность клеток Сасо-2 в присутствии МДА рассчитывали по формуле:
Оценка влияния МДА на уровень Pgp в клетках линии Caco-2 осуществлялась при их культивировании в 6-луночных планшетах в течение 21 сут. Затем к клеткам добавляли МДА до получения конечной концентрации 10, 50, 100 и 150 мкМ и инкубировали в течение 24 ч (n = 3 для каждой концентрации). К контрольным клеткам в эквивалентном объеме прибавляли воду для инъекций (растворитель МДА).
При оценке механизма индукции Pgp под действием МДА в питательную среду за 30 мин до добавления МДА вносили: ингибитор прегнан Х рецептора (PXR) – кетоконазол, 10 мкМ (“Sigma Aldrich”, Германия) [10], ингибитор конститутивного андростанового рецептора (CAR) – 5-[(Диэтиламино)ацетил]-10,11-дигидро-5Н-дибензо[b,f]азепин-3-ил]этиловый эфир карбаминовой кислоты (CINPA 1, “TOCRIS”, Великобритания) в концентрации 10 мкМ [11].
После окончания экспозиции с МДА клетки снимали с лунок 6-луночных планшетов раствором трипсин-ЭДТА (0.25% трипсина и 0.2% ЭДТА, “Sigma-Aldrich”, Германия), трижды промывали раствором фосфатного буфера (“BioRad”, США) и лизировали в NP40 Cell Lysis Buffer Thermo (“Thermo Fisher Scientific”, США) c добавлением смеси ингибиторов протеиназ (4-(2 аминоэтилбензенсульфонил флуорида гидрохлорид (AEBSF) 2 мМ, апротинин 0.3 мкМ, бестатин 130 мкМ, ЭДТА 1мМ, транс-эпоксисукцинил-L-лейциламидо(4-гуанидино)бутан (Е-64) 14 мкМ, лейпептин 1 мкМ, “Sigma-Aldrich”, Германия) в течение 30 мин при +4°С и постоянном перемешивании из расчета 107 клеток на 100 мкл буфера. Полученный лизат центрифугировали при 5000 g (CM-50, “Eppendorf”, Германия). Супернатант использовали для выполнения биохимических анализов.
Количество белка в пробах анализировали методом Бредфорда (Pierce Coomassie Plus (Bradford) Assay Kit, “ThermoFisher”, США).
Определение относительного количества Pgp в клетках линии Сасо-2 проводили методом вестерн-блот. 20 мкг белков супернатанта подвергали электрофорезу с использованием 7.5% TGX Stain-Free FastCast Acrylamide Kit (“Bio-Rad”, США) в буферной системе Laemmli (“BioRad”, США). Образцы смешивали с буфером Laemmli (“Bio-Rad”, США), содержащим 50 мМ β-меркаптоэтанола (“Helicon”, США) в соотношении 1 : 3, инкубировали 10 мин при температуре 70°C. Гели прогоняли при 100 В в течение 90 мин.
Белки переносили на нитроцеллюлозную мембрану (Trans-Blot Turbo Mini-Size nitrocellulose, “Bio-Rad”, США) с использованием Mini Trans-Blot (“Bio-Rad”, США) в течение 10 мин при 25 В и 1.3 А.
Белки на мембране блокировали 1% раствором Casein Blocker (“Bio-Rad”, США), содержащим 0.1% Tween-20 (“Sigma”, Германия), при инкубации в течение 1 ч и комнатной температуре.
Детекцию белка Pgp проводили с использованием первичных мышиных моноклональных антител (P-Glycoprotein Antibody MA5-13854, “Invitrogen”, США) в концентрации 1: 200 в блокирующем растворе Cassein bloker (“Bio-Rad”, США) в течение 2 ч при 37°C. Визуализацию первичных антител осуществляли с использованием вторичных кроличьих антител (Rabbit-anti-Mouse IgG (H+L) Secondary Antibody, HRP, “Invitrogen”, США) в разведении 1:4000 и инкубацией в течение 1 ч при комнатной температуре. Хемилюминесценцию фиксировали с помощью ChemiDocXRS+ (“Bio-Rad”, США). Интенсивность полученных полос (бэндов) анализировали денситометрически с помощью программного обеспечения ImageLab (“Bio-Rad”, США).
Молекулярная масса Pgp была подтверждена путем сравнения с маркерами молекулярной массы (Precision plus protein standards Dual Color, “Bio-Rad”, США).
Содержание Pgp оценивали относительно содержания белка домашнего хозяйства GAPDH (первичные антитела GAPDH Loading Control Monoclonal Antibody (GA1R), DyLight 68 (“Invitrogen”, США), разведение 1:1000, вторичные антитела – вторичные кроличьи антитела к первичным антителам GAPDH – Rabbit-anti-Mouse IgG (H+L) Secondary Antibody, HRP (“Invitrogen”, США), разведение 1:4000).
Исследование влияния МДА на активности Pgp в клетках линии Caco-2. Клетки высеивали в специальные трансвеллы, состоящие из двух камер апикальной и базолатеральной (рис. 1). Дно апикальной камеры представлено полупроницаемой мембраной, на которую высеивали клетки линии Caco-2 с плотностью 105/см2 и культивировали в течение 21 сут.
Рис. 1.
Структура трансвелл-системы. Трансвелл-система представлена двумя камерами: апикальной и базолатеральной. Дно апикальной камеры является полупроницаемой мембраной, на которую высеивали клетки линии Caco-2 с плотностью 105/см2.

Целостность клеточного монослоя оценивали по величине трансэпителиального сопротивления. При его значении выше 500 мОм см2 выполняли транспортные эксперименты. Для этого в лунки трансвеллов добавляли питательную среду с МДА в концентрациях 10, 50 и 100 мкМ. В контрольные лунки добавляли дистиллированную воду – растворитель МДА. Длительность инкубации составила 30 мин (оценка прямого влияния МДА на молекулу Pgp) или 24 ч (оценка влияния МДА на количество Pgp).
После окончания инкубации питательную среду заменяли на транспортную среду, представляющую собой раствор Хэнкса (“Sigma-Aldrich”, Германия) с 25 мМ Хепес (“Sigma-Aldrich”, Германия) и 1% диметилсульфоксида (“ПанЭко”, Россия), а также содержащую соответствующую концентрацию МДА.
Затем добавляли субстрат Pgp – фексофенадин (“Sigma-Aldrich”, Германия) в апикальную камеру в конечной концентрации 150 мкМ. Через 1, 2 и 3 ч забирали образцы из базолатеральной камеры-реципиента для определения концентрации субстрата (a–b транспорт, обусловленный пассивной диффузией против функционирования Pgp).
В аналогичных трансвеллах оценивали транспорт фексофенадина из базолатеральной камеры в апикальную (b–a транспорт, обусловленный пассивной диффузией и функционированием Pgp). Для этого субстрат в той же концентрации добавляли в базолатеральную камеру, а затем через 1, 2 и 3 ч забирали образцы из апикальной камеры для определения концентрации фексофенадина.
Транспорт субстрата (фексофенадина) рассчитывали по формуле:
где Рарр – коэффициент кажущейся проницаемости (apparent permeability coefficient, см/сек), dQ/dt – изменение концентрации субстрата в камере реципиенте за время инкубации (мкМ/сек), A – площадь полупроницаемой мембраны лунки в трансвелл-системе (см2), C0 – начальная концентрация субстрата в камере-доноре (мкМ).Затем рассчитывали отношение коэффициентов кажущейся проницаемости: b–a к a–b, характеризующее общий вклад Pgp в транспорт фексофенадина через билипидную мембрану.
Определение концентрации фексофенадина. Концентрации фексофенадина в транспортной среде определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с УФ-детектированием при длине волны 220 нм. Исследование выполнялось на ВЭЖХ хроматографе “Стайер” (Россия) по оригинальной методике. Полученная проба транспортной среды (50 мкл), содержащая фексофенадин, разводилась в 150 мкл подвижной фазы, и 100 мкл полученного раствора вводились в хроматограф.
При анализе использовалась хроматографическая колонка Phenomenex Synergi 4u Polar-RP 80A (250 × 4.6) (США) с зернением 4 мкм. Температура разделения – 45°С. Скорость потока – 1 мл/мин. Состав подвижной фазы: 128 мл ацетонитрила (“PanReac AppliChem”, Испания), 267.4 мл воды деионизированной, 6.33 мл кислоты уксусной ледяной (“PanReac AppliChem”, Испания), с добавлением триэтиламина (“PanReac AppliChem”, Испания) до pH = 6.7. Время удерживания фексофенадина в данных условиях составляло 12.8 мин. Количественное определение проводилось методом абсолютной калибровки по площади пиков. Аналитический диапазон методики составлял 1.2–57.4 мкМ.
Тестирование принадлежности малонового диальдегида (МДА) к субстратам Pgp также выполнялось в трансвеллах.
Через 21 сут культивирования клеток линии Caco-2 питательную среду заменяли на транспортную среду с добавлением МДА (“Sigma-Aldrich”, Германия) в апикальную камеру в конечной концентрации 1, 50, 100 мкМ. Через 1, 2 и 3 ч забирали образцы из базолатеральной камеры-реципиента для определения концентрации тестируемого вещества (a–b транспорт, обусловленный пассивной диффузией против функционирования Pgp).
Затем аналогичным образом оценивали транспорт МДА из базолатеральной камеры в апикальную (b–a транспорт, обусловленный пассивной диффузией и функционированием Pgp).
Рассчитывали коэффициент кажущейся проницаемости МДА Papp a–b, Papp b–a и их отношение. Значение данного отношения более “2” свидетельствует об асимметрии транспорта МДА через монослой клеток Caco-2. Для подтверждения участия Pgp в формировании асимметрии транспорта выполнялись транспортные эксперименты с ингибитором белка-транспортера – верапамилом. Для этого его добавляли в обе камеры трансвеллов за 30 мин до внесения МДА в концентрации 200 мкМ. Выравнивание транспорта МДА по обе стороны от монослоя клеток Caco-2 на фоне верапамила свидетельствует об участии Pgp в транспорте продукта пероксидации.
Оценка концентрации МДА в транспортной среде выполнялась методом ВЭЖХ-МС/МС с использованием хроматографической системы “Dionex Ultimate 3000” и тандемного масс-селективного детектора TSQ Fortis (“ThermoFisher”, США).
Хроматографию проводили на колонке UCT Selectra C18 4.6 mm × 100 mm, 3 um, 100 A в комплексе с предколонкой Selectra C18 Guard Cartridges SLC-18GDC46-3UM; температура колонки 35°С. Был использован изократический режим элюирования со скоростью потока 300 мкл/мин подвижной фазой, состоящей из 20% ацетонитрила и 80% водного раствора формиата аммония с концентрацией 10 мМоль/л.
Детектирование МДА проводили при следующих условиях. Осуществлялась ионизация путем формирования электроспрея в негативном режиме при атмосферном давлении. В ходе работы использовались условия источника ионов: напряжение электроспрея 2700 В, оболочечный газ (sheath gas) 50 л/мин, вспомогательный газ (aux gas) 10 л/мин, продувочный газ (sweep gas) 1 л/мин, температура испарителя 350°С, ион-транспортирующей трубки 300°С. Для детектирования был использован режим MRM со следующими параметрами: разрешение Q1 и Q3 установлено на 0.7, скорость подачи аргона (CID gas) 1 мТорр. Для количественного определения использовался переход m/z 71.1 Да → 41 Да. Для качественного анализа использовали переходы m/z 71.1 Да → 43 Да, m/z 71.1 Да → 53 Да.
С целью подготовки проб к хроматографированию проводилось осаждение белков путем смешивания 10 мкл пробы с 90 мкл ацетонитрила, последующим встряхиванием и дальнейшим центрифугированием при 10 000 g в течение 10 мин при температуре +4°С. Полученный супернатант переносили в виалы (“ThermoFisher”, США) со специальными вставками объемом 300 мкл, после чего пробы помещали в автосемплер с поддерживаемой температурой +6°С.
Объем вводимой пробы 5 мкл, время удерживания МДА при указанных условиях составило 3.05 мин. Общее время анализа – 7 мин.
Количественное определение проводили методом абсолютной калибровки по площади пиков. Аналитический диапазон методики составлял 600 – 20 000 нмоль/л.
На заключительном этапе исследования оценивали выживаемость клеток линии Caco-2 при индукции/ингибировании активности Pgp в условиях развития окислительного стресса (ОС).
Клетки культивировали в 96-луночном планшете. ОС моделировали добавлением в культуральную среду пероксида водорода Н2О2 (“Sigma-Aldrich”, Германия) в конечных концентрациях 0.1, 0.5, 1, 5, 10 и 50 мкМ и инкубацией в течение 24 ч. На каждый эксперимент было выполнено по 3 повторения.
Ингибирование Pgp вызывали внесением в культуральную среду за 30 мин до добавления Н2О2 верапамила в концентрации 200 мкМ, а индукцию – добавлением 10 мкМ рифампицина за 24 ч до моделирования ОС. В дальнейшем ингибитор и индуктор добавляли к клеткам совместно с Н2О2 на протяжении всего исследования. После завершения эксперимента оценивали жизнеспособность клеток в ходе цитотоксического МТТ-теста.
Статистический анализ. Полученные результаты анализировали с помощью программного обеспечения GraphPad Prism 8. Результаты представлены в виде M ± SD. Для оценки статистической значимости различий использовали дисперсионный анализ (ANOVA), попарные сравнения выполняли с помощью теста Даннетта. Статистически значимыми считали различия при p < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Влияние МДА на жизнеспособность клеток линии Caco-2
На первом этапе исследования с помощью МТТ-теста был установлен безопасный для клеток линии Caco-2 диапазон концентраций МДА при воздействии в течение 24 ч. Жизнеспособность контрольных клеток принималась за 100%. МДА в концентрациях 10, 50 мкМ достоверно не влиял на жизнеспособность клеток, а в концентрациях 100 и 150 мкМ вызывал снижение изучаемого показателя при концентрации субстанции 100 и 150 мкМ до 88.5 ± 4.6% (р = 0.028) и 63.9 ± ± 3.1% (р = 0.0003) (рис. 2).
Влияние малонового диальдегида на количество и активность Pgp в клетках линии Сасо-2
Воздействие МДА в концентрациях 10 и 50 мкМ в течение 24 ч приводило к повышению уровня Pgp на 61.6% (р = 0.006) и 49.5% (р = 0.016) соответственно по сравнению с контролем, в концентрации 100 мкМ статистически значимо не влияло на данный показатель (р > 0.05), а в концентрации 150 мкМ вызывало его снижение на 46.5% (р = 0.018) по сравнению с контролем (рис. 3).
Рис. 2.
Изменение жизнеспособности клеток линии Сасо-2 в зависимости от концентрации МДА при инкубации 24 ч (M ± SD, n = 3). Жизнеспособность клеток оценивали с помощью МТТ-теста. * – достоверное отличие от контроля (* р < 0.05; *** р < 0.001, тест Даннетта).

Рис. 3.
Относительное количество P-гликопротеина в клетках линии Сасо-2 при воздействии малонового диальдегида в концентрациях 10–150 мкМ в течение 24 ч. Относительное количество P-гликопротеина определяли методом вестерн-блот с последующим денситометрическим анализом с использованием программного обеспечения ImageLab. Gapdh использовали в качестве цитоплазматического маркера. Эксперименты были повторены три раза с аналогичными результатами. *р < 0.05; **р < 0.01 – статистически значимые отличия от контроля (тест Даннетта).

Изменение количества Pgp под действием МДА во всех концентрациях сопровождалось следующей динамикой его активности.
Кратковременное воздействие МДА в течение 30 мин не влияло на коэффициенты кажущейся проницаемости Papp a–b и Papp b–a субстрата Pgp фексофенадина – данные показатели достоверно от контроля не отличались. Полученные результаты свидетельствуют о том, что МДА напрямую не влияет на активность Pgp, т.е. не является его прямым ингибитором или активатором.
В то же время увеличение длительности воздействия МДА до 24 ч в концентрации 10 мкМ приводило к увеличению коэффициента кажущейся проницаемости Papp b–a на 35.7% (р < < 0.0001), отношения Papp b–a/Papp a–b на 85.4% (р = 0.003) и снижению коэффициента кажущейся проницаемости Papp a–b на 31.1% (р = 0.04) по сравнению с контролем, а в концентрации 50 мкМ – к увеличению коэффициента кажущейся проницаемости Papp b–a на 14.7% (р = 0.007) и отношения Papp b–a/Papp a–b на 67.0% (р = = 0.003), коэффициент кажущейся проницаемости Papp a–b снижался на 31.6% (р = 0.04) относительно контроля (табл. 1).
Таблица 1.
Влияние МДА на транспорт субстрата Pgp – фексофенадина через билипидную мембрану клеток линии Caco-2 (M ± SD, см/с)
| Время инкубации | Экспериментальная группа | Papp b–a, cм/с, ×10–6 | Papp a–b, см/с, ×10–6 | Papp b–a/Papp a–b |
|---|---|---|---|---|
| Контроль | 5.43 ± 0.13 | 1.93 ± 0.19 | 2.82 ± 0.15 | |
| 30 мин | МДА 10 мкМ | 5.45 ± 0.20 | 1.96 ± 0.16 | 2.78 ± 0.24 |
| МДА 50 мкМ | 5.51 ± 0.26 | 2.04 ± 0.11 | 2.71 ± 0.25 | |
| МДА 100 мкМ | 5.98 ± 1.18 | 1.76 ± 0.13 | 3.41 ± 0.19 | |
| 24 ч | МДА 10 мкМ | 7.37 ± 0.26**** | 1.33 ± 0.18* | 5.23 ± 0.50** |
| МДА 50 мкМ | 6.23 ± 0.23** | 1.32 ± 0.05* | 4.71 ± 0.21** | |
| МДА 100 мкМ | 5.64 ± 0.92 | 1.89 ± 0.57 | 3.20 ± 1.19 |
В концентрации 100 мкМ и длительности экспозиции 24 ч МДА достоверного влияния на изучаемые показатели транспорта фексофенадина не оказал.
Полученные данные свидетельствуют о повышении количества и активности Pgp под действием МДА в концентрациях 10 и 50 мкМ при длительности воздействия 24 ч.
Механизм влияния малонового диальдегида на количество Pgp в клетках линии Сасо-2
Для изучения механизмов повышения количества Pgp под действием МДА были выполнены эксперименты с ингибиторами CAR – CINPA1 и PXR – кетоконазолом.
В ходе исследования было установлено, что CINPA1 в концентрации 10 мкМ предотвращал повышение количества Pgp при воздействии МДА в концентрации 10 и 50 мкМ в течение 24 ч, данный показатель достоверно от контроля не отличался. Инкубация клеток линии Caco-2 с МДА в концентрации 100 мкМ совместно с CINPA1 сопровождалось снижением относительного количества Pgp на 25.5% (р = 0.0002) по сравнению с контролем (рис. 4а).
Рис. 4.
Относительное количество P-гликопротеина в клетках линии Сасо-2 при воздействии малонового диальдегида в концентрациях 10, 50 и 100 мкМ в течение 24 ч в присутствии ингибиторов CAR (CINPA, а) и PXR (кетоконазол, б). Относительное количество P-гликопротеина определяли методом вестерн-блот с последующим денситометрическим анализом с использованием программного обеспечения ImageLab. Gapdh использовали в качестве цитоплазматического маркера. Эксперименты были повторены три раза с аналогичными результатами. *р < 0.05; ***р < 0.001 – статистически значимые отличия от контроля (тест Даннетта).
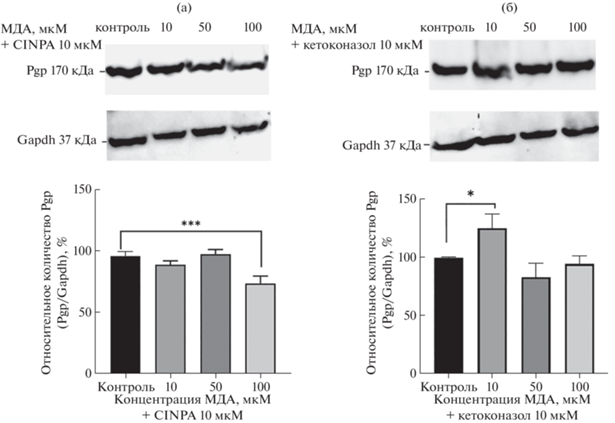
Кетоконазол не влиял на индуцирующее действие МДА на количество Pgp в концентрации 10 мкМ, уровень белка-транспортера превышал показатели контроля на 26.1% (р = 0.015), но при этом препятствовал индукции в концентрациях МДА 50 и 100 мкМ (количество Pgp достоверно не отличалось от значений контроля) (рис. 4б).
Оценка принадлежности малонового диальдегида к субстратам Pgp выполнялась по транспорту МДА через монослой клеток линии Caco-2.
При концентрации МДА 10 мкМ коэффициент кажущейся проницаемости Papp b–a МДА (характеризующий транспорт МДА за счет работы Pgp + пассивной диффузии) достоверно превышал коэффициент кажущейся проницаемости Papp a–b (характеризующий транспорт МДА за счет пассивной диффузии против работы Pgp) на 94.8% (р = 0.00001).
Ингибитор Pgp – верапамил вызывал снижение коэффициента кажущейся проницаемости Papp b–a на 28.8% (р = 0.038), что сопровождалось выравниванием транспорта МДА по обе стороны мембраны (р = 0.018).
Повышение концентрации МДА до 50 и 100 мкМ сопровождалось нивелированием асимметрии транспорта, коэффициенты кажущейся проницаемости Papp b–a МДА достоверно не отличались от Papp a–b.
Добавление в транспортную среду верапамила также существенно не влияло на изучаемые показатели, отмечалось только снижение коэффициента кажущейся проницаемости Papp b–a при концентрации МДА 100 мкМ на 31.7% (p = 0.0091) (табл. 2).
Таблица 2.
Транспорт малонового диальдегида (МДА) через билипидную мембрану клеток линии Caco-2 (M ± SD, см/сек)
| Серии эксперименов | Papp b–a, ×10–6 см/сек | Papp a–b, ×10–6 см/сек | Papp b–a/Papp a–b |
|---|---|---|---|
| МДА 10 мкМ | 19.42 ± 2.37 | 9.97 ± 0.88 | 1.96 ± 0.37 |
| МДА 10 мкМ + верапамил | 13.82 ± 2.15* | 17.01 ± 4.92 | 0.86 ± 0.32* |
| МДА 50 мкМ | 14.38 ± 0.84 | 10.14 ± 3.1 | 1.54 ± 0.64 |
| МДА 50 мкМ + верапамил | 12.88 ± 1.81 | 13.88 ± 1.66 | 0.93 ± 0.02 |
| МДА 100 мкМ | 8.54 ± 0.75 | 6.17 ± 1.67 | 1.44 ± 0.31 |
| МДА 100 мкМ + верапамил | 5.83 ± 0.63** | 4.02 ± 0.64 | 1.46 ± 0.29 |
Полученные результаты свидетельствуют о том, что МДА может транспортироваться Pgp.
Оценка роли P-гликопротеина при развитии окислительного стресса
На заключительном этапе исследования оценивалась роль Pgp в защите клеток при ОС. Для этого вызывали индукцию (преинкубация с рифампицином) или ингибирование Pgp (преинкубация с верапамилом) и оценивали жизнеспособность клеток в ходе МТТ теста после инкубации с H2O2 в концентрациях 0.1–100 мкМ в течение 24 ч.
Жизнеспособность контрольных клеток принималась за 100%. Воздействие H2O2 приводило к снижению жизнеспособности клеток до 45.9% (p = 0.001) и 65.7% (p = 0.002) при концентрациях 50 и 100 мкМ соответственно.
Предварительная индукция Pgp повышала резистентность клеток к ОС, о чем свидетельствовало снижение их жизнеспособности при воздействии Н2О2 только в концентрации 100 мкМ на 26.7% (р = 0.0012) относительно контроля и повышение на 28.5% (р = 0.005) и 40.7% (р = 0.001) относительно самостоятельного применения Н2О2 в концентрациях 50 и 100 мкМ (рис. 5). Ингибирование белка-транспортера, наоборот, снижало устойчивость клеток, их жизнеспособность снижалась при использовании всего диапазона концентраций 0.1–100 мкМ, максимально при 50 и 100 мкМ на 52.9 и 77.6% (р < 0.0001) относительно контроля. Стоит отметить, что при предварительном ингибировании Pgp и использовании Н2О2 в концентрации 0.1 мкМ жизнеспособность клеток статистически значимо снижалась на 18.7% (р = 0.01) относительно самостоятельного воздействия прооксиданта (рис. 5).
Рис. 5.
Изменение жизнеспособности клеток в условиях моделирования окислительного стресса (3, Н2О2), предварительной индукции (2, рифампицин) и ингибирования (4, верапамил) активности Р-гликопротеина при моделировании ОС, контроль принимали за 100% (1). *– статистически значимые отличия относительно контроля, #– статистически значимые отличия относительно группы Н2О2.

Полученные результаты свидетельствуют о том, что Pgp играет защитную роль в клетках при развитии окислительного стресса.
МДА является основным и наиболее изученным продуктом перекисного окисления полиненасыщенных жирных кислот. При этом МДА способен нарушать функционирования клеток благодаря своей способности вступать в реакцию с такими молекулами, как ДНК и белки [12].
Pgp – АТФ-зависимый белок-транспортер, обеспечивающий выведение своих субстратов из клеток во внеклеточное пространство и биологичские жидкости, защищая их от воздействия токсических веществ [1].
В ряде исследований было показано, что развитие ОС может приводить к повышению количества и активности Pgp [8, 13]. Однако механизмы индукции и ее биологическое значение на данный момент не установлены, так же как и неясен ее биологический смысл.
В рамках настоящего исследования проверялась гипотеза о том, что МДА является субстратом Pgp (т.е. Pgp может выводить МДА из клеток, защищая их от его токсического воздействия), а также способен повышать активность данного белка-транспортера. Было показано, что МДА при длительности воздействия 24 ч в концентрации 10 и 50 мкМ вызывает повышение количества Pgp, что сопровождается также и увеличением активности белка-транспортера в изученных концентрациях.
Однако при длительности преинкубации 30 мин МДА не влиял на активность белка-транспортера, что свидетельствует о том, что молекула МДА непосредственно на Pgp не воздействует, т.е. не является его прямым индуктором/ингибитором.
Для изучения механизмов повышения относительного количества Pgp под действием МДА была изучена роль прегнан Х рецептора (PXR, steroid and xenobiotic receptor – SXR, NR1I2 - Nuclear Receptor Subfamily 1, Group I, Member 2) и конститутивного андростанового рецептора (CAR, NR1I3, подсемейство 1, группа I, член 3) в данном процессе. PXR и CAR являются членами суперсемейства ядерных рецепторов, экспрессируются преимущественно в печени и кишечнике и регулируют экспрессию ферментов I фазы биотрансформации, таких как изоферменты цитохрома P450 CYP3A и CYP2B, а также белков-транспортеров, в частности Pgp [14].
Установлено, что данные рецепторы играют важную роль в индукции ферментов биотрансформации и белков-транспортеров под действием ксенобиотиков. Также показано, что развитие окислительного и нитрозативного стресса может приводить к повышению количества PXR [15, 16] и CAR [17].
Ингибирование CAR предотвращало индукцию Pgp при использовании всех изученных концентраций МДА, а блокирование PXR нивелировало индуцирующий эффект МДА только в концентрации 50 мкМ. Полученные результаты свидетельствуют о том, что МДА может индуцировать Pgp через активацию CAR и PXR, при этом вклад CAR, видимо, более существенный.
При тестировании МДА на принадлежность к субстратам Pgp было показано, что в концентрации 10 мкМ белок-транспортер принимает участие в транспорте продукта пероксидаци. При увеличении концентрации МДА до 50 и 100 мкМ вклад Pgp в транспорт МДА уменьшается, так как, видимо, увеличивается его транспорт путем пассивной диффузии. Молекула МДА имеет небольшую молекулярную массу и легко может проходить через монослой клеток [18, 19].
Согласно данным литературы, субстратами Pgp, в основном, являются вещества с молекулярной массой выше 300 Да [20]. Молекулярная масса МДА 72 Да. Можно было бы предположить, что транспортируется не сама молекула, а продукт взаимодействия МДА с каким-либо эндогенным компонентом. Но детектирование МДА методом ВЭЖХ-МС/МС исключает это предположение.
На заключительном этапе исследования была оценена роль Pgp в защите клеток при ОС. Для этого в ходе МТТ теста оценивалась выживаемость клеток Caco-2 при индукции и ингибировании Pgp на фоне ОС. Было показано, что индукция Pgp повышает выживаемость клеток, а ингибирование – ее снижает.
ВЫВОДЫ
Таким образом, на клетках линии Caco-2 было доказано:
1) МДА – конечный продукт перекисного окисления полиненасыщенных жирных кислот, в концентрациях 10 и 50 мкМ и длительности экспозиции 24 ч повышает относительное количество и активность Pgp, действуя через ядерные рецепторы CAR и PXR.
2) МДА при определенных концентрациях может транспортироваться Pgp.
3) Биологическое значение индукции Pgp под действием МДА определяется его защитным и цитопротекторным действием, которое обеспечивает выведение данного продукта пероксидации из клеток во внеклеточное пространство и таким образом увеличивает жизнеспособность клеток.
Список литературы
Якушева Е.Н., Титов Д.С., Правкин С.К. Локализация, модели функционирования и физиологические функции гликопротеина-Р // Успехи физиологических наук. 2017. Т. 48. № 4. С. 70–87.
Juliano R.L., Ling V. A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutans // Biochem. Biophis. Acta. 1976. V. 455. № 1. P. 155–162.
Gottesman M.M., Ling V. The molecular basis of multidrug resistance in cancer: The early years of P-glycoprotein research // FEBS Lett. 2006. V. 580. P. 998–1009.
Fojo A.T., Ueda K., Slamon D.J., Poplack D.G., Gottesman M.M., Pastan I. Expression of a multidrug-resistance gene in human tumors and tissues // Proc. Natl. Acad. Sci. USA. 1987. V. 84. № 1. P. 265–269.
Thiebaut F., Tsuruo T., Hamada H., Gottesman M.M., Pastan I., Willingham M.C. Cellular localization of the multidrug-resistance gene product P-glycoprotein in normal human tissues // Proc. Natl. Acad. Sci. USA. 1987. V. 84. № 21. P. 7735–7738.
Schinkel A.H., Smit J.J.M., van Tellingen O., Beijnen J.H., Wagenaar E., Vandeemter L., Mol C., Vandervalk M.A., Robanusmaandag E.C., Teriele H.PJ. Disruption of the mouse mdr1a P-glycoprotein gene leads to a deficiency in the blood-brain barrier and to increased sensitivity to drugs // Cell. 1994. V. 77. P. 491–502.
Borst P., Schinkel A.H. P-glycoprotein ABCB1: a major player in drug handling by mammals // J. Clin. Invest. 2013. V. 123. № 10. P. 4131–4133.
Shchulkin A.V., Abalenikhina Yu.V., Erokhina P.D., Chernykh I.V., Yakusheva E.N. The Role of PGlycoprotein in Decreasing Cell Membranes Permeability during Oxidative Stress // Biochemistry (Moscow). 2021. V. 86. № 2. P. 197–206.
Hilgers A.R., Conradi R.A., Burton P.S. Caco-2 cell monolayers as a model for drug transport across the intestinal mucosa // Pharmac. res. 1990. V. 7. № 9. P. 902–910.
Kota B.P., Tran V.H., Allen J., Bebawy M., Roufogalis B.D. Characterization of PXR mediated P-glycoprotein regulation in intestinal LS174T cells // Pharmacol Res. 2010. V. 62. № 5. P. 426–431.
Cherian M.T., Lin W., Wu J., Chen T. CINPA1 is an inhibitor of constitutive androstane receptor that does not activate pregnane X receptor. Mol Pharmacol. 2015. V. 87. № 5. P. 878–889.
Rio D. Del, Stewart A. J., Pellegrini N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress // Nutrition, Metabolism and Cardiovascular Diseases. 2005. V. 15. № 4. P. 316–328.
Ziemann C., Bürkle A., Kahl G.F., Hirsch-Ernst K.I. Reactive oxygen species participate in mdr1b mRNA and P-glycoprotein overexpression in primary rat hepatocyte cultures // Carcinogenesis. 1999. V. 20. № 3. P. 407–14.
Lemmen J., Tozakidis I.E., Bele P., Galla H.J. Constitutive androstane receptor upregulates Abcb1 and Abcg2 at the blood-brain barrier after CITCO activation // Brain Res. 2013. V. 21. P. 1501: 68–80.
Abalenikhina Y.V., Sudakova E.A., Slepnev A.A., Seidkulieva A.A., Erokhina P.D., Shchulkin A.V., Yakushe-va E.N. Functioning of the pregnan X receptor under oxidative stress // Biochemistry (Moscow), Supplement Series A: Membrane and Cell Biology. 2022. V. 16. № 1. P. 21–28.
Abalenikhina Y.V., Sudakova E.A., Seidkulieva A.A., Shchul’kin A.V., and Yakusheva E.N. Funktsionirovanie pregnan X retseptora v usloviiakh nitrozativnogo stressa // Biomed Khim. 2021. V. 67. № 5. P. 394–401.
Shchul'kin A.V., Abalenikhina Y.V., Seidkulieva A.A., Ryabkov A.N., and Yakusheva E.N. Induction of Constitutive Androstane Receptor during the Development of Oxidative Stress // Bull Exp Biol Med. 2021. V. 171. № 5. P. 615–618.
Tesoriere L., D’Arpa D., Butera D., Pintaudi A.M., Allegra M., Livrea M.A. Exposure to malondialdehyde induces an early redox unbalance preceding membrane toxicity in human erythrocytes // Free Radic Res. 2002. V. 36. № 1. P. 89–97.
Draper H.H., Hadley M. A review of recent studies on the metabolism of exogenous and endogenous malondialdehyde // Xenobiotica. 1990. V. 20. № 9. P. 901–907.
Mora Lagares L., Minovski N., Novič M. Multiclass Classifier for P-Glycoprotein Substrates, Inhibitors, and Non-Active Compounds // Molecules. 2019. V. 24. № 10.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


