Доклады Российской академии наук. Науки о жизни, 2023, T. 508, № 1, стр. 68-72
ОРГАНИЗАЦИЯ ЦЕРАТЫ ГОЛОЖАБЕРНОГО МОЛЛЮСКА PTERAEOLIDIA SEMPERI (GASTROPODA, NUDIBRANCHIA)
О. А. Воробьева 1, *, И. А. Екимова 1, академик РАН В. В. Малахов 1
1 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: olgavorobyeva.95@gmail.com
Поступила в редакцию 15.09.2022
После доработки 05.10.2022
Принята к публикации 06.10.2022
- EDN: MLNHTJ
- DOI: 10.31857/S2686738922600558
Аннотация
Исследовано строение церат и книдосаков голожаберного моллюска Pteraeolidia semperi (Bergh, 1870). От гастродермального канала пищеварительной железы отходят тонкие трубочки, содержащие клетки с симбиотическими водорослями-зооксантеллами, тогда как в книдосаке содержатся крупные клептокниды. Таким образом, P. semperi представляет собой уникальный пример симбиотрофного питания. Организация их церат и пищеварительной железы демонстрирует морфологические приспособления к культивированию зооксантелл и обеспечению активного фотосинтеза симбиотическими водорослями.
Голожаберные моллюски – необычная группа морских брюхоногих моллюсков, лишенных раковины. На спинной стороне многих представителей Nudibranchia имеются выросты, выполняющие функцию вторичных жабр. У моллюсков из инфраотряда Aeolidida такие выросты (цераты) имеют еще и защитную функцию. В них заходят дивертикулы пищеварительной системы, по которым в апикальную часть цераты транспортируются стрекательные капсулы съеденных моллюском книдарий [1–4]. Однако у некоторых представителей Nudibranchia в цератах обнаружены симбиотические одноклеточные водоросли – зооксантеллы [5]. Как правило, зооксантеллы встречаются у моллюсков, лишенных клептокнид [6–8], но иногда цераты содержат и клептокниды, и зооксантеллы [9]. Данное явление обнаружено у представителей рода Pteraeolidia [9]. Род Pteraeolidia формально включает в себя два вида: Pteraeolidia ianthina (Angas, 1864) и P. semperi (Bergh, 1870), однако недавнее молекулярно-генетическое исследование показало, что вид P. semperi, в действительности, является комплексом видов, которые пока остаются неописанными [10].
Цель настоящей работы – описать организацию церат одного из представителей видового комплекса P. semperi, цераты которого содержат и клептокниды, и зооксантеллы.
Особи P. semperi были собраны в 2017 г. в Южном Вьетнаме, провинция Ня Чанг, в окрестностях острова Мот (глубина 16 м, координаты: 12°10′29.20″ С 109°16′18.47″ В) при помощи легководолазной техники. Материалом служили цераты, отсеченные от живых особей, наркотизированных 7.5%-м раствором хлористого магния, и помещенные в фиксатор. Для проведения гистологических и ультраструктурных исследований материал был зафиксирован в 2.5% растворе глутарового альдегида на фосфатном буфере. Для проведения иммунно-цитохимических исследований фиксатором послужил 4% раствор параформальдегида на морской воде. Для изучения мускулатуры использовалось окрашивание флуоресцентными красителями Alexa Fluor® 647 Phalloidin (окрашивает фибриллярный актин) (“ThermoFisher Scientific”, США) и иодидом пропидия (окрашивает ядра) (“Sigma-Aldrich”, США). Для выявления аморфного хитина использовали окрашивание флуоресцентным красителем Calcofluor White (“Sigma-Aldrich”).
У исследуемого вида цераты собраны в пучки, по 5–15 штук. Каждая церата представляет собой уплощенный вырост, сужающийся апикально. Снаружи церата одета тонким, складчатым эпидермисом, толщиной от 8 до 15 мкм (рис. 1). Клетки эпидермиса заполнены вакуолями с уплощенными хитиновыми гранулами (рис. 2). Обилие хитиновых гранул в эпидермисе обуславливает его яркое свечение при исследовании на конфокальном лазерном микроскопе при окрашивании красителем CalcoFluor White (рис. 2a). Эпителий подостлан толстой и складчатой базальной пластинкой, толщина которой составляет 1 мкм. Изнутри к базальной пластинке прилегает мышечный слой, состоящий преимущественно из клеток продольной мускулатуры (рис. 2а, в).
Рис. 1.
Схема продольного среза цераты Pteraeolidia semperi. Обозначения: cnz – зона книдопора; cndp – книдофаг; cpz – зона книдофагов; ep – эпидермис; gc – гастродермальные клетки; gch – гастродермальный канал; gt – gastrodermal tenia – гастродермальный тяж; hc – гемоцель; lu – просвет пищеварительной железы; ml – мышечные пучки; nc – клептокниды в книдофагах; zx – зооксантеллы в клетках пищеварительной железы.

Рис. 2.
Тонкое строение апикальной части цераты. а – продольный оптический срез через книдосак (конфокальная лазерная сканирующая микроскопия, белыми треугольниками отмечены клептокниды). б – продольный ультратонкий срез через зону книдофагов (трансмиссионная электронная микроскопия, ТЭМ). в – продольный ультратонкий срез через апикальную часть книдосака (ТЭМ, черными треугольниками отмечена базальная пластинка эпидермиса, стрелка в правом верхнем углу обозначает дистальный конец книдосака). Обозначения: cnz – зона книдопора; cndp – книдофаг; cpz – зона книдофагов; dgc – клетки пищеварительной железы; ep – эпидермис; hc – гемоцель; mb – мускулатура стенки тела; mc – мускулатура книдосака; nc – нематоцисты в книдофагах (клептокниды); ve – везикулы; zx – зооксантеллы. Масштабные линейки: a, с – 30 мкм; в – 10 мкм.
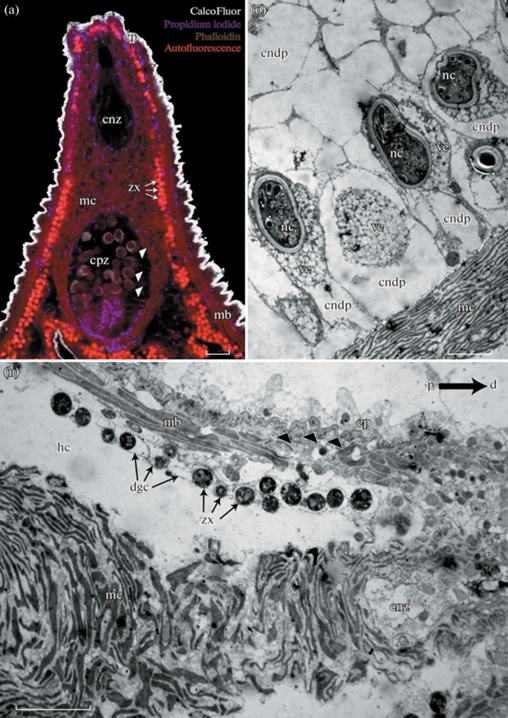
По оси цераты проходит тонкий гастродермальный канал – вырост пищеварительной железы. В апикальной части цераты этот канал расширяется, формируя книдосак (рис. 1). На большей части протяжения цераты гастродермальный канал практически лишен мускулатуры, тогда как книдосак имеет мощную мышечную обкладку, образованную переплетением мышечных пучков, идущих в различных направлениях. Книдосак подразделяется на две части: расширенную базальную – зона книдофагов, и суженую апикальную – зона книдопора (рис. 2а, в). Внутренняя выстилка базальной части книдосака представлена крупными гастродермальными клетками – книдофагами (рис. 2а, б). Для вида P. semperi характерно то, что каждый книдофаг содержит только одну клептокниду (рис. 2б). Книдофаги представляют собой крупные клетки, цитоплазма которых дифференцирована на центральную часть, содержащую многочисленные везикулы и большинство клеточных органелл, включая ядро, и периферическую – бедную органеллами (рис. 2в). Клептокниды представляют собой овальные тельца 10 × 20 мкм, расположенные в наполненной везикулами части цитоплазмы. На ТЭМ изображениях они имеют толстую, электроннопрозрачную оболочку и электронно-плотное внутреннее содержимое, в котором хорошо различима свернутая в спираль стрекательная нить (рис. 2б). Клептокниды помещаются в вакуоль, мембрана которой тесно прилегает к стенке клептокниды и различима только в некоторых местах. Гастродермальная выстилка апикальной части книдосака не содержит клептокнид (рис. 2а).
Апикальная часть книдосака открывается книдопором на вершине цераты. Здесь гастродермальный эпителий выстилки книдосака контактирует с внешней средой. Очевидно, что книдопор служит для выбрасывания во внешнюю среду клептокнид, которые обеспечивают защиту голожаберного моллюска от врагов.
Пространство между тонким гастродермальным выростом и стенкой цераты представлено обширным гемоцелем (рис. 1 и 2в). На проходящем по оси цераты выросте пищеварительной железы (ниже книдосака) периодически располагаются вздутия. От этих вздутий под прямым углом, пересекая гемоцель, отходят тонкие гастродермальные каналы. Достигая стенки тела, они дают начало еще более тонким гастродермальным тяжам, идущим в апикальную и базальную части цераты (рис. 1). Эти тяжи не имеют выраженной полости, непосредственно прилегают к слою мускулатуры, и иногда проникают между мышечными пучками, в отдельных местах образуют вздутия. Гастродермальные клетки этих каналов содержат в цитоплазме многочисленные зооксантеллы (рис. 2в). Последние представляют собой округлые клетки, диаметр которых составляет 7–8 мкм, и в которых можно различить ядро, хлоропласт и другие органеллы (рис. 2в). Каждая зооксантелла находится в фагоцитарной вакуоли.
Терминальные гастродермальные тяжи имеют толщину 7–9 мкм, в них отсутствует просвет. Выраженная базальная пластинка, которая бы отделяла гастродермальные каналы от гемоцеля, отсутствует. Лишь в отдельных участках удается видеть мелко гранулярный материал, который, возможно, представляет собой остатки истонченной базальной пластинки. Такой же мелкогранулярный материал можно наблюдать на плазмолемме мышечных клеток.
Представители рода Pteraeolidia – это уникальный пример одновременной клептокнидии и клептопластии среди голожаберных моллюсков. Большинство видов голожаберных моллюсков вообще не имеют в тканях симбиотических водорослей [11, 12]. Среди тех видов, у которых в тканях обнаруживаются зооксантеллы, можно выделить три группы [9]. К первой группе относятся виды, у которых зооксантеллы некоторое время существуют в клетках пищеварительной железы, но используются преимущественно как пищевой ресурс и рано или поздно перевариваются. Ко второй группе относятся виды, у которых с зооксантеллами устанавливаются мутуалистические отношения. Зооксантеллы живут в клетках пищеварительной железы, фотосинтезируют, но при этом пищеварительная железа не демонстрируют каких-либо специальных морфологических приспособлений для культивирования симбионтов. Можно предполагать, что в таких случаях сахара, образуемые зооксантеллами, используются для питания хозяина, в то время как основным источником пищи являются ткани кораллов и гидроидных полипов.
Представители рода Pteraeolidia относятся к третьей группе. Организация их церат и пищеварительной железы демонстрируют морфологические приспособления к культивированию зооксантелл и обеспечению ими активного фотосинтеза. Цераты располагаются пучками, на специальных базальных выростах, что снижает их перекрывание. Зооксантеллы располагаются в тонких разветвлениях гастродермальных каналов, которые пересекают гемоцель и прилегают к стенке тела. Эпидермис церат P. semperi гораздо тоньше, чем у других голожаберных моллюсков [3, 13].
Биология представителей рода Pteraeolidia изучена плохо. Эти моллюски живут в рифовых сообществах тропических морей, но их редко находят на самих кораллах. Как правило, эти моллюски обнаруживаются на открытых участках дна, не занятых поселениями кораллов [9, 14]. В экспериментальных условиях P. semperi способна длительное время существовать вообще без животного питания, при этом фотосинтетическая активность зооксантелл не снижается [14]. Таким образом, можно предполагать, что симбиотрофное питание за счет зооксантелл имеет для P. semperi существенно большее значение, чем у других голожаберных моллюсков.
Список литературы
Greenwood P.G. Acquisition and use of nematocysts by cnidarian predators // Toxicon. 2009. V. 54. № 8. P. 1065–1070.
Vorobyeva O.A., Ekimova I.A., Malakhov V.V. The structure of cnidosacs in nudibranch mollusc Aeolidia papillosa (Linnaeus, 1761) and presumable mechanism of nematocysts release // Doklady Biological Sciences. 2017. V. 476. № 1. P. 196–199.
Vorobyeva O.A., Malakhov V.V., Ekimova I.A. General and fine structure of Aeolidia papillosa cnidosacs (Gastropoda: Nudibranchia) // Journal of Morphology. 2021. V. 282. № 5. P. 754–768.
Goodheart J.A., Bely A.E. Sequestration of nematocysts by divergent cnidarian predators: mechanism, function, and evolution // Invertebrate Biology. 2017. V. 136. № 1. P. 75–91.
Burghardt I., Evertsen J., Johnsen G., et al. Solar powered sea slugs – mutualistic symbiosis of aeolid Nudibranchia (Mollusca, Gastropoda, Opisthobranchia) with Symbiodinium // Symbiosis. 2005. V. 38. P. 227–250.
Wägele M., Johnsen G. Observations on the histology and photosynthetic performance of “solar-powered” opisthobranchs (Mollusca, Gastropoda, Opisthobranchia) containing symbiotic chloroplasts or zooxanthellae // Organisms Diversity & Evolution. 2001. V. 1. № 3. P. 193–210.
Burghardt I., Gosliner T.M. Phyllodesmium rudmani (Mollusca: Nudibranchia: Aeolidoidea), a new solar powered species from the Indo-West Pacific with data on its symbiosis with zooxanthellae // Zootaxa. 2006. V. 1308. № 1. P. 31–47.
Burghardt I., Wägele H. A new solar powered species of the genus Phyllodesmium Ehrenberg, 1831 (Mollusca: Nudibranchia: Aeolidoidea) from Indonesia with analysis of its photosynthetic activity and notes on biology // Zootaxa. 2004. V. 596. № 1. P. 1–18.
Rudman W.B. The taxonomy and biology of further aeolidacean and arminacean nudibranch molluscs with symbiotic zooxanthellae // Zoological Journal of the Linnean Society. 1982. V. 74. № 2. P. 147–196.
Wilson N.G., Burghardt I. Here be dragons-phylogeography of Pteraeolidia ianthina (Angas, 1864) reveals multiple species of photosynthetic nudibranchs (Aeolidina: Nudibranchia) // Zoological Journal of the Linnean Society. 2015. V. 175. № 1. P. 119–133.
Wägele H. Potential key characters in Opisthobranchia (Gastropoda, Mollusca) enhancing adaptive radiation // Organisms Diversity & Evolution. 2004. V. 4. № 3. P. 175–188.
Wägele H., Raupach M.J., Burghardt I., et al. Solar-powered sea slugs (Opisthobranchia, Gastropoda, Mollusca): incorporation of photosynthetic units: a key character enhancing radiation? // Evolution in action. Springer, Berlin, Heidelberg. 2010. P. 263–282.
Goodheart J.A., Bleidißel S., Schillo D., et al. Comparative morphology and evolution of the cnidosac in Cladobranchia (Gastropoda: Heterobranchia: Nudibranchia) // Frontiers in zoology. 2018. V. 15. № 1. P. 1–18.
Burghardt I., Stemmer K., Wägele H. Symbiosis between Symbiodinium (Dinophyceae) and various taxa of Nudibranchia (Mollusca: Gastropoda), with analyses of long-term retention // Organisms Diversity & Evolution. 2008. V. 8. № 1. P. 66–76.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


