Доклады Российской академии наук. Науки о жизни, 2023, T. 508, № 1, стр. 30-34
СТИМУЛЯЦИЯ ОВУЛЯЦИИ У НЕПОЛОВОЗРЕЛЫХ САМОК КРЫС С ПОМОЩЬЮ ОРТОСТЕРИЧЕСКОГО И АЛЛОСТЕРИЧЕСКОГО АГОНИСТОВ РЕЦЕПТОРА ЛЮТЕИНИЗИРУЮЩЕГО ГОРМОНА
Е. А. Фокина 1, К. В. Деркач 1, А. А. Бахтюков 1, В. Н. Сорокоумов 2, И. А. Лебедев 1, И. Ю. Морина 1, А. О. Шпаков 1, *
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Институт химии, Федеральное государственное бюджетное образовательное учреждение высшего образования “Санкт-Петербургский государственный университет”
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 30.09.2022
После доработки 10.10.2022
Принята к публикации 10.10.2022
- EDN: MUDQQJ
- DOI: 10.31857/S2686738922700032
Аннотация
Хорионический гонадотропин человека (ХГЧ) и лютеинизирующий гормон (ЛГ) широко используются для лечения репродуктивных расстройств и при контролируемой индукции овуляции, но их применение ограничивается побочными эффектами. Альтернативой могут стать аллостерические агонисты рецептора ЛГ/ХГЧ, в том числе разработанный нами тиено[2,3-d]тиенопиримидин TP03. Показано, что TP03 (50 мг/крысу, в/б) при введении неполовозрелым самкам крыс, обработанным за 48 ч до этого Фоллимагом, повышает у них уровень прогестерона (максимум через 8 ч после обработки) и вызывает овуляцию, на что указывает появление через 24 ч желтых тел (8.6 ± 0.5 на яичник). По своей активности TP03 сопоставим с ХГЧ, хотя действует более мягко. В отличие от ХГЧ, он не приводит к повышению в яичниках экспрессии фактора роста эндотелия сосудов, который способен вызвать синдром гиперстимуляции яичников. Таким образом, TP03 является перспективным препаратом, как индуктор овуляции и стимулятор овариального стероидогенеза.
Разработка эффективных стратегий для контролируемой индукции овуляции, в том числе при вспомогательных репродуктивных технологиях, является актуальной задачей современной эндокринологии и репродуктивной медицины. В настоящее время для этого используют препараты гонадотропинов – мочевого и рекомбинантного хорионического гонадотропина человека (ХГЧ) и рекомбинантного лютеинизирующего гормона (ЛГ), но они применяются в сравнительно высоких дозах, и это приводит к гиперактивации овариального рецептора ЛГ/ХГЧ и усиливает экспрессию фактора роста эндотелия сосудов (VEGF), что может стать причиной синдрома гиперстимуляции яичников (СГЯ) [1]. Наряду с этим, гонадотропины обладают низкой специфичностью по отношению к внутриклеточным каскадам в клетках-мишенях, что обусловлено взаимодействием активированного гормоном рецептора ЛГ/ХГЧ с различными типами гетеротримерных G-белков (Gs, Gq/11) и β-аррестинов [2, 3]. Многие побочные эффекты фармакологических препаратов ЛГ и ХГЧ обусловлены тем, что паттерн их N-гликозилирования отличается от такового у природных гормонов [4]. Важно отметить, что N-гликозилирование не только влияет на аффинность гонадотропинов к рецептору, но и играет определяющую роль в их эффекторной специфичности [3, 4].
Все вышесказанное требует разработки альтернативных подходов для индукции овуляции, и большие ожидания здесь связывают с аллостерическими регуляторами рецептора ЛГ/ХГЧ, в том числе с производными тиено[2,3-d]-пиримидина [5, 6]. Нами ранее были разработаны и изучены два тиено[2,3-d]-пиримидиновых производных TP03 и TP04, наделенные свойствами полных аллостерических агонистов рецептора ЛГ/ХГЧ, которые при введении самцам крыс с андрогенным дефицитом, вызванным старением или сахарным диабетом, восстанавливали тестикулярный стероидогенез, нормализовали уровень тестостерона, улучшали сперматогенез [7, 8]. Мы предположили, что эти соединения при введении самкам крыс могут выступать в качестве индукторов овуляции, стимулируя овариальный стероидогенез. В пользу этого свидетельствуют данные о том, что соединение Org43553, наделенное активностью агониста рецептора ЛГ/ХГЧ и также относящееся к классу тиено[2,3-d]-пиримидинов, способно индуцировать овуляцию у животных и в условиях клиники у женщин-добровольцев [9, 10]. В соответствии с этим, целью работы было в сравнительном аспекте исследовать способность ХГЧ и TP03 индуцировать овуляцию у неполовозрелых самок крыс, регулировать овариальный стероидогенез и влиять на экспрессию генов VegfA и VegfB, кодирующих различные изоформы фактора роста эндотелия сосудов (VEGF-A, VEGF-B), вовлеченные в развитие СГЯ [11]. При этом оценивалась временная динамика изучаемых эффектов TP03 и ХГЧ.
В опытах использовали неполовозрелых самок крыс линии Wistar возраста 22–24 дня, эксперименты осуществляли в соответствии с требованиями Этического комитета ИЭФБ РАН (протокол № 2/4-2021), European Communities Council Directive 1986 (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”. Для стимуляции фолликулогенеза использовали гонадотропин сыворотки жеребых кобыл Фоллимаг (1000 МЕ/флакон, “Мосагроген”, Россия) (п/к, 15 МЕ/крысу). Спустя 48 ч после обработки Фоллимагом крысам вводили индукторы овуляции – TP03 (в/б, 50 мг/кг) или ХГЧ (п/к, 15 МЕ/крысу). После введения TP03 или ХГЧ через 4, 8, 16 или 24 ч у животных забирали влагалищные мазки для микроскопии. До и через соответствующие временные интервалы после введения индукторов овуляции крыс анестезировали (хлоральгидрат, 400 мг/кг, в/б), декапитировали, забирали и взвешивали яичники, морфологически оценивали число созревших фолликулов, измеряли экспрессию овариальных генов. Из шейных вен забирали кровь для определения стероидных гормонов. Формировали 10 групп (во всех n = 5): контрольные крысы (К), получавшие вместо препаратов их растворители; крысы, которых обрабатывали только Фоллимагом (через 48 ч после инъекции) (Ф); крысы, которых через 48 ч после инъекции Фоллимага обрабатывали TP03 (в/б, 50 мг/кг) или ХГЧ (п/к, 15 МЕ/крысу) и декапитировали через 4, 8, 16 и 24 ч после введения TP03 (ФТ-4, ФТ-8, ФТ-16, ФТ-24) или ХГЧ (ФГ-4, ФГ-8, ФГ-16, ФГ-24).
Для морфологического анализа яичники в течение 48 ч (+4°C) фиксировали в 4%-ном растворе пара-формальдегида, который готовили в фосфатном буфере (0.1 М, pH 7.2), содержащем 0.9% NaCl (PBS). После промывки в PBS образцы помещали в 30%-ный раствор сахарозы в PBS (+4°C) и после криопротекции замораживали на сухом льду в среде Tissue-Tek® (“Sacura, FinetekEurope”, Нидерланды). Продольные срезы яичника (10 мкм) получали с помощью криостата Leiсa CM-1520 (“Leica Microsystems”, Германия), каждый десятый из них монтировали на стекла Super-Frost/plus (“Menzel”, Германия) и высушивали. После обработки 50%-ным раствором этанола (15 мин) стекла окрашивали Sudan-3 (15 мин), затем докрашивали гематоксилином и заключали под покровное стекло с глицерином. Изображения анализировали с помощью микроскопа Carl Zeiss Imager A1 (“Carl Zeiss”, Германия) с видеокамерой Axiocam 712 и программным обеспечением Zen 3.4. Согласно гистологическому атласу [12], на срезах подсчитывали количество предовуляторных фолликулов и желтых тел, по которым оценивали число фолликулов, подвергнувшихся овуляции. Уровни эстрадиола и прогестерона в крови крыс определяли с помощью ИФА-анализа, используя наборы “Эстрадиол-ИФА” и “Прогестерон-ИФА” (“ХЕМА”, Россия). Тотальную РНК из яичников выделяли с помощью реагента ExtractRNA (“Евроген”, Россия), и проводили обратную транскрипцию с помощью набора “MMLV RT Kit” (“Евроген”, Россия). ПЦР осуществляли на амплификаторе Applied Biosystems® 7500 Real-Time PCR System (“Life Technologies, Thermo Fisher Scientific Inc.”, США) в смеси, содержащей 0.4 мкМ прямо-го и обратного праймеров, используя реагент qPCR-HS SYBR+Low ROX (“Евроген”, Россия). Экспрессию генов VegfA и VegfB оценивали с помощью метода delta-delta-Ct, используя ген актина B (Actb) в качестве референсного, как описано ранее [7]. Статистический анализ проводили с помощью программы “Microsoft Office Excel 2007” (США). Результаты представляли, как M ± SEM. Нормальность распределения оценивали с помощью критерия Шапиро–Уилка. Значимыми считали различия при p < 0.05.
Исследование удельной массы яичников показало значимое ее повышение во всех группах с введением Фоллимага, в том числе с обработкой TP03 и ХГЧ (табл. 1). Морфологический анализ яичников показал, что количество предовуляторных фолликулов при обработке крыс обоими индукторами овуляции нарастало в течение 16 ч после их введения. Через 24 ч число предовуляторных фолликулов резко снижалось (TP03) или они вовсе не обнаруживались (ХГЧ) (табл. 1). Желтые тела, соответствующие овуляторным фолликулам, в значимых количествах были выявлены у животных в группах ФТ-24 и ФГ-24, что указывает на индукцию у них овуляции (табл. 1).
Уровень прогестерона в крови существенно повышался через 8 ч после обработки TP03 и ХГЧ, в большей степени в случае ХГЧ (рис. 1а). Повышение уровня прогестерона сохранялось через 16 ч после обработки ХГЧ, но исчезало через 24 ч, что согласуется с данными других авторов об остром пике повышения уровня прогестерона в крови неполовозрелых крыс после введения ХГЧ и последующем его снижении [13, 14]. Рассчитанное значение AUC4-24 для кривой “концентрация прогестерона (нМ)–время (ч)” в случае ХГЧ существенно превосходило соответствующее значение для TP03 (1208 ± 156 vs. 475 ± 42, p < 0.002). Уровень эстрадиола в группах с обработкой TP03 и ХГЧ, напротив, значимо снижался в сравнении с группой Ф (рис. 1б). Снижение было более эффективным при использовании гонадотропина, на что указывает более низкое значение AUC4–24 для кривой “концентрация эстрадиола (нМ)–время (ч)” в случае ХГЧ в сравнении с TP03 (6.30 ± 0.74 vs. 9.29 ± 0.72, p < 0.05). О снижении уровня эстрадиола после индукции овуляции с помощью ХГЧ у неполовозрелых крыс сообщали и другие авторы [13, 15]. Одной из причин этого является изменение доступности тестостерона для ароматазы, превращающей его в эстрадиол [15]. Тем самым, динамика стероидогенных эффектов у TP03 и ХГЧ была сходной, но ХГЧ действовал эффективнее.
Таблица 1.
Удельная масса яичников, число предовуляторных фолликулов и желтых тел у неполовозрелых самок крыс после индукции овуляции с помощью TP03 или ХГЧ
| Группа | Удельная масса яичников, %* | Количество предовуля-торных фолликулов, шт./яичник | Количество желтых тел (овулировавших фолликулов), шт./яичник |
|---|---|---|---|
| К | 0.020 ± 0.002 | Нет | Нет |
| Ф | 0.046 ± 0.004 a | 1.0 ± 0.5 | Нет |
| ФТ-4 | 0.042 ± 0.002 a | 1.8 ± 0.4 | Нет |
| ФТ-8 | 0.037 ± 0.002 a | 2.8 ± 0.6 | Нет |
| ФТ-16 | 0.065 ± 0.006 a,b | 5.6 ± 0.9 | Нет |
| ФТ-24 | 0.054 ± 0.003 a | 1.4 ± 0.7 | 8.6 ± 0.5 |
| ФГ-4 | 0.066 ± 0.005 a,b | 2.4 ± 0.5 | Нет |
| ФГ-8 | 0.059 ± 0.010 a | 3.2 ± 0.4 | Нет |
| ФГ-16 | 0.078 ± 0.005 a,b | 7.0 ± 0.8 | 0.8 ± 0.5** |
| ФГ-24 | 0.060 ± 0.004 a,b | Нет | 16.6 ± 1.2 |
*Удельную массу яичников рассчитывали, как соотношение суммы масс левого и правого яичников к общей массе тела (в %). ** – у двух из 5 крыс выявлено по 2 овуляторных фолликула, у остальных они отсутствовали. Различия значимы при p < 0.05: a – с группой К, b – с группой Ф. Данные представлены как M ± SEM, n = 5 в каждой группе.
Полученные данные свидетельствуют о том, что, как и в случае стимуляции тестикулярного стероидогенеза [7, 8], эффект аллостерического агониста TP03 на овариальный стероидогенез является более умеренным в сравнении с ХГЧ, а активность TP03, как индуктора овуляции, выражена в меньшей степени. Однако это имеет определенные преимущества, поскольку позволяет избежать СГЯ, истощения овариального резерва и снижения качества яйцеклеток, которые часто встречаются при использовании ХГЧ [1]. Для сравнительного изучения возможных рисков развития СГЯ при применении TP03 и ХГЧ в яичниках оценивали экспрессию генов VegfA и VegfB, кодирующих VEGF-A и VEGF-B, которые могут являться индукторами СГЯ [11]. Показано, что экспрессия VegfA и VegfB в группе Ф с обработкой одним Фоллимагом снижалась (рис. 2). TP03 и ХГЧ слабо влияли на сниженную в группе Ф экспрессию гена VegfA, за исключением временного интервала 24 ч, когда оба агониста подавляли ее в еще большей степени (рис. 2а). В случае экспрессии гена VegfB ситуация была иной. ХГЧ вызывал значительную ее стимуляцию в сравнении с группой Ф, в то время как TP03 влиял на экспрессию VegfB в небольшой степени, значимо повышая ее только у крыс группы ФТ-16 (рис. 2б). Эти данные свидетельствуют о том, что ХГЧ, несмотря на используемую в нашем исследовании сравнительно невысокую дозу препарата, в течение суток после введения поддерживает высокий уровень экспрессии VEGF-B. Это, в совокупности с более высокой удельной массой яичников на протяжении эксперимента, указывает на существенные риски развития СГЯ, которые часто встречаются при использовании гонадотропинов для контролируемой индукции овуляции [1]. В свою очередь, TP03 существенно не влиял на экспрессию VEGF-B, что может свидетельствовать о низкой ве-роятности развития СГЯ.
Рис. 1.
Изменение содержания прогестерона (а) и эстрадиола (б) в крови неполовозрелых самок крыс в течение 24 ч после введения индукторов овуляции – TP03 и ХГЧ.
В контрольной группе концентрация прогестерона в крови составила 20.9 ± 3.7 нМ, эстрадиола – 0.19 ± ± 0.03 нМ. В опытных группах образцы сыворотки крови получали через 48 ч после стимуляции фолликулогенеза (группа Ф, точка 0) и затем через 4, 8, 16 и 24 ч после индукции овуляции ТР03 (группы ФТ-4, ФТ-8, ФТ-16, ФТ-24) или ХГЧ (группы ФГ-4, ФГ-8, ФГ-16, ФГ-24). Различия значимы при p < 0.05: a – с группой К, b – с группой Ф. Данные представлены как M ± SEM, n = 5 в каждой группе.
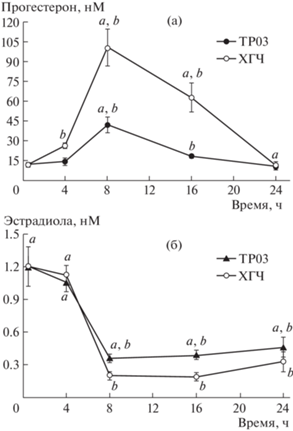
Рис. 2.
Экспрессия генов VegfA (а) и VegfB (б), кодирующих изоформы A и B фактора роста эндотелия сосудов, в яичниках неполовозрелых крыс, и влияние на них индукторов овуляции – TP03 и ХГЧ.
В контрольной группе экспрессия генов VegfA и VegfB в яичниках составила 1.03 ± 0.09 и 1.04 ± 0.08 отн. ед., соответственно. В опытных группах ткани яичников получали через 48 ч после стимуляции фолликулогенеза (группа Ф, точка 0) и затем через 4, 8, 16 и 24 ч после индукции овуляции ТР03 (группы ФТ-4, ФТ-8, ФТ-16, ФТ-24) или ХГЧ (группы ФГ-4, ФГ-8, ФГ-16, ФГ-24). Различия значимы при p < 0.05: a – с группой К, b – с группой Ф. Данные представлены как M ± SEM, n = 5 в каждой группе.

Таким образом, нами впервые показано, что TP03, агонист рецептора ЛГ/ХГЧ, взаимодействующий с его трансмембранным аллостерическим сайтом, как и коммерческий препарат ХГЧ, взаимодействующий с внеклеточным ортостерическим сайтом рецептора, характеризуется способностью стимулировать продукцию прогестерона и индуцировать овуляцию у неполовозрелых самок крыс. При этом TP03 в сравнении с ХГЧ действовал на яичники более мягко, в меньшей степени повышая уровень прогестерона в крови и приводя к образованию вдвое меньшего числа желтых тел. В то же время TP03, в отличие от ХГЧ, не вызывал повышения экспрессии гена VEGF-B в яичниках, что минимизирует вероятность развития СГЯ, ассоциированного с активацией VEGF-зависимых сигнальных путей и являющегося одним из тяжелых осложнений при использовании гонадотропинов при осуществлении контролируемой индукции овуляции во вспомогательных репродуктивных технологиях.
Список литературы
Martinez F., Racca A., Rodríguez I., et al. Ovarian stimulation for oocyte donation: a systematic review and meta-analysis // Hum Reprod Update. 2021. V. 27. P. 673–696.
Riccetti L., Yvinec R., Klett D., et al. Human Luteinizing Hormone and Chorionic Gonadotropin Display Biased Agonism at the LH and LH/CG Receptors // Sci Rep. 2017. V. 7. P. 940.
Casarini L., Simoni M. Recent advances in understanding gonadotropin signaling // Fac Rev. 2021. V. 10. P. 41.
Jiang X., Dias J.A., He X. Structural biology of glycoprotein hormones and their receptors: insights to signaling // Mol Cell Endocrinol. 2014. V. 382. P. 424–451.
van Koppen C.J., Zaman G.J., Timmers C.M., et al. A signaling-selective, nanomolar potent allosteric low molecular weight agonist for the human luteinizing hormone receptor // Naunyn Schmiedebergs Arch Pharmacol. 2008. V. 378. P. 503–514.
Nataraja S.G., Yu H.N., Palmer S.S. Discovery and Development of Small Molecule Allosteric Modulators of Glycoprotein Hormone Receptors // Front Endocrinol (Lausanne). 2015. V. 6. P. 142.
Bakhtyukov A.A., Derkach K.V., Gureev M.A., et al. Comparative Study of the Steroidogenic Effects of Human Chorionic Gonadotropin and Thieno[2,3-D]pyrimidine-Based Allosteric Agonist of Luteinizing Hormone Receptor in Young Adult, Aging and Diabetic Male Rats // Int J Mol Sci. 2020. V. 21. P. 7493.
Bakhtyukov A.A., Derkach K.V., Sorokoumov V.N., et al. The Effects of Separate and Combined Treatment of Male Rats with Type 2 Diabetes with Metformin and Orthosteric and Allosteric Agonists of Luteinizing Hormone Receptor on Steroidogenesis and Spermatogenesis // Int J Mol Sci. 2021. V. 23. P. 198.
van de Lagemaat R., Timmers C.M., Kelder J., et al. Induction of ovulation by a potent, orally active, low molecular weight agonist (Org 43553) of the luteinizing hormone receptor // Hum Reprod. 2009. V. 24. P. 640–648.
Gerrits M., Mannaerts B., Kramer H., et al. First evidence of ovulation induced by oral LH agonists in healthy female volunteers of reproductive age // J Clin Endocrinol Metab. 2013. V. 98. P. 1558–1566.
Fang L., Li Y., Wang S., et al. TGF-β1 induces VEGF expression in human granulosa-lutein cells: a potential mechanism for the pathogenesis of ovarian hyperstimulation syndrome // Exp Mol Med. 2020. V. 52. P. 450–460.
Быков В.Л., Юшканцева С.И. Гистология, цитология и эмбриология. М.: Издательская группа “ГЭОТАР-Медиа”; 2018. [Bykov V.L., Yushkanceva S.I. Gistologiya, citologiya i embriologiya. M.: Izdatel’skaya gruppa “GEOTAR-Media”; 2018. (In Russ.)]
Gao X., Greenbaum L.M., Mahesh V.B., et al. Characterization of the kinin system in the ovary during ovulation in the rat // Biol Reprod. 1992. V. 47. P. 945–951. https://doi.org/10.1095/biolreprod47.6.945
Duggal P.S., Van Der Hoek K.H., Milner C.R., et al. The in vivo and in vitro effects of exogenous leptin on ovulation in the rat // Endocrinology. 2000. V. 141. P. 1971–1976.
Stevenson P.M., Klinken S.P., Boyne P., et al. Identification of the enzymic control point in “de-differentiation” of oestrogen synthesis in superovulated rat ovary // Biochim Biophys Acta. 1982. V. 713. P. 251–259.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


