Доклады Российской академии наук. Науки о жизни, 2023, T. 508, № 1, стр. 23-29
СИНТЕЗ МЕЧЕННОГО ДЕЙТЕРИЕМ ПИРРОЛИЛКАРНОЗИНА
В. П. Шевченко 1, *, И. Ю. Нагаев 1, Т. Н. Федорова 2, академик РАН Н. Ф. Мясоедов 1
1 Федеральное государственное бюджетное учреждение Институт молекулярной генетики Национального исследовательского центра “Курчатовский институт” (НИЦ “Курчатовский институт” – ИМГ)
123182 Москва, Россия
2 Федеральное государственное бюджетное
научное учреждение “Научный центр неврологии” (ФГБНУ НЦН)
125367 Москва, Россия
* E-mail: nagaev@img.ras.ru
Поступила в редакцию 25.09.2022
После доработки 15.10.2022
Принята к публикации 15.10.2022
- EDN: MUUVDR
- DOI: 10.31857/S2686738922700020
Аннотация
Изучено влияние температуры на эффективность введения дейтерия в пирролилкарнозин (ПК). В качестве источника дейтерия использовали газообразный дейтерий и тяжелую воду. Изотопный обмен проводили при использовании твердофазного и жидкофазного методов. Установлено, что для получения препаративных количеств меченого пирролилкарнозина лучше применять изотопный обмен с дейтериевой водой. При использовании твердофазного метода основная метка находится в пирроле. Включение дейтерия при более высокой температуре происходит более равномерно. Кроме того, использование дейтериевой воды позволило снизить количество немеченого изотопомера практически до 0% и получить препарат с выходом 70% и содержанием более 7 атомов дейтерия. Установлено, что содержание атомов дейтерия в веществе можно увеличить, проведя предварительную обработку реакционной смеси газообразным дейтерием. Этот подход открывает дополнительные возможности при получении высокомеченных соединений.
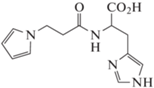
ПК (3-(1H-имидазол-5-ил)-2-(3-пиррол-1-ил-пропаноиламино) пропановая кислота) – новое перспективное соединение, синтезированное на основе карнозина и пиррола с учетом их биологических свойств [1].
Нейропротекторная эффективность дипептида карнозина (бета-аланил-L-гистидин), обусловленная его широким спектром биологического действия, включая антиоксидантное, представлена в различных экспериментальных моделях паркинсонизма и ишемии головного мозга, а также в пилотных клинико-биохимических исследованиях [2]. Однако значимым фактором, лимитирующим выход карнозина в практическую медицину в виде лекарственной формы, является его быстрый гидролиз в кровяном русле под действием специфического фермента – сывороточной карнозиназы. Одним из способов защиты карнозина от гидролиза является синтез конъюгатов с другими биологически активными молекулами [3]. Производные второго компонента нового соединения – пиррола (ароматического пятичленного азотистого гетероцикла) нашли широкое применение при синтезе терапевтически активных соединений, включая фунгициды, антибиотики, противоопухолевые средства, нестероидные противовоспалительные препараты [4–6], а также пирацетам, характеризующийся нейротропным и нейропротекторным действием и входящий в перечень жизненно необходимых и важнейших лекарственных препаратов РФ.
По исследованным физико-химическим характеристикам новосинтезированное соединение ПК описывается следующей структурной формулой, подтвержденной данными ЯМР-спектроскопии и масс-спектрометрии высокого разрешения [1]:
Молекулярная масса ПК, определенная методом масс-спектрометрии высокого разрешения, составила 276 г/моль. Полученное в результате флэш-хроматографии вещество обладало чистотой 99% (ЯМР), по данным ВЭЖХ подтвержденная чистота ПК превышала 99% [1].
ПК характеризуется высокой устойчивостью к гидролизу сывороточной карнозиназой: в течение 3 ч он практически не подвергался гидролизу, тогда как карнозин гидролизовался за 1 ч на 86% и полностью в течение 3 ч [1].
Антиоксидантная активность ПК, измеренная на модели инициируемого ионами Fe2+ перекисного окисления выделенных из сыворотки крови липопротеинов (ЛП), была сопоставима с действием карнозина, а в ряде случаев превышала его эффективность [1].
По данным МТТ-теста ПК не проявлял собственной токсичности при инкубации культуры нейробластомы человека SH-SY5Y, дифференцированной по дофаминергическому типу, в широком диапазоне концентрации в среде культивирования (100, 500, 1000 мкМ, и 2.5, 5.0, 10 мМ) [1].
В условиях окислительного стресса, индуцированного 2,2'-азобис(2-метилпропионамидин) дигидрохлоридом (ААРН) на культуре клеток SH-SY5Y, пирролилкарнозин при его внесении в культуральную среду (в концентрации 10, 50, 250, 500, 1000 мкМ), начиная с концентрации 10 мкМ, увеличивал выживаемость клеток на 10–15% (по данным МТТ-теста) [1].
При моделировании ишемии мозга in vitro с использованием модели глюкозо-кислородной депривации (ГКД) на первичной культуре клеток коры больших полушарий мозга крыс ПК в концентрациях 100, 200, 500 и 1000 мкМ при инкубации с ним культуры во время 4 ч ГКД и 24 ч реоксигенации на 10–12% повышал жизнеспособность нейронов (по данным МТТ-теста) и на 20–25% снижал долю погибших клеток (по данным ЛДГ-теста) [1].
В условиях NMDA-индуцированной эксайтотоксичности ПК, внесенный в культуральную среду в концентрациях 200, 500 и 1000 мкМ по данным ЛДГ-теста снижал гибель нейронов культуры коры больших полушарий мозга крыс на 43.8, 46.3 и 43.3%.
Целью данной работы было получение препаративных количеств меченого ПК с содержанием дейтерия более 2 атомов.
Дейтерированные производные низкомолекулярных веществ являются наиболее оптимальными внутренними стандартами для масс-спектрометрического анализа. Дейтерированное производное не отличается по полярности и липофильности от целевого соединения и при пробоподготовке ведет себя аналогично целевому соединению. В то же время отличие по молекулярной массе позволяет измерять хроматограммы указанных веществ независимо.
Нормировка площади пика аналита на площадь хроматографического пика внутреннего стандарта позволяет компенсировать влияние потерь при извлечении целевого соединения из биологического образца, а также нивелирует возможные природные флуктуации при масс-спектрометрическом анализе. В целом применение дейтерированных стандартов существенно снижает ошибку метода и повышает точность и надежность количественного масс-спектрометрического анализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Катализаторы, реагенты и растворители – коммерческие препараты: катализатор 5% Pd/Al2O3 (Merck (США), х.ч.); носитель Al2O3 (Merck (США), размер ≤10 мкм, чистота 99%). Пирролилкарнозин получен из Федерального государственного бюджетного научного учреждения “Научный центр неврологии”.
Для введения дейтерия в ПК использовали методы, применяемые для получения меченых соединений [7–12]. Наиболее перспективным считается проведение изотопного обмена в присутствии гетерогенных катализаторов, а в качестве источника дейтерия газообразный дейтерий или дейтериевая вода. Для оптимизации методики введения изотопа использовали ПК, который наносили на Al2O3, с последующим механическим перемешиванием этой смеси с 5% Pd/Al2O3. Такую смесь можно было обрабатывать и газообразным дейтерием и дейтериевой водой. В первом случае реализовывался твердофазный метод, во втором – жидкофазный. ПК прекрасно растворим в воде. Поэтому при использовании дейтериевой воды пептид переходил в раствор и изотопный обмен происходил при взаимодействии молекул вещества с D2О в присутствии катализатора.
Включение дейтерия в ПК контролировали масс-спектрометрическим методом на приборе LCQ Advantage MAX (Термоэлектрон, США) типа квадрупольная ионная ловушка, с ионизацией электрораспылением, детектированием масс-спектров в отрицательно заряженных ионах и прямым вводом раствора образца с концентрацией 10 мкг/мл в метаноле.
При нагревании пептида, нанесенного на катализатор, без использования растворителя, как правило, удается получить соединения с большим содержанием изотопа водорода. Но многие соединения оказываются недостаточно устойчивыми в условиях реакции и выход становится неудовлетворительным. В этих случаях пептид наносят на носитель и смешивают с катализатором [9]. ПК наносили на оксид алюминия (1: 100) и растирали с 5% Pd/Al2O3 при соотношении катализатор-вещество 5: 1. На первом этапе реакцию проводили при 150°C, 175°C, 200°C и 225°C (15 мин, давление D2 400 гПа) (табл. 1). ПК из реакционной смеси экстрагировали водным метанолом (МеОН-Н2О 1:2). Для этого в центрифужную пробирку с пробой добавляли 0.1 мл раствора, затем использовали шейкер и центрифугу. Экстракт анализировали масс-спектрометрически и на хроматографе Милихром А-02, колонка ProntoSIL-120-5-C18 AQ (2 × 75 мм, размер частиц 5 мкм). Температура колонки 35°С. Длина волны 210 нм. Элюент А – 0.1% уксусная кислота, элюент Б – метанол, линейный градиент от 0 до 70% Б за 12.5 мин. Скорость подачи элюента 200 мкл/мин. Время удерживания пирролилкарнозина 4.8 мин.
Таблица 1.
Распределение дейтерия по изотопомерам в меченом ПК при различной температуре (изотопный обмен с газообразным дейтерием, соотношение в смеси 5% Pd/Al2O3–Al2O3-ПК равно 5:100:1)
| Изотопомеры | Температура, °С Распределение дейтерия по изотопомерам, в % |
|||
|---|---|---|---|---|
| 150°C | 175°C | 200°C | 225°C | |
| D0 | 2.41 | 2.08 | 0.88 | 1.56 |
| D1 | 1.67 | 0.66 | 1.04 | 1.72 |
| D2 | 3.76 | 1.45 | 2.18 | 3.64 |
| D3 | 11.91 | 5.24 | 2.60 | 3.36 |
| D4 | 30.43 | 15.67 | 6.33 | 6.11 |
| D5 | 37.73 | 32.72 | 10.75 | 10.00 |
| D6 | 11.15 | 30.67 | 19.14 | 14.49 |
| D7 | 0.83 | 9.26 | 28.70 | 13.80 |
| D8 | 0.16 | 1.55 | 18.46 | 16.20 |
| D9 | – | 0.62 | 6.98 | 8.44 |
| D10 | – | 0.15 | 1.14 | 6.81 |
| D11 | – | – | 0.93 | 6.73 |
| D12 | – | – | 0.73 | 4.81 |
| D13 | – | – | 0.18 | 2.36 |
| *∑D | 4.29 ± 0.11 (0.84 ± 0.05) | 5.14 ±0.14 (1.40 ± 0.07) | 6.51 ± 0.2 (2.53 ± 0.12) | 7.13 ± 0.5 (2.92 ± 0.33) |
| Выход, % | 62 ± 5 | 30 ± 3 | 10 ±3 | 6 ±2 |
Полученные данные показали, что дейтерий, главным образом, включался в пиррол. При повышении температуры от 150°C до 225°C включение дейтерия в гистидин увеличивалось от 20% до 41%, т.е. при повышении температуры распределение дейтерия становилось более равномерным. Установлено, что при повышении температуры наблюдалась значительная деградация ПК, и в масс-спектрах появлялся пик продукта деградации с m/z в районе 218. По-видимому, происходило разрушение ароматических фрагментов. При 175°C в продуктах реакции ПК доминирует, а относительное содержание продукта деградации составляет около 30%, при 200°C доминирует уже продукт деградации, а содержание ПК составляет около 30%, при 225°C относительное содержание ПК падает до ~10%.
Как следует из полученных данных (табл. 1), содержание дейтерия высокое, но выход для препаративного синтеза желательно увеличить. Для этого использовали два подхода. Первый, изменение содержания Al2O3 в реакционной смеси относительно ПК (табл. 2). Второй, реакцию проводили не в атмосфере дейтерия, а с дейтериевой водой (табл. 3).
Таблица 2.
Эффективность изотопного обмена с газообразным дейтерием и устойчивость ПК при разных температурах (отношение в смеси 5% Pd/Al2O3–Al2O3-ПК 5:20:1)
| Изотопомеры | Температура, °C Распределение дейтерия по изотопомерам, в % |
|||
|---|---|---|---|---|
| 125°C | 150°C | 175°C | 200°C | |
| D0 | 0.50 | 0.27 | 0.12 | 0.68 |
| D1 | 5.73 | 0.60 | 0.45 | 0.72 |
| D2 | 28.03 | 1.72 | 1.10 | 2.75 |
| D3 | 40.20 | 6.09 | 2.04 | 3.13 |
| D4 | 20.89 | 22.58 | 6.31 | 6.18 |
| D5 | 4.21 | 45.34 | 22.28 | 8.87 |
| D6 | 0.58 | 21.23 | 40.58 | 17.29 |
| D7 | – | 2.19 | 21.53 | 24.75 |
| D8 | – | – | 4.38 | 21.14 |
| D9 | – | – | 1.00 | 9.07 |
| D10 | – | – | 0.27 | 1.60 |
| D11 | – | – | – | 1.71 |
| D12 | – | – | – | 1.64 |
| D13 | – | – | – | 0.56 |
| *∑D | 2.90 ± 0.1 (0.48 ± 0.03) | 4.82 ± 0.14 (1.22 ± 0.05) | 5.86 ± 0.19 (1.95 ± 0.08) | 6.74 ± 0.32 (2.83 ±0.18) |
| Выход | 90 ± 6 | 76 ± 6 | 28 ± 4 | 6 ± 2 |
Таблица 3.
Изотопный обмен дейтериевой воды со смесью 5% Pd/Al2O3–Al2O3-ПК (5:20:1)
| Изотопомеры | Температура, °C Распределение дейтерия по изотопомерам, в % |
|||||
|---|---|---|---|---|---|---|
| 125°C | 150°C | 175°C | ||||
| D0 | 0.03* | 0.06** | 0.03* | 0.05** | –* | 0.02** |
| D1 | 0.11 | 0.41 | 0.04 | 0.095 | 0.04 | 0.12 |
| D2 | 1.04 | 3.92 | 0.28 | 1.075 | 0.21 | 0.88 |
| D3 | 5.40 | 16.90 | 2.11 | 7.94 | 0.87 | 6.18 |
| D4 | 15.68 | 41.07 | 8.94 | 30.50 | 4.12 | 24.48 |
| D5 | 20.92 | 36.72 | 19.04 | 57.25 | 11.85 | 46.85 |
| D6 | 15.52 | 0.86 | 16.99 | 3.03 | 18.93 | 18.41 |
| D7 | 14.69 | 0.05 | 15.37 | 0.08 | 21.22 | 2.57 |
| D8 | 14.47 | 0.03 | 16.38 | – | 21.00 | 0.53 |
| D9 | 9.08 | – | 11.61 | – | 12.83 | 0.01 |
| D10 | 3.54 | – | 6.68 | – | 6.35 | – |
| D11 | 0.03 | – | 2.12 | – | 1.88 | – |
| D12 | – | – | 0.39 | – | 0.59 | – |
| D13 | – | – | 0.02 | – | 0.12 | – |
| ∑D | 6.14 ± 0.14 | 4.12 ± 0.13 | 6.78 ± 0.15 | 4.53 ± 0.11 | 7.17 ± 0.14 | 4.85 ± 0.10 |
| ∑DHis | 1.71 ± 0.06 | 0.92 ± 0.05 | 2.00 ± 0.06 | 0.96 ± 0.06 | 2.12 ± 0.08 | 1.23 ± 0.07 |
| (∑D – ∑DHis) | 4.43 ±0.18 | 3.2 ± 0.017 | 4.78 ± 0.2 | 3.57 ± 0.17 | 5.05 ± 0.21 | 3.62 ± 0.15 |
| Выход, % | 89 ± 6 | 98 ± 7 | 89 ± 7 | 96 ± 6 | 84 ± 8 | 94 ± 9 |
Выход [D]ПК при 150°C в первой серии экспериментов был приемлемым для получения препаративных количеств. Поэтому и при использовании меньшего количества Al2O3 изотопный обмен проводили при 150°С. При этой температуре включение дейтерия и выход ПК принципиально не изменились. Таким образом, проведение реакции при 150–170°C в течение 15 мин для получения препаративных количеств [D]ПК и в этом случае является целесообразным (табл. 2).
Масштабирование экспериментов при твердофазном методе введения дейтерия, т.е. пропорциональное увеличение количества вещества и газообразного дейтерия, связано с определенными трудностями. А изменение соотношения количества вещества и газообразного дейтерия может привести к значительному падению содержания изотопа в препарате. При использовании дейтериевой воды обеспечить соответствующее масштабирование намного проще. Обеспечить отношение обменивающихся протонов к количеству дейтериевой воды как 1:50 или даже к 1:100 не составляет труда. Поэтому провели опыты с использованием дейтериевой воды.
При проведении изотопного обмена с дейтериевой водой использовали ту же смесь – 5% Pd/Al2O3–Al2O3-ПК (5:20:1) (табл. 3). Эту смесь, содержащую около 0.5 мг ПК, помещали в стеклянную ампулу, вносили 50 мкл дейтериевой воды. Затем ампулу запаивали и помещали в термостат. Реакцию вели 15 мин (табл. 3). После окончания реакции водный слой упаривали. Остаток растворяли в 0.1 мл смеси МеОН–Н2О (1:2) и анализировали, как описано выше.
При этом оказалось, что при использовании дейтериевой воды выход и содержание дейтерия в ПК гораздо меньше зависят от температуры по сравнению с использованием твердофазного метода. Можно предположить, что 3–4 атома дейтерия входят в пирроловый фрагмент из дейтериевой воды и только сверх этого количества дейтерий включается в остальную часть ПК. То есть изменения условий реакции (табл. 3) касаются только небольшого вклада в изотопный обмен в случае ПК.
Совсем другая ситуация наблюдалась, если предварительно выдержать смесь Al2O3-5% Pd/Al2O3-ПК (20:5:1), в атмосфере газообразного дейтерия для насыщения носителя активированными частицами дейтерия. Затем в ампулу с обработанной смесью вносили дейтериевую воду, продували аргоном, запаивали и нагревали в термостате 15 мин (табл. 3). Включение дейтерия резко возрастало. Таким образом, при использовании данной методики наблюдается значительный эффект активации изотопного обмена. При этом нужно подчеркнуть, что во время выдерживания пептида, нанесенного на катализатор, при комнатной температуре в атмосфере дейтерия, включения изотопа в его молекулы не наблюдается.
Можно предположить, что включение дейтерия в ароматические фрагменты ПК (пиррол и гистидин) идут параллельно, но с разной скоростью.
По данным табл. 3 видно, что при использовании неактивированного катализатора включение дейтерия изменяется мало. Происходит включение дейтерия в пиррольный фрагмент около 3.20 атома при 125°C, 3.57 атома при 150°C, 3.62 атома при 175°C, т.е. изменение включения дейтерия в этот фрагмент при повышении температуры невелико и, что самое главное, относительный рост содержания дейтерия в ПК имеет тенденцию к уменьшению. Включение дейтерия в гистидин, наоборот, имеет тенденцию к росту. При переходе от 125°C к 150°C увеличение содержания дейтерия в гистидине – 4%, при переходе от 150°C к 175°C – 22%.
При использовании активированного катализатора наблюдается практически полный обмен протия на дейтерий в пиррольном фрагменте. Увеличение содержания дейтерия в гистидине имеет тенденцию к уменьшению. При переходе от 125°С к 150°С увеличение содержания дейтерия в гистидине – 15%, от 150°С к 175°С – 6%. Таким образом, при использовании активированного катализатора итоговый изотопный обмен возрастает, но со временем эффективность его понижается. По-видимому, активированные частицы дейтерия, сольватированные на Al2O3 [9], инициируют увеличение изотопного обмена во всех фрагментах молекул ПК, что позволяет поднять содержание дейтерия в ПК в среднем на треть (схема 1).
Схема 1. Включение дейтерия изотопным обменом с дейтериевой водой при наличии кислотных центров на катализаторе.
Препаративный синтез проводили с 50 мг ПК, нанесенном на 1 г Al2O3, с последующим смешиванием с 250 мг 5% Pd/Al2O3. Смесь тщательно перетирали и переносили в ампулу. Ампулу заполняли газообразным дейтерием и выдерживали при комнатной температуре 2 ч. Затем вносили 0.5 мл дейтериевой воды, продували аргоном, и ампулу запаивали. Реакцию вели 15 мин при 160°С. После охлаждения ампулу вскрывали и [D]ПК отделяли экстракцией смесью МеОН–Н2О (1:2). Растворитель упаривали, остаток (46 мг) очищали на колонке Reprosil-pur C18aq (8 × 150 мм, размер частиц 5 мкм), скорость подачи элюента 2 мл/мин. Элюент А – вода-ТФУ (99:1), элюент Б – метанол, линейный градиент Б от 0 до 50% за 15 мин. Выход [D]ПК – 66–73%, среднее содержание дейтерия около семи атомов (рис. 1).
Таким образом, проведенная работа позволила получить меченый пептид с высоким выходом и содержанием изотопа. Включение дейтерия в гистидин составляет около 30% от теоретически возможного. Причем изотопомеры с низким содержанием дейтерия в ПК практически отсутствуют. Достижением работы также является разработка нового подхода к получению высокомеченных соединений изотопным обменом с водой с использованием катализаторов, предварительно обработанных газообразными изотопами водорода при сохранении высокого выхода.
Список литературы
Федорова Т.Н., Стволинский С.Л., Мигулин В.А., Лопачев А.В., Хуторова А.В., Куликова О.И., Музычук О.А., Абаимов Д.А. Патент № 2777391, 03.08.2022, Бюл. № 22.
Boldyrev A., Fedorova T., Stepanova M., Dobrotvorskaya I., Kozlova E., Boldanova N., Bagyeva G., Ivanova-Smolenskaya I., Illarioshkin S. // Rejuvenation Res. 2008. Vol. 11. № 4. P. 821–827.
Kulikova O.I., Stvolinsky S.L., Migulin V.A., Andreeva L.A., Nagaev I.Yu., Lopacheva O.M., Kulichenkova K.N., Lopachev A.V., Trubitsina I.E., Fedorova T.N. // Daru. 2020. Vol. 28. P. 119–130.
Adams S.P., Tsang M., Wright J.M. // Cochrane Database Syst. Rev. 2015.
Bhardwaj V., Gumber D., Abbot V., Dhiman S., Sharma P. // RSC Adv. 2015. Vol. 5. № 20. P. 15233–15266.
Каратеев А.Е. // Современная ревматология. 2014. Т. 8. № 2. С. 83–89.
Toth G., Mallareddy J.R., Toth F., Lipkowski A.W., Tourwe D. // Arkivoc. 2012. Vol. 2012. № 5. P. 163–174.
Rees A.T. // J. Labelled Compd. Radiopharm. 2004. Vol. 47. № 5. P. 318–319.
Voges R., Heys J.R., Moenius T. “Preparation of Compounds Labeled with Tritium and Carbon-14” United Kingdom: John Wiley & Sons. Ltd. 2009. 664 p.
Stack D.E., Eastman R. // J. Label. Compd. Radiopharm. 2016. Vol. 59. № 12. P. 500–505.
Lockley W.J.S., Hesk D. // J. Label. Compd. Radiopharm. 2010. Vol. 53. № 11–12. P. 704–715.
Lockley W.J.S. // Tetrahedron Lett. 1982. Vol. 23. № 37. P. 3819–3822.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни