Доклады Российской академии наук. Науки о жизни, 2023, T. 508, № 1, стр. 48-52
СИНЕРГИЧЕСКИЙ ЭФФЕКТ КОМБИНИРОВАННОГО ДЕЙСТВИЯ ТАРГЕТНОЙ И ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ В ОТНОШЕНИИ HER2-ПОЛОЖИТЕЛЬНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
И. В. Балалаева 1, *, Л. В. Крылова 1, М. А. Карпова 1, А. А. Шульга 2, Е. В. Коновалова 2, Е. Л. Гурьев 1, академик РАН С. М. Деев 2, 3, **
1 Нижегородский государственный университет
им. Н.И. Лобачевского
Нижний Новгород, Россия
2 Институт биоорганической химии
им. акад. М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
3 Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России
Москва, Россия
* E-mail: irin-b@mail.ru
** E-mail: biomem@mail.ru
Поступила в редакцию 10.10.2022
После доработки 25.10.2022
Принята к публикации 25.10.2022
- EDN: MUGOWP
- DOI: 10.31857/S268673892270007X
Аннотация
Перспективной стратегией по повышению эффективности противоопухолевой терапии является разработка комбинированных схем лечения онкологических заболеваний. В работе показана принципиальная возможность многократного усиления противоопухолевого действия при комбинировании таргетной и фотодинамической терапии. Продемонстрировано, что последовательная обработка клеток HER-2 положительного рака молочной железы таргетным токсином DARPin-LoPE и фотоактивным соединением фотодитазином приводит к многократному синергическому усилению их эффекта. В перспективе такой подход призван обеспечить достижение максимального терапевтического эффекта при минимизации рисков негативных побочных эффектов.
Рак молочной железы (РМЖ) является наиболее распространенным онкологическим заболеванием среди женщин [1]. При лечении данного заболевания широко используется лекарственная терапия, однако традиционные химиопрепараты зачастую демонстрируют недостаточную терапевтическую эффективность и высокую системную токсичность. Достижения в области молекулярной биологии способствовали созданию более эффективного и прецизионного подхода к лечению онкологических заболеваний – таргетной терапии. Таргетная терапия основана на применении агентов, специфически взаимодействующих с определенными молекулярными мишенями опухолевой клетки, что приводит к остановке пролиферации и распространения опухоли [2, 3].
Примерно 30% случаев РМЖ характеризуются сверхэкспрессией рецептора эпидермального фактора роста человека 2 (HER-2, от англ. Human Epidermal growth factor Receptor 2), связанного со злокачественной трансформацией клеток [4]. Для лечения данного подтипа рака в настоящее время в клинике применяются таргетные препараты на основе моноклональных антител, скаффолдов и их конъюгатов (трастузумаб, пертузумаб, TDM1 и др.) и низкомолекулярный ингибитор (лапатиниб) [5, 6]. Важнейшим исследовательским направлением является разработка рекомбинантных белковых агентов, в которых в единую полипептидную цепь объединены направляющий белок и фрагмент токсина растительного или бактериального происхождения. Селективное действие таких таргетных токсинов в отношении опухолевых клеток очень высоко, существует точка зрения, согласно которой для гибели клетки достаточно поступления в нее единичных молекул токсина. К таким перспективным агентам относится таргетный токсин DARPin-LoPE. Включенный в его состав белок из группы дарпинов DARPin9.29 обеспечивает высокоаффинное специфическое связывание с внеклеточным доменом HER2, цитотоксический эффект реализуется за счет низкоммуногенного фрагмента псевдомонадного экзотоксина А LoPE, который необратимо блокирует синтез белка в клетке на уровне трансляции [7, 8].
Несмотря на многочисленные достоинства таргетной терапии, ее применение в качестве монотерапевтического подхода имеет ограниченную эффективность из гетерогенности клеток опухоли и формирования ими приобретенной лекарственной устойчивости [9]. В связи с этим в последние десятилетия большинство исследований направлено на разработку комбинированных терапевтических подходов, подразумевающих сочетанное или последовательное применение нескольких, различных по механизму действия, терапевтических агентов. В результате комбинации могут наблюдаться аддитивный или синергический эффект при сниженной терапевтической дозе каждого индивидуального компонента [10, 11]. В качестве одной из таких схем рассматривается комбинация таргетной терапии и фотодинамической терапии (ФДТ). Привлекательность ФДТ для исследователей заключается в минимальной инвазивности и низкой токсичности в отношении нормальных клеток. Терапевтический эффект ФДТ основан на взаимодействии фотоактивного вещества, или фотосенсибилизатора, в возбужденном состоянии и молекулярного кислорода, которое приводит к образованию активных форм кислорода (АФК). В результате избыточной продукции АФК в клетке-мишени происходит запуск окислительного стресса и последующей гибели [12–14].
В данной работе мы исследовали терапевтический потенциал комбинации рекомбинантного токсина DARPin-LoPE и ФДТ в отношении HER2-положительного рака молочной железы in vitro.
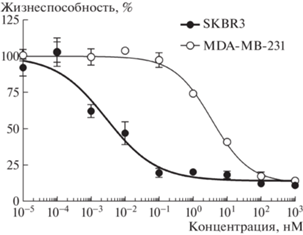
Специфическая цитотоксичность DARPin-LoPE была подтверждена путем сравнения его действия в отношении клеток аденокарциномы молочной железы человека двух линий, а именно SK-BR-3, характеризующихся сверхэкспрессией HER2, и MDA-MB-231 с очень низким уровнем представленности данного рецептора. Согласно данным проточной цитометрии с использованием специфических антител к данному рецептору, представленность HER2 в культуре клеток SK-BR-3 на три порядка выше по сравнению с MDA-MB-231.
С использованием МТТ-теста показано, что DARPin-LoPE снижает жизнеспособность клеток SK-BR-3 при крайне низких концентрациях (рис. 1). При инкубации с токсином в течение 48 ч значение полумаксимальной ингибирующей концентрации IC50 составило 2.8 пМ (95% доверительный интервал 1.4–5.7 пМ). В отношении клеток MDA-MB-231 таргетный токсин оказался существенно менее токсичным, значение IC50 составило 3.6 нМ (2.6–4.9 нМ). Высокая эффективность действия DARPin-LoPE в отношении клеток SK-BR-3, на три порядка превосходящая таковую для MDA-MB-231, по-видимому, обусловлена высокоспецифичным взаимодействием направляющего модуля (DARPin) с рецептором HER2, экспрессия которого на клетках данной линии также на три порядка выше.
Рис. 1.
Зависимость относительной жизнеспособности клеток SK-BR-3 и MDA-MB-231 от концентрации таргетного токсина DARPin-LoPE. Клетки инкубировали с токсином в течение 48 ч, затем среду заменяли полной ростовой средой. Жизнеспособность клеточных культур оценивали через 24 ч при помощи МТТ-теста.
Использование для лечения опухолей высоких концентраций рекомбинантных противоопухолевых токсинов сопряжено с риском развития серьезных побочных эффектов. В случае производных псевдомонадного экзотоксина А они связаны в первую очередь с гепатотоксичностью и кардиотоксичностью [15]. Мы полагаем, что снижение негативного влияния на нормальные ткани и органы при лечении HER2-положительного РМЖ возможно путем использования подхода, при котором терапия с относительно низкими концентрациями противоопухолевого токсина комбинируется с ФДТ. Возможность такого подхода была показана нами экспериментально.
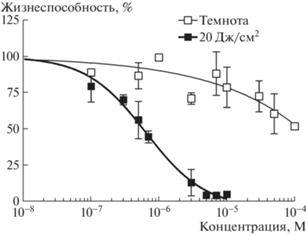
Для проведения ФДТ применялся коммерчески доступный препарат фотодитазин, или ФД (ООО ВЕТА-ГРАНД, Россия), представляющий собой бис-N-метилглюкаминовую соль хлорина е6. Исследование фотодинамической активности ФД проводилось на клеточной культуре SK-BR-3. Клетки инкубировали с ФД в течение 4 ч, а затем проводили облучение в дозе 20 Дж/см2 (32 мВт/см2, 10 мин 25 с) в спектральном диапазоне 655–675 нм при помощи светодиодного излучателя [16] в термостатируемых условиях (37°С). Фотодинамическое воздействие приводило к фотоиндуцированной гибели клеток со значением IC50 0.64 мкМ (0.44–0.95 мкМ), тогда как в отсутствие облучения жизнеспособность культуры не снижалась ниже 50% даже при концентрациях 100 мкМ ФД (рис. 2).
Рис. 2.
Зависимость относительной жизнеспособности клеток SK-BR-3 от концентрации фотодитазина в темноте и при освещении в дозе 20 Дж/см2. Клетки инкубировали с фотосенсибилизатором в течение 4 ч, затем заменяли среду полной ростовой средой. Для оценки фотодинамического воздействия клетки облучали с помощью светодиодного облучателя. Жизнеспособность клеточных культур оценивали через 24 ч при помощи МТТ-теста.
Реализация комбинированного действия таргетной и фотодинамической терапии проводилась путем последовательной обработки клеток SK-BR-3 DARPin-LoPE и фотодитазином с последующим облучением (рис. 3 а). Применение двух терапевтических агентов в дозах, приближенных к значениям IC50 (2 пМ DARPin-LoPE и 0.5 мкМ ФД), показало значительное увеличение эффективности воздействия по сравнению с монотерапевтическими вариантами. При такой обработке жизнеспособность культуры клеток не превышала 10% (рис. 3 б).
Рис. 3.
Сочетанное действие DARPin-LoPE и фотодитазина (20 Дж/см2) на клетки SK-BR-3. а – схема эксперимента по оценке сочетанного действия in vitro. Клетки инкубируются с DARPin-LoPE в течение 48 ч, после чего отмываются и инкубируются с ФД в течение 4 ч с последующим облучением в дозе 20 Дж/см2, оценка эффекта осуществляется через сутки с использованием МТТ-теста. б – относительная жизнеспособность клеток при обработке DARPin-LoPE и ФД индивидуально, а также при их комбинации в дозах, соответствующих IC50. в – кривые доза-эффект для DARPin-LoPE, ФД (20 Дж/см2) и их сочетанного воздействия; соотношение концентраций действующих веществ при всех вариантах сочетанной обработки сохранялось неизменным.

Идеальной ситуацией при использовании нескольких терапевтических агентов считается появление синергического эффекта, при котором эффективность действия комбинации агентов превосходит простую сумму эффектов индивидуальных соединений. В таком случае для достижения конечного результата, в нашем случае полной элиминации опухолевых клеток, можно использовать меньшие концентрации терапевтических агентов, что существенно снижает нагрузку на нормальные ткани и органы. Особенно актуально достижение синергизма в случае использования соединений с высоким риском развития побочных эффектов.
Для выяснения, является ли совместное действие DARPin-LoPE и ФД аддитивным или синергическим, мы провели серию экспериментов, в которых оценивали эффективность их сочетанного действия в разных концентрациях, но при сохранении одного и того же соотношения между агентами (1:250), соответствующего соотношению их IC50 (рис. 3 в). Комбинирование двух видов воздействия позволило добиться существенного снижения жизнеспособности культуры SK-BR-3 при концентрациях токсина и фотосенсибилизатора, практически нетоксичных для клеток при их использовании по отдельности. Полученные кривые доза-эффект были использованы для расчета комбинаторного индекса CI [17]. Данный индекс предназначен для определения типа лекарственного взаимодействия, значения CI в диапазоне 0.9–1.1 соответствуют аддитивному эффекту, тогда как CI < 0.9 свидетельствует о синергическом усилении действия агентов. Рассчитанное значение CI для комбинации DARPin-LoPE и ФД составило 0.07, что свидетельствует о значительном синергическом эффекте при их совместном применении.
Мы полагаем, что данный эффект обусловлен особенностями действия исследованных агентов. Предобработка клеток таргетным токсином DARPin-LoPE приводит к блокаде синтеза белка в клетках-мишенях, в том числе белков системы антиоксидантной защиты, репарации ДНК и ферментов, участвующих в поддержании липидного состава мембран. Такое ингибирование белкового синтеза многократно повышает чувствительность клеток к последующему фотодинамическому воздействию, эффект которого в первую очередь связан с накоплением в клетке окислительных повреждений. Стоит отметить, что сенсибилизация к фотодинамическому воздействию была также показана в отношении низкомолекулярных ингибиторов рецепторных тирозинкиназ [18] и терапевтических моноклональных антител [19]. Это подтверждает перспективность подхода, основанного на комбинировании таргетной и фотодинамической терапии.
В настоящей работе показана принципиальная возможность повышения эффективности лечения HER2-положительного рака молочной железы путем комбинирования таргетной терапии с использованием рекомбинантного токсина DARPin-LoPE и фотодинамической терапии с фотодитазином. Предлагаемый подход обеспечивает высокоэффективную элиминацию опухолевых клеток за счет значительного синергического эффекта двух действующих агентов. В перспективе такой подход должен обеспечить возможность достижения требуемого терапевтического эффекта при использовании относительно невысоких доз действующих веществ и снижение вероятности развития негативных побочных эффектов.
Список литературы
Harbeck N., Penault-Llorca F., Cortes J., et al. // Nature Reviews Disease Primers. 2019. V. 5. № 66.
Gerber D.E. // American Family Physician. 2008. V. 77. № 3. P. 311–319.
Padma V.V. // Biomedicine (Taipei). 2015. V. 5. № 4. P. 19.
Iqbal N., Iqbal N. // Molecular Biology International. 2014.
Higgins M.J., Baselga J. // Journal of Clinical Investigation. 2011. V. 121. № 10. P. 3797–3803.
Tolmachev V.M., Chernov V.I., Deyev S.M. // Russ. Chem. Rev. 2022. V. 91. RCR5034.
Sokolova E.A., Shilova O.N., Kiseleva D.V., et al. // International Journal of Molecular Sciences. 2019. V. 20. № 10.
Shapira A., Benhar I. // Toxins (Basel). 2010. V. 2. № 11. P. 2519–2583.
Sabnis A.J., Bivona T.G. // Trends in Molecular Medicine. 2019. V. 25. №3. P. 185–197.
Plana D., Palmer A.C., Sorger P.K. // Cancer Discovery. 2022. V. 12. № 3. P. 606–624.
Boshuizen J., Peeper D.S. // Molecular Cell. 2020. V. 78. № 6. P. 1002–1018.
Agostinis P., Berg K., Cengel K.A. et al. // CA: A Cancer Journal for Clinicians. 2011. V.61. №4. P. 250–281.
Shramova E.I., Chumakov S.P., Shipunova V.O., et al. // Light Sci. Appl. 2022. V. 11. № 1. P. 38.
Mishchenko T., Balalaeva I., Gorokhova A., et al. // Cell Death & Disease. 2022. V. 13. № 5. P. 455.
Weldon J.E., Pastan I. // The FEBS Journal. 2011. V. 278. № 23. P. 4683–4700.
Shilyagina N.Y., Plekhanov V.I., Shkunov I.V. et al. // Sovremennye Tehnologii v Medicine. 2014. V. 8. P. 15–24.
Guryev E.L., Volodina N.O., Shilyagina N.Y., et al. // Proceedings of the National Academy of Sciences. 2018. V. 115. № 39. P. 9690–9695.
Chu P.L., Shihabuddeen W.A., Low K.P., et al. // Photodiagnosis and Photodynamic Therapy. 2019. V. 27. P. 367–374.
Bhuvaneswari R., Ng Q.F., Thong P.S., Soo K.C. // Oncotarget. 2015. V. 6. № 15. P. 13487–13505.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


