Доклады Российской академии наук. Науки о жизни, 2023, T. 508, № 1, стр. 53-57
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ И ВЕРОЯТНЫЕ МЕХАНИЗМЫ ДЕЙСТВИЯ ПРОИЗВОДНЫХ АЛКАЛОИДОВ ТРИПТАНТРИНА И МОСТОТРИНА
А. М. Попов 1, *, Л. Г. Деженкова 2, Т. В. Московкина 3, Н. Э. Грамматикова 2, А. С. Кузьмич 1, О. В. Черников 1, А. Е. Щекотихин 2, академик РАН В. А. Стоник 1
1 Федеральное государственное бюджетное учреждение науки Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН
Владивосток, Россия
2 Федеральное государственное бюджетное научное учреждение Научно-исследовательский институт
по изысканию новых антибиотиков им. Г.Ф. Гаузе
Москва, Россия
3 Дальневосточный Федеральный университет,
Школа наукоемких технологий и передовых материалов
Владивосток, Русский остров, бухта Аякс, 10, Россия
* E-mail: popovam@piboc.dvo.ru
Поступила в редакцию 10.10.2022
После доработки 25.10.2022
Принята к публикации 25.10.2022
- EDN: MTHALD
- DOI: 10.31857/S2686738922600807
Аннотация
Алкалоид триптантрин и его водорастворимое производное мостотрин проявляют высокую противомикробную и противоопухолевую активность. Для разработки более активных и менее токсичных препаратов были выполнены синтезы и произведено тестирование биологических активностей ряда новых и/или малоизученных их аналогов. Показано, что некоторые из них обладают более высокой цитотоксичностью в отношении опухолевых и микробных клеток, чем триптантрин и мостотрин. Так, 8-фтортриптантрин эффективно ингибирует пролиферацию различных линий опухолевых клеток, а именно: K-562/4, HCT-116 и HCT-116p53ko в более низких концентрациях, чем триптантрин, а 2,8-дифтормостотрин проявляет более сильное противомикробное действие против патогенной бактерии S. aureus ATCC 29213, чем мостотрин. Установлено, что антипролиферативные свойства 8-фтортриптантрина и 8-фтормостотрина связаны с их способностью в наномолярных концентрациях ингибировать клеточный цикл опухолевых клеток на стадии перехода с фазы G1 в S фазу. Полученные данные свидетельствуют о перспективности проведения дальнейших углубленных исследований их противоопухолевых свойств.
Алкалоид триптантрин (1а) был найден в некоторых высших растениях и микроорганизмах [1] и синтезирован несколькими способами [1–3]. Он обладает противовоспалительными, противотуберкулезными, противопаразитарными, противомикробными свойствами [2] и ингибирует репликацию короновируса [4]. Изучено также противоопухолевое действие этого вещества, а молекулярный механизм такой активности предположительно связан со способностью блокировать прогрессию и дифференциацию опухолевых клеток [5]. В составе экстрактов медицинских растений 1а применяется в медицине, например для лечения псориаза [6]. В то же время плохая биодоступность (он плохо растворим в воде и биологических жидкостях), относительно высокая токсичность и иммуносупрессорные свойства тормозят клиническое применение триптантрина. Поэтому проводится поиск его новых природных и синтетических производных и аналогов с улучшенными биологическими свойствами [1, 2].
Для решения этой задачи недавно был синтезирован его водорастворимый аналог, названный мостотрином (2а). Было показано, что (2а) является менее токсичным соединением, обладает выраженными противоопухолевыми свойствами в опытах in vivo в отношении мышиной модели асцитной карциномы Эрлиха, обеспечивая 50% выживание экспериментальные животных при монотерапии, а при сочетанном применении с известным противоопухолевым антибиотиком доксорубицином, эффектность лечебного курса достигает 100% [7].
Мы синтезировали несколько новых или мало изученных производных триптантрина и мостотрина (1б, 1в, 2б, 2в), а также аналог мостотрина на основе изатина (3) и изучили эффективность их ингибирующего действия с использованием различных культур опухолевых клеток и патогенных микроорганизмов in vitro.
Ранее известные замещенные триптантрины (1б и 1в) были получены реакцией 5-фторизатина с изатовым ангидридом при катализе триметиламином [8] и соответственно окислением 5-метилизатина KMnO4, как описано в работе [3], а идентифицированы сравнением их температур плавления и ЯМР спектров с литературными данными. Новые производные мостотрина 2б, выход 55%, т.пл. >250°С (с разл.) и 2в, выход 62%, т.пл. >255°С (с разл.) синтезированы по модифицированной методике, ранее использованной нами для получения мостотрина [7]. Строение 2б и 2в было подтверждено ИК, масс-спектрами и 1Н ЯМР спектрами. Так, в ИК спектре 2б (Vertex 70, KBr) имелись полосы поглощения, подтверждающие присутствие CO (1690 см–1), NH (~3480 cм–1) и C=N групп (~1610 см–1). В масс-спектре 2б, полученном ВЭЖХ-МС с регистрацией катионов на хромато-масс-спектрометре Agilent Technologies 6510, колонка Eclipse XDB-C18, система AcCN–H2O (7:3), имелся пик М–Cl– иона с m/z 380.1533 (ВУ 14.7 мин), рассчитано для С20H19FN5O2 380.1500. В его DEPT ЯМР спектре (D2O) присутствовали сигналы 7 ароматических СН, из них три – в виде дублетов из-за 13С–19F спин-спинового взаимодействия [9], и синглет 9 метильных групп в N(СH3)3 фрагменте при 54.2 м.д. В ИК спектре 2в имелись полосы поглощения, подтверждающие присутствие CO (1688 см–1), NH (3484 cм–1) и C=N групп (1605 см–1). В масс-спектре 2в имелся пик катиона с m/z 390,1941, рассчитано для С22H24N5O2 390.1925. В его DEPT ЯМР спектре (D2O) присутствовали сигналы 6 ароматических СН при 115.6, 120.9, 125.26, 127, 54, 132.85, 136.4 м.д., двух метильных групп в триптантриновом ядре при 19.85 и 20.28, трех метильных групп в N(CH3)3 фрагменте при 54.09 м.д. Соединение 3, выход 50%, т. пл. 248–249оС (из этанола) было получено при кипячении спиртового раствора эквимолярных количеств изатина и реактива Жирара T в присутствии ТФУ в течение 3 ч. В его ИK спектре (KBr) имелись полосы поглощения при 1690 см–1 (лактамный и амидные карбонилы), 1620 см–1 (С=N), 3426 см–1 (NH), а полоса, характерная для карбонила в пятичленном цикле исходного изатина (1740 см–1), отсутствовала. (+)ЭРИ МС высокого разрешения (Agilent 1200, колонка Eclipse, система AcCN: H2O:ТФУ, 4:1: O.1%, ВУ 9.2 мин) показал катион: 261.1357 (M-Cl–)+, вычислено для С13H17N4O2 261.1346. В DEPT спектре 2б имелись сигналы 4 СН групп в изатиновом ядре при 112.31, 121.82, 123.33, 133.45, а также N(CH3) и СH2 групп в боковой цепи при 54.40 и 62.2 м.д.
Изучение антипролиферативной активности полученных веществ и веществ сравнения (1а, 2а) было выполнено на опухолевых клетках человека различного гистогенеза с использованием МТТ-теста [7, 10]. Скрининговая панель включала следующие линии опухолевых клеток человека: карциномы молочной железы MCF-7, карциномы легкого A-549, миелоидного лимфолейкоза К-562 и его сублинии К-562/4 (с множественной лекарственной устойчивостью, вызванной экспрессией гликопротеина P), аденокарциномы толстой кишки НСТ-116 и ее резистентного штамма HCT116p53ko (c делецией гена опухолевого супрессора p53–/–), а также линию неопухолевых, клеток фибробластов человека (ПФЧ) для сравнения жизнеспособности нормальных и опухолевых клеток в стандартных условиях тестирования исследуемых соединений. Все линии клеток дикого типа были приобретены в American Type Culture Collection (ATCC, США). Линии клеток ПФЧ, HCT116p53ko и К-562/4 – любезно предоставлены проф. Штилем А.А. (ФГБУ “НМИЦ онкологии им. Н.Н. Блохина”, Москва). В качестве положительного контроля использован противоопухолевый антибиотик доксорубицин (Sigma, USA). Полученные данные представлены в табл. 1.
Таблица 1.
Антипролиферативная активность производных триптантрина и мостотрина
| Соединения | ИК50*, мкМ | ||||||
|---|---|---|---|---|---|---|---|
| MCF-7 | A-549 | K-562 | K-562/4 | HCT-116 | HCT-116 p53ko | ПФЧ | |
| Триптантрин (1а) | >50.0 | нт** | 0.21 ± 0.02 | 6.0 ± 0.8 | >50.0 | >50.0 | 0.30 ± 0.04 |
| 8-Фтортриптантрин (1б) | 3.5 ± 0.4 | 6.8 ± 0.4 | 2.5 ± 0.3 | 2.2 ± 0.3 | 2.9 ± 0.3 | 2.3 ± 0.4 | 5.1 ± 0.6 |
| 2,8-Диметилтриптантрин (1в) | >50.0 | >50.0 | >50.0 | >50.0 | >50.0 | >50.0 | >50.0 |
| Мостотрин (2а) | 11.1 ± 2.1 | нт** | 1.0 ± 0.10 | нт** | 5.0 ± 0.7 | нт** | нт** |
| 8-Фтормостотрин (2б) | 10.8 ± 1.3 | 16.3 ± 1.9 | 7.1 ± 0.8 | 6.8 ± 0.4 | 6.7 ± 0.2 | 8.0 ± 1.2 | 9.0 ± 1.0 |
| 2,8-Диметилмостотрин (2в) | 15.4 ± 2.1 | 21.3 ± 2.7 | 18.5 ± 2.0 | > 50.0 | 25.5 ± 3.3 | 25.2 ± 2.5 | 41.2 ± 5.6 |
| Производное 3 | >50.0 | >50.0 | >50.0 | >50.0 | >50.0 | >50.0 | >50.0 |
| Доксорубицин | 0.41 ± 0.03 | 0.52 ± 0.06 | 0.33 ± 0.03 | 6.1 ± 0.5 | 0.40 ± 0.06 | 1.1 ± 0.1 | 0.28 ± 0.04 |
В проведенных экспериментах наиболее активным по сравнению с триптантрином (1а) на всех линиях опухолевых клеток, кроме линии К-562, оказался 8-фтортриптантрин (1б). При этом он продемонстрировал на порядок меньшую токсичность для клеток неопухолевой линии ПФЧ. Для мостотрина (2а) и 8-фтормостотрина (2б) значения ИК50 для большей части использованных в эксперименте линий клеток практически совпадали, однако в отношении клеток линии К-562 мостотрин оказался более активным.
Неактивными для всех линий клеток, на которых проводился эксперимент, оказались диметилированное производное триптантрина (1в) и изатиновое производное (3) (табл. 1). В то же время у диметилированного производного мостотрина (2в), аналогичного 1в, наблюдалось небольшое увеличение антипролиферативной активности практически в отношении всех линий клеток.
Хотя полученные нами соединения (1б и 2б) оказались менее цитотоксичными по сравнению с известным противоопухолевым препаратом доксорубицином для всех протестированных нами опухолевых линий клеток, в то же время для линии незлокачественных фибробластов (ПЧФ) их токсичность оказалась намного ниже.
Противомикробную активность соединений оценивали стандартным методом серийных разведений в 96 луночных планшетах по минимальной подавляющей концентрации (МПК). В работе использовали штаммы микроорганизмов из коллекции ФГБНУ Научно-исследовательского института по изысканию новых антибиотиков им. Г.Ф. Гаузе: Staphylococcus aureus ATCC 29213, Escherichia coli ATCC 25922, Pseudomonas aeruginosa ATCC 27853, Bacillus cereus ATCC 10702, Candida albicans ATCC 10231. Бактериальные культуры анализировали в бульоне Mueller-Hinton Broth (“Beckton, Dickinson”, Франция), Candida albicans в среде RPMI (SIGMA Lot SLBZ6264, USA). Чувствительность тест-микроорганизмов к аналогам, триптантрину и мостотрину изучали в диапазоне концентраций от 1 до 32 мкг/мл. Минимальную подавляющую концентрацию (МПК) оценивали по наименьшей концентрации для каждого соединения, подавляющей видимый рост микроорганизмов после инкубации при (36 ± 1)°С в течении 24 ч [10–12].
Результаты тестирования, представленные в табл. 2, указывают на то, что производные триптантрина обладают меньшей противомикробной активностью, чем сам триптантрин (1a). В то же время аналоги мостотрина (2a) обладают более высокой активностью по сравнению с мостотрином: (соединение 2б) в отношении S. aureus ATCC 29213, а (соединение 2в) как в отношении S. aureus ATCC 29213, так и B. сereus ATCC 10702.
Таблица 2.
Сравнительная противомикробная активность аналогов мостотрина и триптантрина
| Соединения | Штаммы микроорганизмов, МПК, мкг/мл | ||||
|---|---|---|---|---|---|
| S. aureus ATCC 29213 |
E. coli ATCC 25922 |
B. cereus ATCC 10702 |
P. aeruginosa ATCC 27853 | C. albicans ATCC 10231 | |
| Триптантрин (1а) | 32 | 8 | 8 | >32 | – |
| 8-Фтортриптантрин (1б) | >32 | >32 | >32 | >32 | >32 |
| 2,8-Диметилтриптантрин (1в) | >32 | >32 | >32 | >32 | >32 |
| Мостотрин (2а) | 64 | 128 | 8 | >32 | – |
| 8-Фтормостотрин (2б) | 16 | >32 | 16 | >32 | 32 |
| 2,8-Диметилмостотрин (2в) | 8 | >32 | 4 | >32 | >32 |
| Производное 3 | >32 | >32 | >32 | >32 | >32 |
Таким образом, наиболее перспективными являются 8-фтортриптантрин (1б) и 8-фтормостотрин (2б), обладающие высокой антипролиферативной активностью в отношении различных линий опухолевых клеток, а также 2,8-диметилмостотрин (2в), оказывающий высокое антибактериальное действие в отношении S. aureus ATCC 29213. Полученные данные позволили выбрать соединения (1б, 2б и 2в) для дальнейших in vivo экспериментов на лабораторных животных.
Ранее было показано, что мостотрин (2а) может взаимодействовать с бороздками ДНК [7], а триптантрин (1а) ингибировать ферменты, связанные с воспалением [13, 14]. Однако особенности молекулярных механизмов действия других синтезированных нами соединений пока не были изучены.
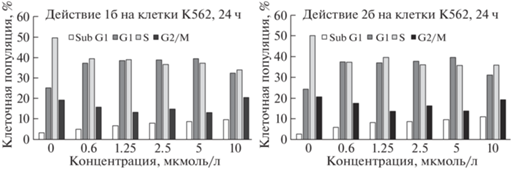
Учитывая этот факт, мы исследовали характер действия различных концентраций 8-фтортриптантрина (1б) и 8-фтормостотрина (2б) на клеточный цикл опухолевых клеток K-562, используя метод проточной цитометрии [15] (рис. 1).
Результаты показали, что соединения 1б и 2б ингибируют переход опухолевых клеток с фазы G1 в фазу S клеточного цикла, где происходит репликация ДНК. Блокирование клеточного цикла опухолевых клеток часто приводит к их гибели по механизмам апоптоза, что, очевидно, лежит в основе одного из возможных механизмов антипролиферативного действия этих веществ.
Список литературы
Jahng Y. Progress in the studies on tryptanthrin, an alkaloid of history // Arch. Pharm. Res. 2013. V. 36. № 5. P. 517–535.
Kaur R., Manjal S.K., Raval R.K., et al. Recent synthetic and medicinal perspectives of tryptanthrin // Bioorg. Med. Chem. 2017. V. 25. № 17. P. 4533–4552.
Moskovkina T.V., Denisenko M.V., Kalinovsky A.I., et al. Oxidation of isatin and its 5-substituted analogs with potassium permanganate // Russ. J. Org. Chem. 2013. V. 49. P. 1740–1743.
Mani J.S., Johnson J.B., Steel J.C., Broszczak D.A., et al. Natural product-derived phytochemicals as potential agents against coronaviruses: a review // Virus Res. 2020. V. 284. P. 197989.
Chan H.-L., Yip H.Y., Mak N.-K., et al. Modulatory effects and action mechanism of tryptanthrin on murine leukemia cells // Cell Mol. Immunol. 2009. V. 6. № 5. P. 335–342.
Cheng H.M., Wu Y.C., Wang, Q., et al. Clinical efficiency an yd IL-17 targeting mechanism of Indigo naturalis in moderate psoriasis // BCM Complement Altern. Med. 2017. V. 17. № 1. P. 439.
Popov A., Klimovich A., Styshova O., et al. Design, synthesis and biomedical evaluation of mostotrin, a new water soluble tryptanthrin derivative // Int. J. Molecular Med. 2020. V. 46. № 4. P. 1335–1346.
Lutnaes B.F., Luthe G., Brinkman UAT., et al. Characterization of monofluorinated polycyclic aromatic compounds by 1H, 13C and 19F NMR spectroscopy // Magn. Reson. Chem. 2005. V. 43. № 7. P. 588–594.
Zheng X., Hou B., Wang R., et al. Synthesis of substituted tryptanthrin via aryl halides and amines as antitumor and anti-MRSA agents // Tetrahedron. 2019. V. 75. № 29. P. 130351.
Tikhomirov A.S., Tsvetkov V.B., Kaluzhny D.N., et al. Tri-armed ligands of G-quadruplex on heteroarene-fused anthraquinone scaffolds: Design, synthesis and pre-screening of biological properties. Eur. J. Med. Chem. 2018. V. 159. № 5. P. 59–73.
Clinical and Laboratory Standards Institute (CLSI) 2015 (M07-A10). Methods for Dilution Antimicrobial Susceptibility Tests For bacteria that Grow Aerobically; Approved Standard, 10th ed.; CLSI: Wayne, PA, USA, 2015.
CLSI. Reference Method for Broth Dilution Antifungal Susceptibility Testing for Yeasts. 4th ed. CLSI standard M27. Wayne, PA: Clinical and Laboratory Standards Institute; 2017.
Ishihara T., Ishihara T., Kohno K., Ushio S., et al. Tryptanthrin inhibits nitric oxide and prostaglandin E(2) synthesis by murine macrophages // Eur. J. Pharmacol. 2000. V. 407. № 1–2. P. 197–204.
Pergola C., Jazzar B., Rossi A., et al. On the inhibition of 5-lipoxygenase product formation by tryptanthrin: mechanistic studies and efficacy in vivo // Brit. J. Pharm. 2012. V. 165. № 3. P. 765–776.
Krishan A.J. Rapid flow cytofluorometric analysis of mammalian cell cycle by propidium iodide staining // Cell Biol. 1975. V. 66. № 1. P. 188.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни