Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 202-204
Внутриклеточная доставка антителоподобной молекулы, способной ингибировать c-MYC
Т. Н. Лупанова 1, *, А. В. Уласов 1, Ю. В. Храмцов 1, А. А. Розенкранц 1, 2, академик РАН Г. П. Георгиев 1, член-корреспондент РАН А. С. Соболев 1, 2, **
1 Институт биологии гена Российской академии наук
Москва, Россия
2 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: tatyanalupanova@yandex.ru
** E-mail: AlSobolev@yandex.ru
Поступила в редакцию 01.11.2022
После доработки 30.11.2022
Принята к публикации 01.12.2022
- EDN: LZEHSX
- DOI: 10.31857/S2686738922600819
Аннотация
Синтезирован и охарактеризован модульный нанотранспортер (МНТ), несущий последовательность антителоподобной молекулы, анти с-Мус нанободи. Продемонстрировано, что созданный МНТ способен взаимодействовать с белком-мишенью, онкогеном c-Myc, с константой диссоциации 46 ± 14 нМ, интернализоваться в клетки-мишени, изменять Мус-зависимую экспрессию и оказывать антипролиферативное действие.
Специфическое воздействие на внутриклеточные белок-белковые взаимодействия является многообещающим подходом к регуляции сигнальных путей, в том числе и вовлеченных в различные патологические процессы. Ингибирование белок-белковых взаимодействий вошло в клиническую практику как способ терапии ряда воспалительных, онкологических и вирусных заболеваний. Однако эффективные низкомолекулярные ингибиторы известны не для всех перспективных мишеней и во многом ограничены белками, имеющими в своей структуре карманы, куда такой ингибитор мог бы встроиться. При этом некоторые белок-белковые взаимодействия характеризуются значительно большей площадью контакта, делая невозможным использование низкомолекулярных ингибиторов [1]. В то же время антитела и антителоподобные молекулы можно подобрать и к таким сложным мишеням [2], однако возникает проблема их специфической внутриклеточной доставки [3]. Для решения этой задачи нами было предложено адаптировать технологию модульных нанотранспортеров (МНТ), ранее успешно использованную для доставки низкомолекулярных соединений и регуляторных белков в клетки-мишени как in vitro, так и in vivo [4]. МНТ состоят из нескольких транспортных модулей, которые обеспечивают узнавание клетки мишени, рецептор-опосредуемый эндоцитоз, выход из эндосом в цитозоль и, при необходимости, транспорт из цитозоля в иной клеточный компартмент, например, в ядро через ядерную пору. В качестве модельной антителоподобной молекулы мы использовали нанободи к внутриклеточному белку с-Мус, онкогену, активированному в большинстве новообразований человека [5]. с-Мус − достаточно трудная мишень для воздействия из-за своей ядерной локализации, отсутствия полостей для связывания низкомолекулярных ингибиторов и вовлеченности в многочисленные клеточные процессы, что крайне затрудняет избирательное подавление с-Мус в живой клетке и организме такими ингибиторами.
В качестве конкурентного ингибитора использовали последовательность анти с-Мус нанободи CMYCVH-12-321, взаимодействие которого с с-Мус было продемонстрировано методом двугибридной системы [6]. Последовательность, кодирующая нанободи, была синтезирована и клонирована на N-конец ранее описанного МНТ [7] с получением гена слитого белка nb-DTox-HMP-NLS-EGF, где nb – анти с-Мус нанободи, эффекторная часть, DTox − эндосомолитический модуль, HMP − модуль-носитель, NLS – сигнал ядерной локализации, EGF – эпидермальный фактор роста в качестве лиганда к клеткам-мишеням со сверхэкпрессией EGFR. Наработку целевого nb-МНТ (nb-DTox-HMP-NLS-EGF) и контрольного МНТ (DTox-HMP-NLS-EGF) осуществляли в штамме E. coli C3029. Индукцию экспрессии МНТ проводили 500 мкМ изопропил-β-D-галактопиранозида в течение 20 ч при 16°C. Оба МНТ выделяли из растворимой фракции, а затем очищали аффинной хроматографией на носителе HisTrap™ High Performance (Cytiva, США). Выделенные белки хранили в 10 мМ Na2HPO4, 150 мМ NaCl, рН 8. Денатурирующий электрофорез в полиакриламидном геле продемонстрировал достаточную степень чистоты полученных белков (92% для nb-МНТ и 96% для МНТ) (рис. 1а).
Рис. 1.
(а) Денатурирующий электрофорез nb-МНТ и МНТ в полиакриламидном геле. М – белковый маркер. (б) Мембранолитические свойства nb-МНТ в зависимости от рН окружения. (в) Кривая титрования c-Myc-EGFP (50 нМ) возрастающими концентрациями nb-МНТ при определении методом термофореза константы диссоциации комплекса nb-МНТ:c-Myc-EGFP. (г) Уровни экспрессии нуклеолина в клетках А431 через 2 и 5 ч после добавления к ним 500 нМ nb-МНТ или МНТ, определенные методом вестерн-блоттинга.
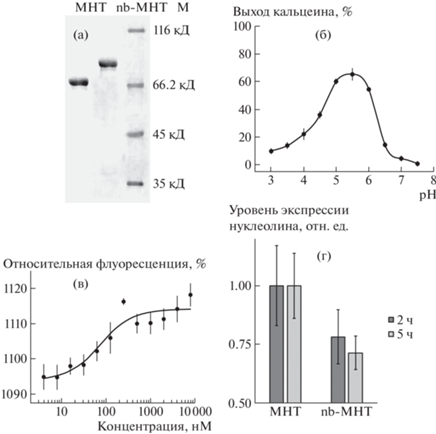
Для оценки функциональности модулей МНТ в составе nb-МНТ было проведено комплексное исследование. Характеристики лигандного модуля nb-МНТ были получены при помощи конкурентного радиолигандного анализа на клеточной линии эпидермоидной карциномы человека A431, характеризующейся сверхэкспрессией EGFR. При помощи конкурентного радиолигандного анализа с 125I-EGF на клетках эпидермоидной карциномы человека А431 выявлено, что nb-МНТ демонстрирует специфическое связывание с EGFR с константой диссоциации 20.1 ± 2.1 нМ. Это свидетельствует о сохранении способности лигандного модуля в составе nb-МНТ эффективно связываться с целевым рецептором. Интернализация меченных флуоресцентным красителем белков в клетки А431 была оценена методом проточной цитофлуориметрии. Оба МНТ демонстрировали специфическую интернализацию в клетки А431, которая блокировалась избытком свободного EGF.
Характеристика эндосомолитического модуля в составе nb-МНТ была получена на модельной системе липосом, нагруженных флуоресцентным красителем кальцеином до концентрации самотушения флуоресценции. Проведенные эксперименты показали, что nb-МНТ обладает мембранолитической активностью в области pH 5–6 (рис. 1б), соответствующей рН эндосом, что позволяет рассчитывать на работу этого модуля в составе nb-МНТ после интернализации в ранних эндосомах.
Взаимодействие nb-МНТ с c-Myc-EGFP было оценено методом термофореза на приборе Monolith NT.115 Series (“NanoTemper Technologies GmbH”, Германия). Образование комплекса nb-МНТ с EGFP-c-Myc влияет на величину падения интенсивности флуоресценции EGFP, обусловленное термофорезом. По зависимости относительной (по отношению к общей флуоресценции) глубины этого падения от концентрации МНТ (рис. 1в) при фиксированной концентрации EGFP-c-Myc (50 нМ) была рассчитана константа диссоциации комплекса nb-МНТ с EGFP-c-Myc, которая составила 46 ± 14 нМ.
Антипролиферативное действие nb-МНТ было изучено на клетках эпидермоидной карциномы человека А431, экспрессирующих и рецептор для nb-МНТ − EGFR, и с-Myc. Эксперименты показали, что уже через 2 ч после добавления 500 нМ nb-МНТ к клеткам А431 в них, по сравнению с добавленным контрольным МНТ (500 нМ), намечается снижение экспрессии нуклеолина − известной мишени Мус-индуцируемой активации [8], а спустя 5 ч экспрессия нуклеолина оказывается достоверно (p = 0.03 по критерию Манна–Уитни) подавленной на ~1/3 (рис. 1г). Похожие результаты были отмечены и на клетках аденокарциномы молочной железы MCF7. При помощи МТТ-теста на 6 день инкубации 500 нМ МНТ с клетками культуры MCF7 для nb-МНТ был выявлен статистически значимый (t-критерий Стьюдента, р < 0.05) антипролиферативный эффект по сравнению с контрольным МНТ. Так, для nb-МНТ относительная пролиферативная активность составляла 81 ± 5% от контрольного МНТ (100 ± 6%).
Полученные данные свидетельствуют о влиянии nb-МНТ на с-Myc сигнальный путь, что проявляется в изменении с-Мус зависимой экспрессии и снижении пролиферативной активности опухолевых клеток. Таким образом, показана принципиальная возможность эффективного воздействия на внутриклеточные мишени с помощью МНТ, несущих нанободи, которое мы планируем использовать в отношении других внутриклеточных белков, в том числе чужеродных, например, вирусных.
Список литературы
Wells J.A., McClendon C.L. // Nature. 2007. V. 450. №. 7172. P. 1001–1009.
Shipunova V.O., Deyev S.M. // Acta Naturae. 2022. V. 14. № 1(52). P. 54–72.
Santos R. et al. // Nat. Rev. Drug Discov. 2017. V. 16. P. 19–34.
Sobolev A.S. // Acta Naturae. 2020. V. 12. № 4 (47). P. 47–56.
Massó-Vallés D., Soucek L. // Cells. 2020. V. 9. № 4. P. 883.
Zeng J. et al. // Journal of Immunological Methods. 2015. V. 426. P. 140–143.
Gilyazova D.G. et al. // Cancer research. 2006. V. 66. № 21. P. 10534–10540.
Greasley et al. // Nucleic acids research. 2000. V. 28. № 2. P. 446–453.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


