Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 129-132
Использование биомаркерных жирных кислот икры и филе для определения среды обитания стерляди (Acipenser ruthenus, Linnaeus, 1758)
А. Е. Рудченко 1, 2, *, С. М. Чупров 1, член-корреспондент РАН Н. Н. Сущик 1, 2
1 Сибирский федеральный университет
Красноярск, Россия
2 Институт биофизики Сибирского отделения Российской академии наук Федерального исследовательского центра “Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
* E-mail: arudchenko@sfu-kras.ru
Поступила в редакцию 20.10.2022
После доработки 20.11.2022
Принята к публикации 22.11.2022
- EDN: NANZDN
- DOI: 10.31857/S2686738922600935
Аннотация
Установлены значительные отличия жирнокислотного состава икры и филе стерляди (Acipenser ruthenus, Linnaeus, 1758) из р. Енисей и аквакультурных хозяйств, связанные с разными пищевыми источниками. Для икры и мышечной ткани стерляди из естественной среды обитания были характерны значительно более высокие процентные уровни жирных кислот – биомаркеров диатомовых водорослей и бактериального вещества. В жирнокислотном составе тканей стерляди, выращенной в аквакультуре, были достоверно выше уровни олеиновой и линолевой кислот, характерных для масел семян высших растений, а также длинноцепочечных мононенасыщенных кислот – биомаркеров морских копепод, очевидно, являющихся ингредиентами искусственных кормов. Впервые предложено использовать соотношение уровней данных биомаркерных жирных кислот и установлено его пороговое значение для определения происхождения икры и филе осетровых рыб из естественной среды обитания или аквакультуры.
Осетровые виды рыб традиционно считаются одними из самых ценных рыбных ресурсов. Из-за масштабного снижения численности осетровых видов рыб, промысел данных видов в водных объектах Российской Федерации строго ограничен или полностью запрещен. Однако, несмотря на запрет промысла осетровых рыб, известно, что заметная доля черной икры, присутствующей на рынке, является результатом браконьерского промысла [1]. По этой причине остро стоит проблема определения происхождения икры и филе осетровых видов рыб из аквакультуры или же естественной среды обитания. Для определения происхождения продукции осетровых рыб общепринятого и точного метода на данный момент не существует. Следует отметить, что визуальный анализ морфологических характеристик икры и филе не дает оснований для установления происхождения рыб-производителей из аквакультуры или же природных местообитаний.
Одним из перспективных способов идентификации происхождения икры осетровых рыб является создание базы генетических паспортов осетровых рыб из российских рыбоводных хозяйств, на основе последовательности митохондриальной ДНК и микросателлитов [2, 3]. Однако для этого необходимо постоянно отслеживать генетическую структуру популяций самок на рыбоводных предприятиях с целью обновления банка.
Другим способом определения происхождения икры и филе осетровых видов рыб может оказаться использование жирных кислот (ЖК) тканей в качестве биохимических маркеров. Известно, что состав ЖК тканей рыб, так же, как и у многих других животных, в значительной степени зависит от состава их пищи [4]. В исследованиях, направленных на определение пищевой ценности икры и филе различных видов рыб, как источника ряда эссенциальных полиненасыщенных ЖК, были обнаружены существенные различия жирнокислотного состава тканей рыб из аквакультуры и природных местообитаний, вызванные разными пищевыми источниками [5, 6]. Различия жирнокислотного состава пищи аквакультурных и диких осетровых рыб могут быть использованы для идентификации происхождения их продукции, в том числе филе и икры.
Целью работы было установить различия жирнокислотного состава икры и филе стерляди из природных местообитаний и аквакультуры и выявить пороговые значения уровней маркерных жирных кислот, которые могут указывать на среду обитания осетровых рыб.
Для анализа состава ЖК собирали икру (V–IV стадия зрелости) прижизненным способом у самок стерляди (Acipenser ruthenus, Linnaeus, 1758) из р. Енисей и двух рыбоводных хозяйств, расположенных в Красноярском крае. Также для анализа отбирали мышечную ткань (0.5 г) со спинной стороны у половозрелых аквакультурных и диких особей стерляди возрастом от 7 до 15 лет. Липиды из тканей экстрагировали методом Фолча с модификациями. Метиловые эфиры ЖК получали методом двойного метанолиза. Анализ ЖК в икре и мышечной ткани проводили методом хромато-масс-спектрометрии. Этапы подготовки и анализа описывались ранее [7]. Расчеты средних и стандартных ошибок, критерия Манна–Уитни, дисперсионный анализ ANOVA и анализ главных компонент выполнены с использованием пакета Statistica 9.0 (StatSoft Inc.).
Анализ главных компонент ЖК состава икры и мышечной ткани стерляди показал значительные отличия рыб из р. Енисей по сравнению с рыбами, выращенными в аквакультурных хозяйствах (рис. 1). Как в икре, так и в мышечной ткани стерляди из р. Енисей обнаружены достоверно более высокие процентные уровни 16:1n-7, 18:1n-7, 20:5n-3 и разветвленных жирных кислот с 15 и 17 атомами углерода (С15-17 РЖК) (рис. 1, табл. 1, табл. 2).
Рис. 1.
Анализ главных компонент жирнокислотного состава (% от суммы ЖК) икры и мышечной ткани стерляди (Acipenser ruthenus) из р. Енисей и двух аквакультурных хозяйств.
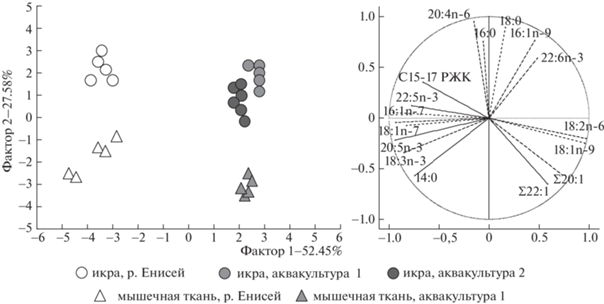
Таблица 1.
Содержание жирных кислот (% от суммы ЖК, среднее значение ± стандартная ошибка) в икре стерляди (Acipenser ruthenus) из р. Енисей и аквакультуры. Величины имели нормальное распределение (согласно критерия Колмогорова–Смирнова). Значения сравнивались в дисперсионном анализе ANOVA по критерию Тьюки. Статистически достоверные значения (p < 0.05) приведены жирным шрифтом, n – число проб. R – соотношение, рассчитанное по формуле (1)
| ЖК | Енисей | Аквакультура 1 | Аквакультура 2 | F | p | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| n-5 | n-6 | n-5 | |||||||||
| m | ± | SE | m | ± | SE | m | ± | SE | |||
| 15-17 РЖК | 1.6 | ± | 0.4A | 0.4 | ± | 0.0B | 0.4 | ± | 0.0B | 9.8 | 0.0025 |
| 16:1n-7 | 10.8 | ± | 0.7A | 4.0 | ± | 0.2B | 3.2 | ± | 0.1B | 103.9 | 0.0000 |
| 18:1n-7 | 4.6 | ± | 0.1A | 2.8 | ± | 0.0B | 2.5 | ± | 0.0B | 425.4 | 0.0000 |
| 20:5n-3 | 7.4 | ± | 0.3A | 2.7 | ± | 0.1B | 1.5 | ± | 0.1C | 263.8 | 0.0000 |
| 18:1n-9 | 22.6 | ± | 0.3A | 35.6 | ± | 0.4B | 34.3 | ± | 0.4B | 417.2 | 0.0000 |
| 18:2n-6 | 2.3 | ± | 0.1A | 9.5 | ± | 0.3B | 10.0 | ± | 0.1B | 362.0 | 0.0000 |
| Σ20:1 | 0.6 | ± | 0.1A | 1.7 | ± | 0.1B | 1.6 | ± | 0.1B | 65.0 | 0.0000 |
| Σ22:1 | 0.1 | ± | 0.0A | 0.2 | ± | 0.0B | 0.3 | ± | 0.0B | 8.8 | 0.0038 |
| R | 0.96 | ± | 0.03A | 0.21 | ± | 0.01B | 0.16 | ± | 0.00B | 588.3 | 0.0000 |
Таблица 2.
Содержание жирных кислот (% от суммы ЖК, среднее значение ± стандартная ошибка) в мышечной ткани стерляди (Acipenser ruthenus) из р. Енисей и аквакультуры. Величины имели нормальное распределение (согласно критерия Колмогорова–Смирнова). Значения сравнивались по критерию Манна–Уитни (U). Статистически достоверные значения (p < 0.05) приведены жирным шрифтом, n – число проб. R – соотношение, рассчитанное по формуле (1)
| ЖК | Енисей | Аквакультура | U | p | ||||
|---|---|---|---|---|---|---|---|---|
| n-5 | n-5 | |||||||
| m | ± | SE | m | ± | SE | |||
| 15-17 РЖК | 0.8 | ± | 0.1 | 0.3 | ± | 0.0 | 0.00 | 0.0090 |
| 16:1n-7 | 10.8 | ± | 0.5 | 3.3 | ± | 0.1 | 0.00 | 0.0090 |
| 18:1n-7 | 4.6 | ± | 0.2 | 3.0 | ± | 0.1 | 0.00 | 0.0090 |
| 20:5n-3 | 8.0 | ± | 0.4 | 3.9 | ± | 0.2 | 0.00 | 0.0090 |
| 18:1n-9 | 25.0 | ± | 0.5 | 37.4 | ± | 0.3 | 0.00 | 0.0090 |
| 18:2n-6 | 2.4 | ± | 0.2 | 12.0 | ± | 0.2 | 0.00 | 0.0090 |
| Σ20:1 | 1.1 | ± | 0.2 | 3.0 | ± | 0.1 | 0.00 | 0.0090 |
| Σ22:1 | 0.1 | ± | 0.0 | 0.8 | ± | 0.0 | 0.00 | 0.0090 |
| R | 0.85 | ± | 0.02 | 0.20 | ± | 0.01 | 0.00 | 0.0090 |
Повышенное содержание данных ЖК в тканях стерляди из естественной среды обитания, вероятно, связано с бентосным характером питания рыб. Так, характерными особенностями биохимического состава беспозвоночных речного бентоса является повышенное содержание 16:1n-7 и 20:5n-3, синтезируемых диатомовыми водорослями, а также 18:1n-7 и С15-17 РЖК – биохимических маркеров бактериального вещества [8]. Данные ЖК продуцируются в водных экосистемах диатомовыми водорослями и бактериями, передаются по трофическим сетям и накапливаются в икре и мышечных тканях бентоядной стерляди. В свою очередь, ЖК состав икры и мышечной ткани стерляди из аквакультурных хозяйств отличался достоверно более высокими процентами 18:1n-9, 18:2n-6, а также суммарного содержания мононенасыщенных ЖК с 20 и 22 атомами углерода (Σ20:1 и Σ22:1) (рис. 1, табл. 1, табл. 2).
Высокая доля 18:1n-9 и 18:2n-6 в тканях аквакультурных рыб связана с доминированием этих ЖК в составе растительных масел и шрота, которые часто используют в составе современных аквакультурных кормов [9–11]. Кроме того, в корма добавляют рыбную муку и биомассу копепод морского происхождения, содержащих большую долю кислот 20:1 и 22:1 [12].
Таким образом, отмеченные различия содержания биомаркерных ЖК в тканях стерляди из реки и аквакультуры, вызванные разным характером питания рыб, могут быть использованы для идентификации происхождения рыбопродукции. Повышенное содержание таких ЖК, как 16:1n-7, 18:1n-7, 20:5n-3 и С15-17 РЖК в тканях стерляди и, вероятно, других бентоядных осетровых, будет указывать на происхождение рыб из естественной среды обитания. Напротив, высокие процентные уровни 18:1n-9, 18:2n-6, Σ20:1 и Σ22:1 будут характерны для рыб, выращиваемых в аквакультуре. Однако стоит отметить, что все перечисленные ЖК маркеры были обнаружены в икре и мышечной ткани стерляди как аквакультурного, так и природного происхождения. Кроме того, в результате сезонных изменений кормовой базы и/или из-за физиологических изменений, происходящих в организмах в процессе роста и репродуктивного цикла, содержание отдельных ЖК в тканях рыб может значительно варьировать. В таком случае использование значений содержания отдельных биомаркерных ЖК не всегда может давать корректные результаты при установлении среды обитания рыбы. В этой связи мы предлагаем использовать соотношение (R) уровней всех вышеперечисленных биомаркерных ЖК, характерных для рыб как природных местообитаний, так и аквакультуры, рассчитываемое по следующей формуле:
(1)
$R = \frac{{\% \left( {{\mathbf{16:1n}} - {\mathbf{7}}} \right) + \% \left( {{\mathbf{18:1n}} - {\mathbf{7}}} \right) + \% \left( {{\mathbf{20:5n}} - {\mathbf{3}}} \right) + \% \left( {{\mathbf{С15}} - {\mathbf{17}}~{\text{РЖК}}} \right)~}}{{\% \left( {{\mathbf{18:1n}} - {\mathbf{9}}} \right) + \% \left( {{\mathbf{18:2n}} - {\mathbf{6}}} \right) + \% \left( {{\mathbf{\Sigma 20:1}}} \right) + \% \left( {{\mathbf{\Sigma 22:1}}} \right)}}~$Соотношение R, рассчитанное по предложенной формуле, для икры и мышечной ткани стерляди из р. Енисей варьировало от 0.6 до 1.0 (табл. 1, табл. 2). Для икры и мышечной ткани аквакультурной стерляди соотношение было значительно ниже и не превышало 0.3 (табл. 1, табл. 2). Эти показатели можно использовать в качестве пороговых значений при идентификации происхождения рыбной продукции. Так, например, величина R > 0.4–0.5, полученная при анализе ЖК состава икры или филе стерляди, будет указывать на происхождение от рыб из природной среды обитания.
Таким образом, впервые установлено, что биохимический анализ содержания ЖК в филе и икре осетровых бентоядных рыб может быть использован для идентификации среды обитания особей. Использование нескольких биомаркерных ЖК и расчет соотношений их процентных уровней позволит быстро и с достаточной степенью точности проводить экспертизу продукции осетровых рыб, для выявления и предотвращения появления браконьерской продукции в торговых сетях и товарном экспорте под видом аквакультурной.
Список литературы
Голубковский М.К., Копыленко Л.Р., Вафина Л.Х. Черная икра: проблемы и перспективы // Рыбное хозяйство. 2015. № 6. С. 30–34.
Мюге Н.С., Барминцева А.Е., Расторгуев В.Н., и др. Полиморфизм контрольного региона митохондриальной ДНК восьми видов осетровых и разработка системы ДНК-идентификации видов // Генетика. 2008. Т. 44. № 7. С. 913–919.
Барминцева А.Е., Мюге Н.С. Использование микросателлитных локусов для установления видовой принадлежности осетровых (Acipenseridae) и выявления особей гибридного происхождения // Генетика. 2013. Т. 49. № 9. С. 1093–2005.
Czesny S.J., Jacques R., Hanson S.D., et al. Fatty acid signatures of Lake Michigan prey fish and invertebrates: among-species differences and spatiotemporal variability // Canadian Journal of Fish and Aquatic Sciences. 2011. V. 68. P. 1211–1230.
Jankowska B., Zakes Z., Zmijewski T., et al. Fatty acid composition of wild and cultured northern pike (Esox lucius) // J. Appl. Ichthyol. 2008. V. 24. P. 196–201.
Mol S., Turan S. Comparison of proximate, fatty acid and amino acid compositions of various types of fish roes // International Journal of Food Properties. 2008. V. 11. P. 669–677.
Gladyshev M.I., Makhrov A.A., Baydarov I.V., et al. Fatty acid composition and contents of fish of genus salvelinus from natural ecosystems and aquaculture // Biomolecules. 2022. V 12 (1). P. 144.
Сущик Н.Н. Роль незаменимых жирных кислот в трофометаболических взаимодействиях в пресноводных экосистемах // Журнал общей биологии. 2008. Т. 69. № 4. С. 299–316.
Nasopoulou C., Zabetakis I. Benefits of fish oil replacement by plant originated oils in compounded fish feeds. A review // LWT – Food Science and Technology. 2012. V. 47. P. 217–224.
Teves J.F., Ragaza J.A. The quest for indigenous aquafeed ingredients: a review // Reviews in Aquaculture. 2016. V. 8. P. 154–171.
Gladyshev M.I. Terrestrial Sources of Polyunsaturated Fatty Acids for Aquaculture // Journal of Ichthyology. 2021. V. 61. № 4. P. 632–645.
Лагуткина Л.Ю. Перспективное развитие мирового производства кормов для аквакультуры: альтернативные источники сырья // Вестник АГТУ. Серия Рыбное хозяйство. 2017. № 1. С. 67–78.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


