Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 124-128
Сравнение эффектов моделирования септопластики и депривации обонятельного анализатора у крыс на изменение вариабельности сердечного ритма
А. Г. Мнацаканян 1, А. Г. Королев 1, 2, А. А. Цымбал 3, А. Н. Иноземцев 2, Т. И. Банкурова 1, С. С. Шилин 1, *, Я. И. Емец 1, С. С. Амирханян 1, Н. Д. Кузнецов 1, А. И. Глухова 1, С. М. Васякова 1, К. С. Гусев 1, И. Б. Ганьшин 1, Г. А. Дроздова 1
1 ФГАОУ ВО Российский университет дружбы народов
Москва, Россия
2 ФГБОУ ВО Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
3 ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет)
Москва, Россия
* E-mail: 9060965527@mail.ru
Поступила в редакцию 20.10.2022
После доработки 07.11.2022
Принята к публикации 10.11.2022
- EDN: LYVBSJ
- DOI: 10.31857/S2686738922600789
Аннотация
Проведено сравнение эффекта моделирования септопластики и моделирования сенсорной депривации обонятельного анализатора у крыс на изменения частотной области вариабельности сердечного ритма. Бульбэктомия провоцирует у крыс более выраженные изменения вариабельности сердечного ритма, по сравнению с моделированием септопластики.
ВВЕДЕНИЕ
Обонятельный анализатор играет важную роль в нормальной жизнедеятельности не только у человека, но и у животных. Нарушение его функции может спровоцировать развитие ряда стрессовых реакций [1, 2].
Нарушение обонятельной функции отмечается при различных заболеваниях полости носа и околоносовых пазух, среди которых одним из наиболее распространенных является искривление перегородки носа (ИПН) [3]. Также дисфункция периферического отдела обонятельного анализатора отмечается в раннем послеоперационном периоде у пациентов после септопластики [4], которая выполняется у пациентов с ИПН [5, 6].
Считается, что вариабельность сердечного ритма отражает аффективные, физиологические, когнитивные и поведенческие аспекты болевого синдрома [7, 8], а также ряда инфекционных заболеваний [9–11], т.е. наличие в организме той или иной интенсивности воспалительного процесса. По современным данным, центральная вегетативная нейронная сеть является функциональной интегрированной моделью, участвующей в тоническом, рефлекторном и адаптивном управлении вегетативными функциями [12]. Очевидно, что ВСР может быть одним из объективных методов контроля ответа нейрогуморальной регуляторной системы организма на различные стрессорные факторы, нарушающие функцию обонятельного анализатора [13].
Цель исследования: сравнить степень стрессогенности моделирования септопластики и других моделей сенсорной депривации обонятельного анализатора на основании анализа вариабельности сердечного ритма у крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Работа была проведена на 20 половозрелых крысах-самцах линии Wistar массой 205.25 ± 10.15 г. За 3 сут до операций всем животным под местной анестезией 2% раствором лидокаина и общей анестезией раствором золетила 50 (тилетамина гидрохлорид и золазепама гидрохлорид) (3 мг на 100 г массы тела крысы) устанавливались 3 металлических полукольца с округлыми наконечниками для последующей фиксации электродов. Через три дня после этого проводили запись электрокардиограммы (ЭКГ), после в этот же день проводили хирургические вмешательства. Для оценки состояния вегетативной нервной системы (ВНС) проводили спектральный анализ вариабельности сердечного ритма (ВСР) у крыс до операции (данные контроля), на 1–6 сутки после моделирования септопластики (1 группа, n = 10). В группе бульбэктомии (2 группа, n = 10) указанному сроку (1–6 сутки после операции в 1-й группе) соответствовали 15–19 постоперационные сутки. Влияние гуморального и надсегментарного уровней регуляции ВСР оценивали при помощи анализа очень низкочастотного (VLF), а состояние парасимпатической (ПНС) и симпатической (СНС) нервных систем – с помощью высокочастотного компонента сердечного ритма (HF) и низкочастотного компонента сердечного ритма (LF), соответственно, как процентное отношение каждого частотного показателя от их суммы, также оценивали отношение LF/HF (вагосимпатический индекс). Полученные значения сравнивали с дооперационными показателями (контроль), между группами на каждом сроке и внутри групп в динамике.
Септопластика. За 10 мин всем крысам до операции в целях общей анестезии внутрибрюшинно вводили раствор золетила 50 в дозировке 15 мг/кг. Моделирование септопластики (1 группа, n = 10) проводили стандартным методом путем зигзагообразной скарификации слизистой оболочки полости носа (рис. 1а) [1, 2, 7].
Рис. 1.
Результат бульбэтомии у крыс (желтыми стрелками указаны места бульбэктомии) (а) схема проведения моделирования септопластики (б). Синими стрелками – направление скарификации слизистой перегородки носа.
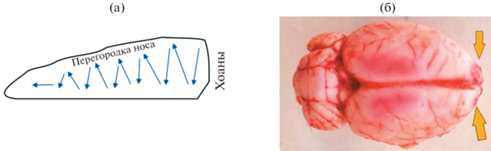
Бульбэктомия. Двустороннюю бульбэктомию (рис. 1б) проводили (2 группа, n = 10) согласно протоколу [14]. После введения раствора золетила 100 в указанной выше дозировке брили голову и над обонятельными луковицами в черепе проделывали микробором отверстия размером 2 мм для иглы кпереди от брегмы с двух сторон на расстоянии 2 мм от средней линии лобной кости, лежащей над обонятельными луковицами. Животные исключались из исследования, если не были полностью удалены луковицы или была повреждена лобная кора [14]. При этом было важно не повредить лобную кору. Для профилактики кровотечения из фрезевых отверстий использовали гемостатическую губку. На рану наносили порошок антибиотика цефтриаксона до их закрытия хирургическими зажимами 7.5 мм.
Для оценки различий результатов до и после операции использовали критерий Вилкоксона, а при межгрупповом сравнении – критерий Манна–Уитни. Исследования на животных проводили согласно требованиям “Правил проведения работ с использованием экспериментальных животных” (1984 г.) и “Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях” (1986 г.). Исследования одобрены этическим комитетом МИ РУДН от 18.09.2020 (протокол № 1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Низкочастотный компонент. Группа бульбэктомии имела достоверно более высокие показатели LF на всем протяжении периода наблюдения, по сравнению с группой септопластики (p < 0.001) (рис. 2а).
Рис. 2.
Изменения параметров частотной области ВСР после моделирования сенсорной депривации: LF (a), HF (б), VLF (в), LF/HF (г). Примечание: ֏ – достоверные различия между экспериментальными группами и контрольной группой при p < 0.001; • – достоверные различия между экспериментальными группами и контрольной группой p < 0.01; * – достоверные различия между экспериментальными группами при p < 0.001; † – достоверные различия между экспериментальными группами при p < 0.01; ‡ – достоверные различия между экспериментальными группами при p < 0.05; $\diamondsuit $ – достоверные различия между сроками внутри экспериментальных групп; p < 0.001 $\bigcirc $ – достоверные различия между сроками внутри экспериментальных групп p < 0.01.
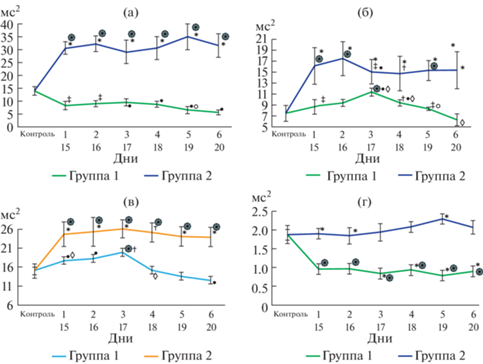
Высокочастотный компонент. По сравнению с 1-й группой, HF 2-й группы был значимо выше 1-й 2-й, 5-й, 6-й дни (p < 0.001), 3-й день (p < < 0.05), 4-й день (p < 0.01) (рис. 2б).
Критерий Манна–Уитни показал, что очень низкочастотный компонент во 2-й группе на 15–20 дни после операции был достоверно выше, чем в 1-й, 2-й, 3-й, 5-й, 6-й дни (p < 0.001) и 4-й день (p < 0.01) после операции в первой группе (рис. 2в).
Вагосимпатический индекс. Согласно критерию Манна–Уитни, через день после операций самый высокий LF/HF наблюдался у животных 2-й группы, по сравнению с 1-й группой и контролем (p < 0.001). Через 48 ч после моделирования воздействий на обонятельный анализатор в группе 2 наблюдалась похожая картина (p < 0.001), однако наименьшие показатели вагосимпатического индекса на этом отрезке его оценки были отмечены в группе 1. В третий период наблюдения самые высокие значения были выявлены во 2-й группе, по сравнению с 1-й (p < 0.001). На 4-й, 5-й и 6-й временных точках оценки вагосимпатического индекса ситуация была та же, что и в предыдущий период. Но на 5-й день наблюдения LF/HF 2-й группы был значимо выше, чем в 1-й (p < 0.001) (рис. 2г).
Хирургические манипуляции в челюстно-лицевой области приводят к изменениям вариабельности сердечного ритма [15].
Традиционно анализ ВСР в частотной области выявляет два или более пика: более низкую частоту (<0.15 Гц) и пик более высокой частоты (>0.15 Гц), которые, как правило, соотносят с симпатическим и парасимпатическим влиянием на сердечную деятельность соответственно. Снижение HF по сравнению с LF, и рост VLF, которые наблюдаются одновременно изменением поведения крыс в условиях стресса [8, 13], можно объяснить эффектом постхирургического воспаления. Высокие значения LF в группе бульбэктомии свидетельствуют о снижении активности СНС в регуляции сердечной деятельности на фоне депривации центрального отдела обонятельного анализатора. Известно, что колебания HF-компонента тесно связаны с выбросом в кровеносное русло провоспалительных цитокинов через час после воздействия стрессового фактора [11]. Кроме того, показано, что анестезиологическое пособие, не соответствующее объему хирургического вмешательства, провоцирует ваготонию, что отражается на регуляции сердечной деятельности [16]. На ранних сроках после септопластики в полости носа воспалительные реакции сопровождаются отеком слизистой оболочки, а это приводит к сужению носовых ходов и последующей гипоксемии, что, в свою очередь, увеличивает активность ПНС, чем объясняется повышение HF во второй группе [15]. Однако при моделировании септопластики в первые дни после операции произошло падение HF, вероятно, из-за развития классического стресс-ответа и развития депрессивно-подобного состояния [17].
Известно, что амплитуда VLF тесно связана с эмоциональным стрессом, а также VLF может показывать регуляцию метаболизма [18]. Тесная связь этого компонента ВСР с метаболизмом подтверждается взаимосвязью между суточными изменениями концентрации адипоцитарного гормона лептина в сыворотке крови и суточными изменениями VLF-компонента ВСР [19]. Полученную разницу между группами можно объяснить тем, что в условиях полной депривации обонятельного анализатора у крыс развивается тревожное состояние, увеличивается двигательная активность, так как обонятельный анализатор у этих животных в познании окружающей среды – ведущий [8].
Вагосимпатический индекс (LF/HF) показывает соотношение взаимодействия СНС и ПНС [20–22]. Септопластика, в сравнении с другими моделями операций в челюстно-лицевой области, сама по себе провоцирует рост вагосимпатического индекса, что обусловлено большой площадью операционного поля, уменьшением носовых ходов, сенсорной депривацией обонятельного анализатора [1, 2, 7]. В группе бульбэктомии этот показатель еще выше, что можно объяснить полным отсутствием функции обонятельного анализатора [8].
Ранее было показано, что моделирование септопластики у крыс провоцирует появление тревожно-депрессивного состояния, что проявляется изменениями в поведении животных [8, 23]. Так же известно, что хирургическая альтерация в челюстно-лицевой области приводит к изменениям в цитоархитектонике пирамидного слоя гиппокампа, росту апоптоза нейронов в аммониевом роге гиппокампа [2], выраженным местным воспалительным реакциям депрессивного состояния, что проявляется изменениями в поведении животных [15]. Кроме того, моделирование септопластики в раннем постоперационном периоде провоцирует увеличение активности симпатической нервной системы [8, 23], что согласуется с данными, полученными в настоящем исследовании. Сравнительную характеристику цитоархитектоники гиппокампа в условиях сенсорной депривации на различных моделях еще предстоит изучить [25–30].
ЗАКЛЮЧЕНИЕ
Хирургическая травматизация перегородки носа и верхней челюсти у крыс в раннем послеоперационном периоде вызывает сдвиг вегетативной нервной системы в сторону ее симпатического компонента. Что косвенно свидетельствует о возникновении острого стресс-ответа, наличии депрессивно-тревожного состояния, увеличении мобилизации высших вегетативных центров и росте влияния нейрогуморального и метаболического уровней регуляции. Степень стрессогенности бульбэктомии у крыс в раннем послеоперационном периоде выражена сильнее.
Список литературы
Kastyro I.V., Popadyuk V.I., Reshetov I.V., Kostyaeva M.G., Dragunova S.G., Kosyreva T.F., Khamidulin G.V., Shmaevsky P.E. Changes in the Time-Domain of Heart Rate Variability and Corticosterone after Surgical Trauma to the Nasal Septum in Rats // Doklady Biochemistry and Biophysics. 2021. V. 499. P. 247–250.
Kostyaeva M.G., Kastyro I.V., Yunusov T.Yu., Kolomin T.A., Torshin V.I., Popadyuk V.I., Dragunova S.G., Shilin S.S., Kleiman V.K., Slominsky P.A., Teplov A.Y. Protein p53 Expression and Dark Neurons in Rat Hippocampus after Experimental Septoplasty Simulation // Molecular Genetics, Microbiology and Virology. 2022. V. 37. № 1. P. 19–24.
Van Egmond M.M.H.T., Rovers M.M., Hannink G., Hendriks C.T.M., van Heerbeek N. Septoplasty with or without concurrent turbinate surgery versus non-surgical management for nasal obstruction in adults with a deviated septum: a pragmatic, randomised controlled trial // Lancet. 2019. V. 394. № 10195. P. 314–321.
Kalmykov I.K., Popadyuk V.I., Ermakova N.V., Kley-man V.K., Shalamov K.P., Efimenkov I.O., Dyachen-ko Yu.E., Sharipova N.R., Sedelnikova A.D., Gordeev D.V., Torshin V.I., Kastyro I.V. Influence of the choice of anesthetic aid on changes in the frequency range of heart rate variability during septoplasty in the early postoperative period // Russian Rhinology. 2022. V. 30. № 3. P. 169–177.
Dąbrowska‑Bień J., Skarżyński P.H., Gwizdalska I., Łazęcka K., Skarżyńsk H. Complications in septoplasty based on a large group of 5639 patients // European Archives of Oto-Rhino-Laryngology. 2018. V. 275. P. 1789–1794.
Simsek T., Coskun Musaoglu I., Uluat A. The effect of lidocaine and tramadol in nasal packs on pain after septoplasty // European Archives of Oto-Rhino-Laryngology. 2019. V. 276. № 6. P. 1663–1669.
Kastyro I.V., Reshetov I.V., Popadyuk V.I., Torshin V.I., Ermakova N.V., Karpukhina O.V., Inozemtsev A.N., Khamidulin G.V., Shmaevsky P.E., Sardarov G.G., Gordeev D.V., Scopich A.A. Studying the physiological effects of a new model of septoplasty in rats // Head and Neck Russian Journal. 2020. V. 8. № 2. P. 33–38.
Kastyro I.V., A Inozemtsev.N., Shmaevsky P.E., Khami-dullin G.V., Torshin V.I., Kovalenko A.N., Pryanikov P.D., Guseinov I.I. The impact of trauma of the mucous membrane of the nasal septum in rats on behavioral responses and changes in the balance of the autonomic nervous system (pilot study) // J. Phys.: Conf. Ser. 2020. V. 1611. 012054.
Carod-Artal F.J. Infectious diseases causing autonomic dysfunction // Clin Auton Res. 2018. V. 28. P. 67–81.
Ghosh R., Roy D, Sengupta S., Benito-Leon J. Autonomic dysfunction heralding acute motor axonal neuropathy in COVID-19 // J Neurovirol. 2020. V. 26. P. 964–66.
Buchhorn R., Baumann C., Willaschek C. Heart rate variability in a patient with coronavirus disease 2019 // Int Cardiovasc Forum J. 2020. 2020050209
Riganello F., Chatelle C., Schnakers C., Laureys S. Heart Rate Variability as an Indicator of Nociceptive Pain in Disorders of Consciousness? // J Pain Symptom Manage. 2019. V. 57. № 1. P. 47–56.
Dragunova S.G., Kosyreva T.F., Severin A.E., Shmaev-sky P.E., Khamidulin G.V., Popadyuk V.I., Yudin D.K., Yunusov T.Y., Kleyman V.K., Kuznetsov N.D., Skopich A.A., Kastyro I.V., Kostyaeva M.G., Vostrikov A.M., Shevele-va V.A., Antoniv V.F., Torshin V.I., Ermakova N.V. The effect of simulating sinus lifting and septoplasty on changes in the sympathetic and parasympathetic nervous systems in rats // Head and neck. Russian Journal. 2021. V. 9. № 3. P. 43–49.
Freitas A.E., Machado D.G., Budni J., Neis V.B., Balen G.O., Lopes M.W., de Souza L.F., Dafre A.L., Leal R.B., Rodrigues A.L. Fluoxetine modulates hippocampal cell signaling pathways implicated in neuroplasticity in olfactory bulbectomized mice // Behav Brain Res. 2013. V. 15. № 237. P. 176–84.
Dolgalev Al.Al., Svyatoslavov D.S., Pout V.A., Reshetov I.V., Kastyro I.V. Effectiveness of the Sequential Use of Plastic and Titanium Implants for Experimental Replacement of the Mandibular Defect in Animals using Preliminary Digital Design // Doklady Biochemistry and Biophysics. 2021. V. 496. P. 36–39.
Agadzhanyan N.A., Batotsyrenova T.E., Severin A.E., Semenov Y.N., Sushkova L.T., Gomboeva N.G. Comparison of specific features of the heart rate variability in students living in regions with different natural and climatic conditions // Human Physiology. 2007. V. 33. № 6. P. 715–719.
Takabatake N., Nakamura H., Minamihaba O., Inage M., Inoue S., Kagaya S., Michiyasu Y., Tomoike H. A Novel Pathophysiological Phenomenon in Cachexic Patients with Obstructive Pulmonary Disease: the Relationship between the Circadian Rhythm of Circulating Leptin and Very Low Frequency Component of Heart Rate Variability // Am. J. Respir. Crit. Care Med. 2001. V. 163. P. 1314–1319.
Pinchasov G., Juodzbalys G. Graft-Free Sinus Augmentation Procedure: a Literature Review. 2014. V. 5. № 1. P. e1.
Sturman O., Germain P.L., Bohacek J. Exploratory rearing: a context- and stress-sensitive behavior recorded in the open-field test // Stress. 2018. V. 2. № 5. P. 443–452.
Eckberg D.L. Sympathovagal balance: a critical appraisal // Circulation. 1997. V. 96. P. 3224–3232.
Billman G.E. The LF/HF ratio does not accurately measure cardiac sympatho-vagal balance. Frontiers in Physiology. 2013.
Kang J.H., Kim J.K., Hong S.H., Lee C.H., Choi B.Y. Heart Rate Variability for Quantification of Autonomic Dysfunction in Fibromyalgia // Ann Rehabil Med. 2016. V. 40. № 2. P. 301–309.
Kastyro I.V., Reshetov I.V., Khamidulin G.V., Shmaev-sky P.E., Karpukhina O.V., Inozemtsev A.N., Torshin V.I., Ermakova N.V., Popadyuk V.I. The Effect of Surgical Trauma in the Nasal Cavity on the Behavior in the Open Field and the Autonomic Nervous System of Rats // Doklady Biochemistry and Biophysics. 2020. V. 492. P. 121–123.
Popadyuk V.I., Kastyro I.V., Ermakova N.V., Torshin V.I. Septoplasty and tonsillectomy: acute stress response as a measure of effectiveness of local anesthetics // Vestn. Otorinolaringol. 2016. V. 81. № 3. P. 7–11.
Alvites R.D., Caseiro A.R., Pedrosa S.S., Branquinho M.E., Varejão A.S.P., Maurício A.C. The Nasal Cavity of the Rat and Mouse-Source of Mesenchymal Stem Cells for Treatment of Peripheral Nerve Injury // The Anatomical Record. 2018. V. 301. P. 1678–1689. https://doi.org/10.1002/ar.23844
Aragoneses Lamas J.M., Gómez Sánchez M., Cuadrado González L., Suárez García A., Aragoneses Sánchez J. Vertical Bone Gain after Sinus Lift Procedures with Beta-Tricalcium Phosphate and Simultaneous Implant Placement-A Cross-Sectional Study // Medicina. 2020. V. 56 609
Dard M. Animal models for experimental surgical research in implant dentistry. In: BALLO A.: Implant dentistry research guide: basic, transitional and experimental clinical research. Nova Science Publishers, Inc., Hauppauge NY, USA, 2012. P. 167–190.
Goebel M.U., Mills P.J., Irwin M.R., Ziegler M.G. Interleukin-6 and tumor necrosis factor-alpha production after acute psychological stress, exercise, and infused isoproterenol: differential effects and pathways // Psychosom Med. 2000. V. 62. P. 591–8.
Kim E.J., Pellman B., Kim J.J. Stress effects on the hippocampus: a critical review // Learn Mem. 2015. V. 22. Iss. 9. P. 411–416.
Mello Lima J.F., Melo de Matos J.D., Santos Í.K.S., de Oliveira A.J.A.G., de Vasconcelos J.E.L., Zogheib L.V., Sartorelli de Castro D. Maxillary sinus lift surgery techniques: a literature review maxillary sinus lift surgery techniques: a literature review maxillary sinus lift surgery techniques: a literature review // Int. J. Adv. Res. 2017. V. 5. № 8. P. 832–844.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


