Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 170-176
Синтез 1-[ω-(бромфенокси)алкил]-3-нафталенилметил-производных урацила и их аналогов как вероятных ингибиторов репликации цитомегаловируса человека
М. П. Парамонова 1, Е. С. Гуреева 1, А. А. Озеров 1, R. Snoeck 2, G. Andrei 2, Д. А. Александров 3, А. Л. Хандажинская 4, *, М. С. Новиков 1, академик РАН С. Н. Кочетков 4, **
1 Волгоградский государственный медицинский университет
Волгоград, Россия
2 Rega Institute for Medical Research, KU Leuven
B-3000 Leuven, Herestraat 49 bus 1043, Belgium
3 Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
4 Институт молекулярной биологии
им. В.А. Энгельгардта Российской академии наук
Москва, Россия
* E-mail: khandazhinskaya@bk.ru
** E-mail: snk1952@gmail.com
Поступила в редакцию 30.09.2022
После доработки 17.11.2022
Принята к публикации 17.11.2022
- EDN: NAUWWD
- DOI: 10.31857/S2686738922700093
Аннотация
Осуществлен синтез нового ряда 1-[ω-(бромфенокси)алкил]-производных урацила, содержащих в положении 3 остатка урацила нафтален-1-ил-, нафтален-2-ил-, 1-бромнафтален-2-илметильный, бензильный и антрацен-9-илметильный фрагмент. Были изучены противовирусные свойства синтезированных соединений в отношении цитомегаловируса человека. Было обнаружено, что соединение, имеющее в своем составе мостик, состоящий из пяти метиленовых групп, обладает высокой анти-цитомегаловирусной активностью in vitro.
ВВЕДЕНИЕ
Цитомегаловирус человека (HCMV), являющийся одной из наиболее распространенных причин ряда инфекционных заболеваний, поражает Т-клетки и изменяет их иммунные свойства. Считается, что HCMV способствует развитию атеросклероза [1], иммунного старения [2], провоцирует воспалительные заболевания кишечника [3] и может вызывать развитие злокачественных опухолей благодаря онкомодулирующему эффекту [4, 5]. Вирус HCMV крайне опасен для беременных женщин и может привести к развитию тяжелых патологий у новорожденных: потере слуха, микроцефалии, умственной отсталости, гепатоспленомегалии и тромботической тромбоцитопенической пурпуре [6]. Как следствие, врожденная HCMV инфекция может закончиться потерей плода или смертью новорожденного [6, 7].
В настоящее время для лечения заболеваний, вызванных HCMV, применяются ингибиторы вирусной ДНК-полимеразы: ганцикловир, цидофовир и фоскарнет, а также их пролекарственные формы – валганцикловир и бринцидофовир [8]. Однако эти препараты вызывают множество побочных эффектов, которые включают токсическое воздействия на костный мозг (ганцикловир, валганцикловир и цидофовир) и почки (фоскарнет, цидофовир и бринцидофовир) [9, 10]. Кроме того, длительная терапия, проводимая при HCMV инфекции, может приводить к возникновению устойчивых вариантов HCMV [11]. Недавно были одобрены имеющие иной механизм действия летермовир и нуклеозидный аналог марибавир в качестве средств для профилактики HCMV-инфекции у пациентов с трансплантацией аллогенных стволовых клеток [12, 13]. Однако, несмотря на низкую токсичность, их использование также приводило к появлению резистентных к летермовиру и марибавиру вариантов HCMV [14]. По этой причине поиск новых высокоэффективных анти-HCMV препаратов является важной и актуальной задачей.
Ранее нами была описана серия 1-[ω-(фенокси)алкил]-производных урацила, которые ингибировали репликацию HCMV в концентрациях, сравнимых с действием ганцикловира [15]. Введение в положение 3 пиримидинового кольца (4-феноксифенил)-ацетамидного фрагмента привело к усилению вирусингибиторных свойств [16]. В литературе были описаны 3-(3,5-диметилбензил)-производные 1-бензил- и 1-(пиридилметил)урацила, проявляющие двойную активность как в отношении ВИЧ-1, так и в отношении HCMV [17, 18]. Недавно нами был обнаружен ряд 1-циннамил-производных урацила, содержащих при атоме азота N3 бензильный и нафтален-1-илметильный заместители, которые также обладали активностью в отношении ВИЧ-1 и HCMV [19]. Также высокую анти-HCMV активность про- явили производные 1-[5-(4-бромфенокси)пентил]урацила, которые имели при атоме азота N3 3-(4-оксохиназолин-3(4H)-ил)пропильный [20] или 3-[(4-метил-2-оксо-2H-хромен-7-ил)окси]пропильный заместитель [21].
В этой связи этим нами было сделано предположение о том, что наличие объемного заместителя у атома азота N3 пиримидинового кольца дает соединения, обладающие высокой активностью в отношении HCMV. В рамках этой гипотезы нами был осуществлен синтез ряда 1-[ω-(фенокси)алкил]-производных урацила, содержащих нафталенилметильный заместитель в положении 3 остатка урацила.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все реагенты были получены от компаний Sigma-Aldrich и Acros Organics и были использованы без предварительной очистки.
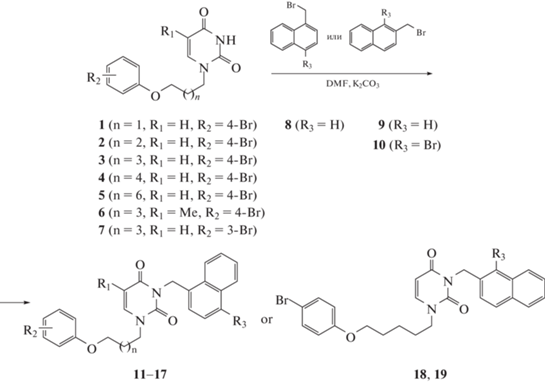
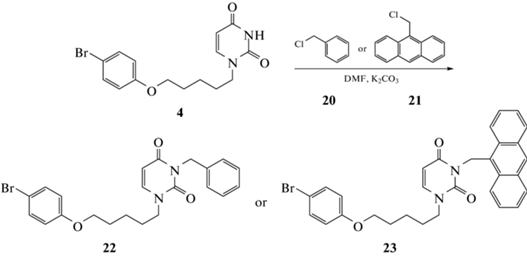
Общий метод получения 3-арилметил-1-[ω-(бромфенокси)алкил]- производных урацила 11–19 и 22–24. Суспензию 1-[ω-(4-бромфенокси)алкил]-производного урацила 1–7 или 1-[5-(4-бромфе- нокси)пентил]хиназолин-2,4(1H,3H)-дион (25) (1.416 ммоль) и свежепрокаленного карбоната калия (0.3 г, 2.171 ммоль) перемешивали в растворе ДМФА (10 мл) при 80°С в течение 1 ч, охладили до комнатной температуры и добавили раствор бромметилнафталина 8–10, бензилхлорида (20) или 9-(хлорметил)антраценом (21) (1.469 ммоль) в ДМФА (5 мл). Полученную смесь перемешивали при той температуре в течение 24 ч, упарили при пониженном давлении и остаток обработали водой (80 мл). Смесь экстрагировали 1,2-дихлорэтаном (4 × 20 мл), объединенный экстракт упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью этилацетат-1,2-дихлорэтан (1:1), фракции, содержащие продукт, объединяли и упаривали в вакууме. Остаток кристаллизовали из смеси этилацетат-гексан (1:1). Целевые соединения 11–19 и 22–24 были получены с выходами 74–89%.
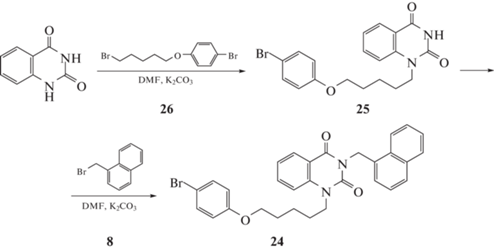
1-[5-(4-Бромфенокси)пентил]хиназолин-2,4(1H,3H)-дион (25). Суспензию хиназолин-2,4(1H,3H)-диона (4.0 г, 24.67 ммоль) и свежепрокаленного карбоната калия (0.86 г, 6.222 ммоль) перемешивали в растворе ДМФА (50 мл) при 80°С в течение 1 ч, добавили раствор 1-бром-4-[(5-бромпентил)окси]бензола (26) (1.99 г, 6.179 ммоль) в ДМФА (20 мл) и полученную смесь перемешивали при той температуре в течение 24 ч. Реакционную массу упарили при пониженном давлении, остаток обработали водой (100 мл) и экстрагировали 1,2-дихлорэтаном (4 × 50 мл), объединенный экстракт упаривали при пониженном давлении. Остаток нанесли на колонку с силикагелем и элюировали этилацетатом, фракции, содержащие продукт, объединяли и упаривали в вакууме. Остаток кристаллизовали из смеси изопропанол-гексан (1:1). Получили 1.7 г белого мелкокристаллического продукта. Выход 68%, т. пл. 178–180°C, Rf 0.80 (этилацетат).
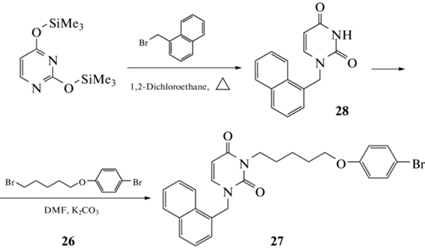
1-(Нафтален-1-илметил)урацил (28). К раствору 2,4-бис(триметилсилилокси)пиримидина, полученного из урацила (1.5 г, 13.38 ммоль), в безводном 1,2-дихлорэтане (50 мл) добавили 1-(бромметил)нафталин (8) (2.85 г, 13.50 ммоль). Полученную смесь кипятили с обратным холодильником с защитой от влаги воздуха в течение 36 ч. Реакционную массу охладили до комнатной температуры, обработали изопропанолом (10 мл), упарили при пониженном давлении на 2/3 объ-ема и разбавили гексаном (20 мл). Выпавший осадок отфильтровали и перекристаллизовали из смеси ДМФА-вода (2:1). Получили 2.26 г мелкокристаллического продукта белого цвета. Выход 67%, т. пл. 266–268°C (262–266°C лит.21), Rf 0.44 (этилацетат).
3-[5-(4-Бромфенокси)пентил]-1-(нафтален-1-илметил)урацил (27). Суспензию 1-(нафтален-1-илметил)урацил (28) (0.5 г, 1.982 ммоль) и свежепрокаленного карбоната калия (0.5 г, 3.618 ммоль) перемешивали в растворе ДМФА (10 мл) при 80°С в течение 1 ч, добавили раствор 1-бром-4-[(5-бромпентил)окси]бензола (26) (0.64 г, 1.987 ммоль) и полученную смесь перемешивали при той температуре в течение 24 ч. Реакционную массу упарили при пониженном давлении и остаток обработали водой (80 мл). Смесь экстрагировали 1,2-дихлорэтаном (4 × 20 мл), объединенный экстракт упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью этилацетат-1,2-дихлорэтан (1:1), фракции, содержащие продукт, объединяли и упаривали в вакууме. Остаток кристаллизовали из смеси этилацетат-гексан (1:1). Получили 0.83 г мелкокристаллического продукта белого цвета. Выход 85%, т. пл. 92.5–93.5°C, Rf 0.65 (этилацетат-1,2-дихлорэтан, 1:1).
Противовирусные исследования и оценка цитостатической активности. Соединения были оценены в отношении следующих вирусов: цитомегаловирус человека (HCMV, штаммы AD-169 и Davis) и вирус ветряной оспы (VZV, штаммы OKA и YS). Противовирусные исследования основывались на ингибировании цитопатичного эффекта, вызванного вирусом или образования бляшек в культуре клеток легкого эмбриона человека (HEL) по опубликованной методике [22]. Исследования цитостатической активности также проводили методом, описанным ранее [22].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЯ
Получение исходных 1-[ω-(4-бромфенокси)алкил]-производных урацила 1–6 было описано ранее [15]. Синтез 1-[5-(3-бромфенокси)урацила (7) описан в работе Парамоновой и др. [21]. Получение целевых соединений нафталенил-метильного ряда заключалось в алкилировании 1-[ω-(фенокси)алкил]-производных урацила 1–7 1-(бромметил)нафталином (8, R3 = H), 2-(бромметил)нафталином (9, R3 = H) или 1-бром-2-(бромметил)нафталином (10, R3 = Br) в ранее описанных условиях [18, 23]. В растворе ДМФА в присутствии K2СО3 образовывались соответствующие 1-[ω-(фенокси)алкил]-3-(нафтален-1-илметил)- 11–14 или 3-(нафтален-2-илметил)-производные урацила 18, 19 (схема 1), выход которых был в пределах 74–89%.
Для изучения закономерности структура–противовирусная активность был синтезирован ряд аналогов. В частности, путем обработки урацила 1 бензилхлоридом (20) или 9-(хлорметил)антраценом (21) в растворе ДМФА в присутствии K2СО3 были получены 1-[5-(4-бромфенокси)пентил]-3-бензил- (22) и -(антрацен-9-илме-тил)урацилы (23), выход которых составил 81 и 79% (схема 2).
Еще одним аналогом явился 1-[5-(4-бромфенокси)пентил]-3-(нафтален-1-илметил)хиназолин-2,4(1H,3H)-дион (24). Исходный 1-[5-(4-бромфенокси)пентил] хиназолин-2,4(1H,3H)-дион (25) был получен путем алкилирования 4-х кратного мольного избытка хиназолин-2,4(1H,3H)-диона 1-бром-4-[(5-бромпентил)окси]бензола (26) в растворе ДМФА в присутствии К2СО3. 1-Замещенный хиназолин-2,4(1H,3H)-дион (25) действием 1-(бромметил)нафталином (8) с выходом 77% превращали в целевое соединение 24 (схема 3).
В заключение был получен изомер соединения 14 – 3-[5-(4-бромфенокси)пентил]-1-(нафтален-1-илметил)урацил (27). Его синтез включал стадию получения 1-(нафтален-1-илметил)урацила (28) путем конденсации 2,4-бис(триметилсилилокси)пиримидина с 1-(бромметил)нафталином (8) при кипячении в растворе безводного 1,2-дихлорэтана. Урацил 28 в растворе ДМФА в присутствии К2СО3 обрабатывали 1-бром-4-[(5-бромпентил)окси]бензолом (26), что вело с выходом 85% к целевому соединению 27 (схема 4).
Активность соединений оценивали в отношении вируса герпеса простого типа 1, вируса герпеса простого типа 2, вируса ветряной оспы, вируса осповакцины, респираторно-синцитиального вируса, вируса везикулярного стоматита, вируса Коксаки B4, вируса парагриппа 3, вируса гриппа A (подтипы H1N1, H3N2), вируса гриппа B, реовируса-1, вируса Синдбис, вируса Пунта Торо, а также в отношении HCMV (штаммы AD-169 и Davis).
Активность соединений 11–19, 22–24 и 27 в отношении HCMV была изучена в культуре HEL-клеток. Результаты исследования представлены в табл. 1. Обнаружено, что соединение 13 проявило заметную анти-HCMV-активность: оно блокировало репликацию вируса в концентрации (ЕС50) 2.19 µM (штаммы AD-169 и Davis), что заметно превосходило действие ганцикловира и было сравнимо с действием цидофовира. Соединения 11 и 12, имеющие короткий мостик, оказались менее эффективными ингибиторами репликации HCMV. Их ЕС50 было в пределах 8.94–10.94 µM. В то же время удлинение мостика до шести и особенно до восьми метиленовых групп вело к усилению цитотоксичности (соединения 14 и 15). Перемещение атома брома в 4-бромфеноксильном фрагменте из пара-положения в мета-положение вело к полной потере противовирусной активности (соединение 16). Тиминовый аналог соединения 13 (соединение 17) оказался более чем на порядок менее активным (ЕС50 44.72 и 48.9 µM для штаммов AD-169 и Davis соответственно). Нафтален-2-ильный аналог 18 и его 1-бром-производное 19 не проявили какой-либо ингибиторной активности. По-видимому, пространственное положение нафталинового фрагмента играет важную роль в проявлении противовирусных свойств. Замена нафталинового фрагмента на бензильный дало соединение 22 с достаточно интересными свойствами, ЕС50 которого составила 10.9 µM (штамм AD-169) и 15.3 µM (штамм Davis). 3-(Антрацен-9-илметил)-производное 23 оказалось полностью неактивным. Замена остатка урацила на хиназолин-2,4(1H,3H)-дионовый дало также неактивное соединение 24. Региоизомер соединения 13 – 3-[5-(4-бромфенокси)пентил]-1-(нафтален-1-илметил)урацил (соединение 27) оказался более чем на порядок менее активным в отношении HCMV.
Таблица 1.
Анти-HCMV свойства 3-арилметил-1-[ω-(бромфенокси)алкил]-производных урацила 11–19, 22–24 и 27
| Соединение | R1 | R2 | R3 | n | Противовирусная активность, EC50 (мкM)a | Цитотоксичность (мкМ) | ||
|---|---|---|---|---|---|---|---|---|
| AD-169 | Davis | Морфология клеток (МСС)b | Рост клеток (СС50)с | |||||
| 11 | H | 4-Br | H | 1 | 9.78 | 10.94 | 100 | >100 |
| 12 | H | 4-Br | H | 2 | 8.94 | 8.94 | 100 | 10.82 |
| 13 | H | 4-Br | H | 3 | 2.19 | 2.19 | >100 | 75.7 |
| 14 | H | 4-Br | H | 4 | >4 | 8.94 | 20 | – |
| 15 | H | 4-Br | H | 6 | >0.8 | 1.79 | 4 | – |
| 16 | H | 3-Br | H | 3 | >20 | >100 | 20 | – |
| 17 | Me | 4-Br | H | 3 | 44.72 | 48.9 | 100 | – |
| 18 | – | – | H | 3 | >4 | >4 | 20 | – |
| 19 | – | – | Br | 3 | >20 | >20 | 100 | – |
| 22 | – | – | – | – | 10.9 | 15.3 | 100 | >100 |
| 23 | – | – | – | – | >4 | >4 | 20 | – |
| 24 | – | – | – | – | >100 | >100 | >100 | – |
| 27 | – | – | – | – | 36.57 | 44.72 | >100 | – |
| Ганцикловир | – | – | – | – | 3.15 | 9.21 | >350 | >350 |
| Цидофовир | – | – | – | – | 1.49 | 1.49 | >300 | >300 |
ЗАКЛЮЧЕНИЕ
Таким образом, нами обнаружен ряд высокоактивных анти-HCMV агентов, которые подавляли репликацию HCMV в концентрациях, превосходящих действие ганцикловира и сравнимых с действием цидофовира. Результаты данного исследования послужат основой для создания высокоэффективного лекарственного средства для лечения HCMV инфекций.
Список литературы
Rodríguez-Goncer I., Fernández-Ruiz M., Aguado J.M. // Expert Rev. Anti. Infect. Ther. 2020. V. 18. P. 113–125.
Karrer U., Mekker A., Wanke K., Tchang V., Haeberli L. // Exp. Gerontol. 2009. V. 44. P. 689–694.
Jentzer A., Veyrard P., Roblin X., Saint-Sardos P., Rochereau N., Paul S., Bourlet T., Pozzetto B., Pillet S. // Microorganisms. 2020. V. 8. P. 1078.
Richardson A.K., Walker L.C., Cox B., Rollag H., Robin-son B.A., Morrin H., Pearson J.F., Potter J.D., Paterson M., Surcel H.M., Pukkala E., Currie M.J. // Clin. Transl. Oncol. 2020. V. 22. P. 585–602.
Lv Y.L., Han F.F., An Z.L., Jia Y., Xuan L.L., Gong L.L., Zhang W., Ren L.L., Yang S., Liu H., Liu L.H. // Intervirology. 2020. V. 63. P. 10–16.
Plotkin S.A., Boppana S.B. // Vaccine. 2019. V. 37. P. 7437–7442.
Permar S.R., Schleiss M.R., Plotkin S.A. // J. Virol. 2018. V. 92. P. e00030-18.
Kotton C.N. // Curr Opin Organ Transplant. 2019. V. 24. P. 469–475.
Sellar R.S., Peggs K.S. // Expert Opin. Biol. Ther. 2012. V. 12. P. 1161–1172.
Faure E., Galperine T., Cannesson O., Alain S., Gnemmi V., Goeminne C., Dewilde A., Béné J., Lasri M., Lessore de Sainte Foy C., Lionet A. // Medicine. 2016. V. 95. P. e5226.
Tan B.H. // Options Infect. Dis. 2014. V. 6. P. 256–270.
El Helou G., Razonable R.R. // Infect. Drug Resist. 2019. V. 12. P. 1481–1491.
Papanicolaou G.A., Silveira F.P., Langston A.A., Pereira M.R., Avery R.K., Uknis M., Wijatyk A., Wu J., Boeckh M., Marty F.M., Villano S. // Clin. Infect. Dis. 2019. V. 68. P. 1255–1264.
Piret J., Boivin G. // Antiviral Res. 2019. V. 163. P. 91–105.
Novikov M.S., Babkov D.A., Paramonova M.P., Khandazhinskaya A.L., Ozerov A.A., Chizhov A.O., Andrei G., Snoeck R., Balzarini J., Seley-Radtke K.L. // Bioorg. Med. Chem. 2013. V. 21. P. 4151–4157.
Babkov D.A., Khandazhinskaya A.L., Chizhov A.O., Andrei G., Snoeck R., Seley-Radtke K.L., Novikov M.S. // Bioorg. Med. Chem. 2015. V. 23. P. 7035–7044.
Maruyama T., Kozai S., Yamasaki T., Witvrouw M., Pannecouque C., Balzarini J., Snoeck R., Andrei G., De Clercq E. // Antivir. Chem. Chemother. 2003. V. 14. P. 271–279.
Maruyama T., Demizu Y., Kozai S., Witvrouw M., Pannecouque C., Balzarini J., Snoecks R., Andrei G., De Clercq E. // Nucleosides Nucleotides Nucleic Acids. 2007. V. 26. P. 1553–1558.
Novikov M.S., Valuev-Elliston V.T., Babkov D.A., Paramonova M.P., Ivanov A.V., Gavryushov S.A., Khandazhinskaya A.L., Kochetkov S.N., Pannecouque C., Andrei G., Snoeck R., Balzarini J., Seley-Radtke K.L. // Bioorg. Med. Chem. 2013. V. 21. P. 1150–1158.
Paramonova M.P., Khandazhinskaya A.L., Ozerov A.A., Kochetkov S.N., Snoeck R., Andrei G., Novikov M.S. // Acta Naturae. 2020. V. 12. P. 134–139.
Paramonova M.P., Snoeck R., Andrei G., Khandazhinskaya A.L., Novikov M.S. // Mendeleev Commun. 2020. V. 30. P. 602–603.
Snoeck R., Sakuma T., De Clercq E., Rosenberg I., Holy A. // Antimicrob. Agents Chemother. 1988. V. 32. P. 1839–1844.
Baker B.R., Kelley J.L. // J. Med. Chem. 1970. V. 13. P. 458–461.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни