Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 177-180
Исследование функциональной роли in vivo мутаций в ВТВ домене белка СР190 Drosophila melanogaster
А. А. Федотова 1, академик РАН П. Г. Георгиев 1, А. Н. Бончук 1, *
1 Федеральное государственное бюджетное учреждение науки Институт биологии гена Российской академии наук (ИБГ РАН)
Москва, Россия
* E-mail: bonchuk_a@genebiology.ru
Поступила в редакцию 24.10.2022
После доработки 15.11.2022
Принята к публикации 17.11.2022
- EDN: LZNLTA
- DOI: 10.31857/S2686738922600868
Аннотация
Транскрипционный фактор СР190 дрозофилы является одним из ключевых белков, определяющих активность промоторов генов домашнего хозяйства и инсуляторов. CP190 имеет N-концевой ВТВ домен, обеспечивающий димеризацию. Большая часть из известных архитектурных белков дрозофилы взаимодействуют с гидрофобной пептид-связывающей бороздкой в ВТВ домене, что, как предполагается, является одним из механизмов привлечения СР190 на регуляторные элементы. Для исследования роли ВТВ домена во взаимодействии с архитектурными белками были получены трансгенные линии, экспрессирующие варианты СР190 с мутациями в пептид-связывающей бороздке, что нарушает их взаимодействие с архитектурными белками. В результате проведенных исследований было выяснено, что мутации в ВТВ домене не влияют на связывание белка СР190 с политенными хромосомами. Таким образом, наши исследования подтверждают полученные ранее данные о том, что СР190 привлекается на регуляторные элементы при помощи нескольких транскрипционных факторов, взаимодействующих помимо ВТВ с другими доменами СР190.
Регуляция транскрипции у высших эукариот определяется функциональными взаимодействиями между энхансерами и промоторами, которые регулируются инсуляторами [1]. Белок СР190 участвует в организации большой группы активных промоторов генов домашнего хозяйства и известных инсуляторов дрозофилы [2, 3]. СР190 принимает участие в привлечении комплексов ремоделирования, открывающих хроматин в области регуляторных элементов [4, 5]. На N-конце белка СР190 находится ВТВ домен (рис. 1а), который образует стабильные гомодимеры и имеет высокий уровень гомологии с BTB доменами ДНК-связывающих транскрипционных факторов млекопитающих, таких как Bcl6 и PLZF [6, 7]. В центральной части белка СР190 находятся D и M домены, а также 4 цинковых пальца С2Н2 типа (рис. 1а), все эти домены, как и ВТВ домен, участвуют только в белок-белковых взаимодействиях и не принимают участие в связывании с ДНК [8]. Таким образом, в отличие от ВТВ-содержащих транскрипционных факторов млекопитающих, СР190 связывается с регуляторными элементами не напрямую, а с помощью ДНК-связывающих архитектурных белков [5, 9–12]. Было показано, что наиболее изученные архитектурные белки СTCF, Pita и Su(Hw) взаимодействуют с гидрофобной пептид-связывающей бороздкой в ВТВ домене белка СР190 [13]. Аналогичным образом ВТВ домены белков BCL6 и PLZF млекопитающих взаимодействуют с ко-репрессорными комплексами [14, 15]. В то время как Pita и Su(Hw) взаимодействуют только с ВТВ доменом [5, 11], белок CTCF одновременно взаимодействует с BТВ, D и M доменами [10, 13]. Наконец, существует большая группа архитектурных белков, которые взаимодействуют только с D и М доменами белка СР190 [13].
Рис. 1.
Исследование влияния мутаций в ВТВ домене белка СР190 на его связывание с геномными сайтами. (а) Доменная структура белка СР190. Указаны порядковые номера аминокислотных остатков, соответствующих границам доменов. (б) Схема генетических конструкций, используемых для создания трансгенных мух, экспрессирующих варианты белка CP190, слитые с FLAG-эпитопом. U – промотор Ubi63E; V – интрон; EJC – сайт соединения экзонов; SV40 – сигнал полиаденилирования SV40; attB – сайт φC31-опосредованной рекомбинации; yellow – безынтронный вариант гена yellow, используемый в качестве селективного маркера. (в) Вестерн-блот белковых экстрактов из 2–3 дневных самцов, экспрессирующих различные варианты белка CP190, окрашенные антителами к FLAG-эпитопу или ламину. (г) Политенные хромосомы слюнных желез личинок мух, экспрессирующих CP190wt, CP190V114A, CP190L118A на фоне мутаций Cp1902/Cp1903. Политенные хромосомы были окрашены антителами к белкам Su(Hw) [11] и CP190 [5]. Цифрами 1–4 показано положение одних и тех же геномных локусов на разных препаратах политенных хромосом. (д) Политенные хромосомы личинок мух, экспрессирующих слитые с FLAG белки CP190wt и CP190V7A, окрашенные антителами к CP190 и FLAG. Масштаб 10 мкм.
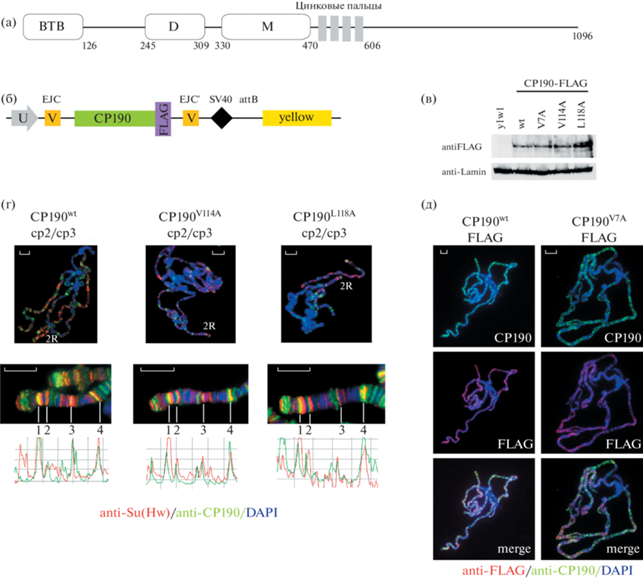
Целью настоящей работы является исследование функциональной роли взаимодействия ВТВ домена с архитектурными белками. Ранее было показано, что мутации V7A, V114A и L118A в гидрофобной бороздке имели наибольшее влияние на взаимодействие ВТВ домена с архитектурными белками Su(Hw), Pita и dCTCF [13]. Для исследования функциональной роли гидрофобной бороздки в рекрутировании СР190 на хроматин и осуществление других функций СР190, были созданы генетические конструкции, содержащие кДНК, кодирующую либо СР190 дикого типа (CP190wt), либо мутанты CP190 с 3×FLAG-эпитопом на С-конце под контролем сильного полиубиквитинового (Ubi) промотора с широким профилем экспрессии (Ubi-CP190wt, Ubi-CP190V114A, Ubi-CP190L118A; Ubi-CP190V7A) (рис. 1б). Для экспрессии СР190 белков все трансгенные векторы были вставлены в одну и ту же область 38D на 2-й хромосоме с использованием системы интеграции на основе φC31 [16]. С этой целью трансгенные конструкции были инъецированы в эмбрионы пребластодермы линии, которая содержит сайт для специфической системы интеграции в локусе 38D. Появившихся взрослых особей F0 скрещивали с мухами yacw1118, и потомство, несущее трансген в области 38D, идентифицировали по экспрессии маркерного гена yellow (пигментированная кутикула тела и крыльев).
Вестерн-блоттинг показал, что все варианты СР190 имели схожий уровень экспрессии в трансгенных линиях мух (рис. 1в). Для проверки того, как мутации в домене BTB влияют на функцию CP190 in vivo, были использованы ранее охарактеризованные ноль-мутации в гене Cp190: Cp1902 и Cp1903 [17]. У гетерозигот Cp1902/Cp1903 наблюдается личиночная смертность, но некоторые из мутантов доживают до поздней куколочной стадии [17].
Каждый трансген на второй хромосоме вводили на комбинацию мутаций Cp1902/Cp1903 (3 хромосома) с использованием линии, содержащей балансерные 2 и 3 хромосомы (CyO/If; Tm6,Tb/Sb). Даже введение одной копии конструкции CP190wt-FLAG приводило к полному восстановлению нормальной жизнеспособности Cp1902/Cp1903 мух. Линия Ubi-CP190wt/Ubi-CP190wt; Cp1902/Cp1903 была стабильна на протяжении не менее 10 поколений без изменений жизнеспособности или фенотипа. Аналогичные результаты были получены с трансгенами, экспрессирующими два мутантных варианта белка СР190 (CP190V114A и CP190 L118A). Таким образом, мутантные CP190V114A и CP190 L118A белки являются полностью функциональными, как CP190wt.
Для сравнения связывания с хроматином CP190wt и мутантных белков была использована модельная система политенных хромосом слюнных желез личинок. Белок СР190 связывается с большей частью междисков политенных хромосом, которые преимущественно соответствуют промоторам генов домашнего хозяйства [18, 19]. Было показано, что экспрессирующийся с трансгена белок CP190wt-FLAG демонстрирует паттерн связывания на политенных хромосомах, сходный с эндогенным белком CP190 (рис. 1д). Анализ распределения сайтов связывания мутантных белков CP190V114A и CP190L118A на политенных хромосомах показал, что связывание мутантных белков не отличалось от CP190wt на фоне генетических мутаций Cp1902/Cp1903 (рис. 1г). Таким образом, результаты, полученные на политенных хромосомах, показывают, что мутанты СР190 сохраняют способность эффективно связываться с хроматином.
В отличие CP190V114A и CP190L118A, экспрессия CP190V7A не приводит к восстановлению нормальной выживаемости Cp1902/Cp1903 линии. В потомстве от скрещивания Ubi-CP190V7A/CyO; Cp1902/CyO и Ubi-CP190V7A/CyO; Cp1903/CyO было получено среди 1748 потомков только 8 мух с генотипом Ubi-CP190V7A/CyO; Cp1902/Cp1903. Гомозиготы Cp1902/Cp1903 в основном погибали на стадии личинки. Выжившие Ubi-CP190V7A/CyO; Cp1902/Cp1903 имаго умерли через 5–8 дней после вылупления из куколок. При этом они были бесплодны и имели множественные фенотипические изменения: нарушение пропорций тела, уплощение грудной клетки, пузыри на крыльях. В отличие от мух, экспрессирующих белок CP190WT, не было найдено мух, гомозиготных по конструкции Ubi-CP190V7A, что позволяет предположить доминантно-негативное влияние сильной экспрессии мутантного CP190V7A белка на жизнеспособность мух.
Поскольку личинки Cp1902/Cp1903, экспрессирующие CP190V7A-FLAG, имели редуцированные слюнные железы и низкую политенизацию хромосом, было проведено сравнение связывания CP190wt-FLAG и CP190V7A-FLAG с политенными хромосомами у гетерозиготных Cp1902/+ личинок (рис. 1д). Существует вероятность того, что мутантный белок может димеризоваться с белком дикого типа через ВТВ домен, но недавнее исследование [20] демонстрирует, что BTB-домены предпочтительно моментально образуют гомодимеры со своей копией, транслируемой с той же мРНК. Меченные FLAG-эпитопом белки CP190wt и CP190V7A связывались со всеми видимыми сайтами CP190 на политенных хромосомах. Таким образом, замена V7A не влияет на стабильность мутантного белка или его способность связывать регуляторные элементы. Следовательно, мутация V7A нарушает функции белка СР190, которые не связаны с его способностью связываться с регуляторными элементами. Можно предположить, что мутация V7A приводит к нарушению связывания ВТВ домена с неизвестным транскрипционным комплексом. В таком случае связывание с промоторами мутантного белка CP190V7A может негативно влиять на транскрипцию.
В целом результаты демонстрируют, что нарушение взаимодействия архитектурных белков с ВТВV114A или ВТВL118A не влияет на способность мутантных вариантов СР190 связываться с геномными регуляторными элементами. Это можно объяснить тем, что CP190 имеет два дополнительных домена, D и M, которые участвуют во взаимодействии СР190 с некоторыми архитектурными белками [9, 13] (рис. 1а). Согласно нашей модели промоторы и инсуляторы состоят из различных комбинаций мотивов связывания архитектурных белков, значительная часть из которых может независимо рекрутировать белок СР190 [1]. В результате создается стабильный механизм функционирования регуляторных элементов, при котором ВТВ, D и М домены белка СР190 одновременно взаимодействуют с несколькими архитектурными белками на каждом промоторе.
Список литературы
Kyrchanova O., Georgiev P. // Int J Mol Sci. 2021. V. 22. № 2. P. 671.
Pai C.Y., Lei E.P., Ghosh D., Corces V.G. // Mol. Cell. 2004. V. 16. P. 737–748.
Cubenas-Potts C., Rowley M.J., Lyu X., et al. // Nucleic Acids Res. 2017. V. 45. № 4. P. 1714–1730.
Bartkuhn M., Straub T., Herold M., et al. // EMBO J. 2009. V. 28. P. 877–888.
Sabirov M., Kyrchanova O., Pokholkova G., et al. // Epigenetics Chromatin. 2021. V. 22. № 14 (1). P. 16.
Plevock K.M., Galletta B.J., Slep K.C., Rusan N.M. // PLoS One. 2015. V. 10. e0144174.
Bonchuk A., Denisov S., Georgiev P., Maksimenko O. // J Mol Biol. 2011. V. 23. № 412 (3). P. 423–36.
Oliver D., Sheehan B., South H. et al. // BMC Cell Biol. 2010. V. 11. P. 101.
Maksimenko O., Bartkuhn M., Stakhov V. et al. // Genome Res. 2015. V. 25. P. 89–99.
Kyrchanova O., Klimenko N., Postika N., et al. // Biochim Biophys Acta Gene Regul Mech. 2021. V. 1864. № 10. 194733.
Melnikova L., Kostyuchenko M., Molodina V., et al. // Chromosoma. 2018. V. 127. № 1. P. 59–71.
Bag I., Chen S., Rosin L.F., et al. // Nat. Commun. 2021. V. 12. P. 4170.
Sabirov M., Popovich A., Boyko K., et al. // Int J Mol Sci. 2021. V. 22. № 22. 12400.
Ahmad K., Melnick A., Lax S., et al. // Mol. Cell. 2003. V. 12. P. 1551–1564.
Ghetu A., Corcoran C., Cerchietti L., et al. // Mol. Cell. 2008. V. 29. P. 384–391.
Bischof J., Maeda R., Hediger M., et al. // Proc Natl Acad Sci U S A. 2007. V. 27. № 104 (9). P. 3312–7.
Butcher R., Chodagam S., Basto R., et al. // J Cell Sci. 2004. V. 117. Pt. 7. P. 1191–9.
Demakova O., Demakov S., Boldyreva L., et al. // Chromosoma. 2020. V. 129. № 1. P. 25–44.
Zykova T., Levitsky V., Belyaeva E., et al. // Curr. Genomics. 2018. V. 19. № 3. P. 179–191.
Bertolini M. et al. // Science. 2021. V. 371. P. 57–64.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


